淫羊藿苷对人牙囊干细胞旁分泌作用的影响
郑晓雪 王乙行 陶天翼 韩 冰
牙囊干细胞(dental follicle stem cell,DFSC)来自间充质组织,是一种牙源性干细胞,可从第三磨牙或多生牙牙囊中获取。与其他间充质干细胞类似,DFSC具有分泌多种生物活性因子的旁分泌功能,这些因子已被报道可以调节免疫、促进细胞增殖、迁移及血管生成等。收集间充质干细胞的培养上清,这些生物活性因子存在其中,称为条件培养基(conditioned medium,CM),可用于基于干细胞分泌细胞因子的无细胞疗法,具有广泛的应用价值。多项研究表明,多种牙源性干细胞CM可以促进细胞的增殖、迁移及成骨分化。来源于多生牙的DFSC-CM能否在骨再生中发挥作用尚不明确。淫羊藿苷(icariin, ICA)是淫羊藿中提取的有效单体。研究发现,ICA类似于雌激素,可以刺激骨形成,抑制骨吸收。ICA能否调控DFSC旁分泌功能,发挥定向成骨的作用,尚少见报道。本研究通过ICA诱导多生牙来源的DFSC,制备了DFSC-CM,并通过检测其对小鼠胚胎成骨细胞前体细胞(MC3T3-E1)增殖、迁移和成骨分化的影响,探究了ICA能否作为骨诱导因子,促进DFSC定向成骨的旁分泌作用。
材料与方法
1.主要试剂与仪器:高糖培养基、α-培养基购自美国HyClone公司;胎牛血清购自美国Gibco公司;Ⅰ型胶原酶购自德国Sigma公司;淫羊藿苷购自北京索莱宝科技有限公司;人间充质干细胞成脂诱导培养基购自广州赛业生物科技有限公司;β-甘油磷酸二钠购自北京酷来博科技有限公司;地塞米松和维生素C均购自上海源叶生物科技有限公司;兔抗波形丝蛋白、角蛋白8抗体、DAB试剂盒均购自沈阳万类生物有限公司;小鼠抗IGg、CD34、CD45、CD90、CD105抗体均购自美国Bio Legend公司;CCK-8、PCR试剂盒购自上海翌圣股份有限公司;酶标仪购自美国Thermo Fisher公司;流式细胞仪购自美国BD公司;倒置相差显微镜购自日本Olympus公司;荧光定量PCR仪购自美国Bio-Rad公司。
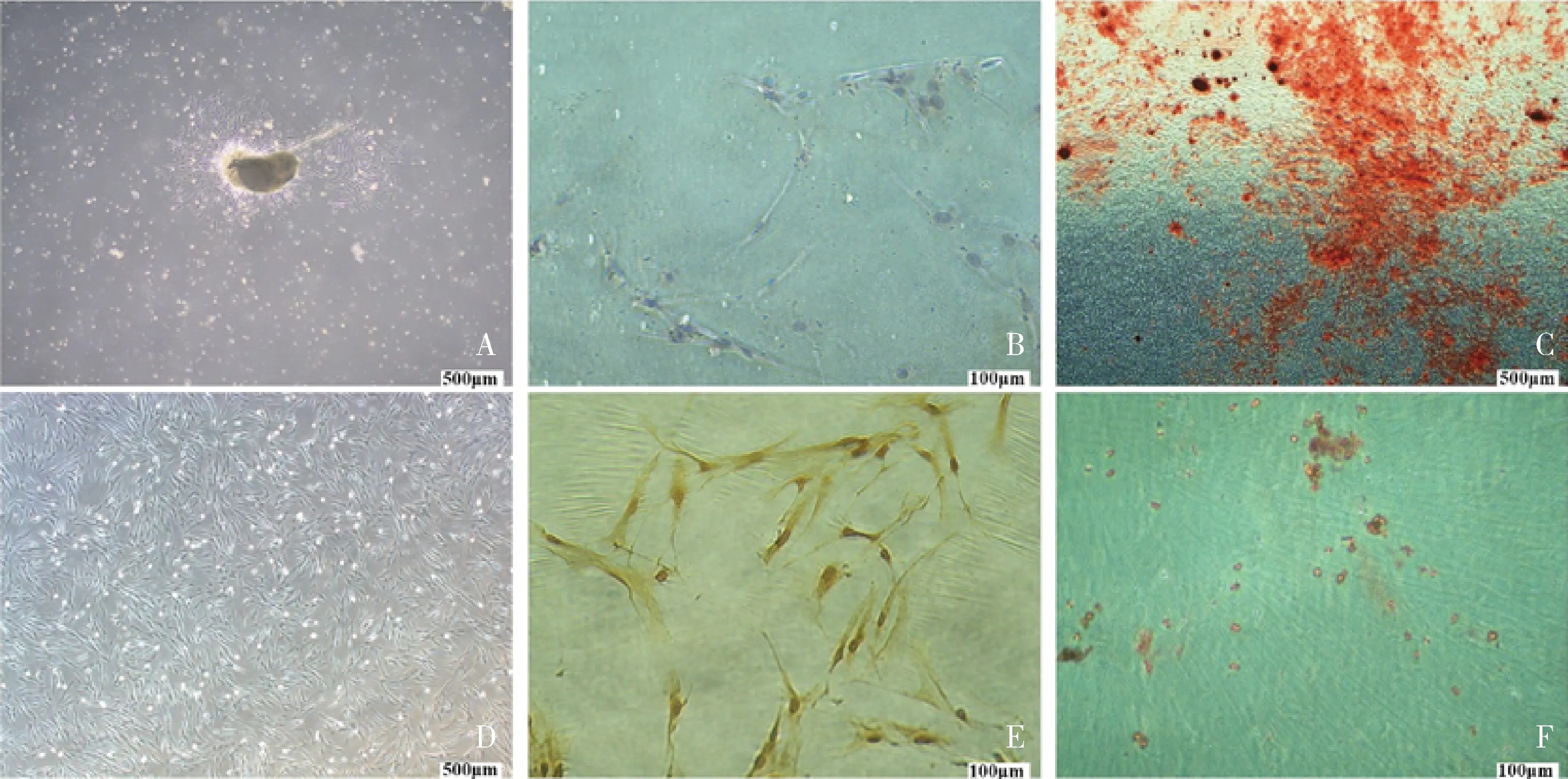
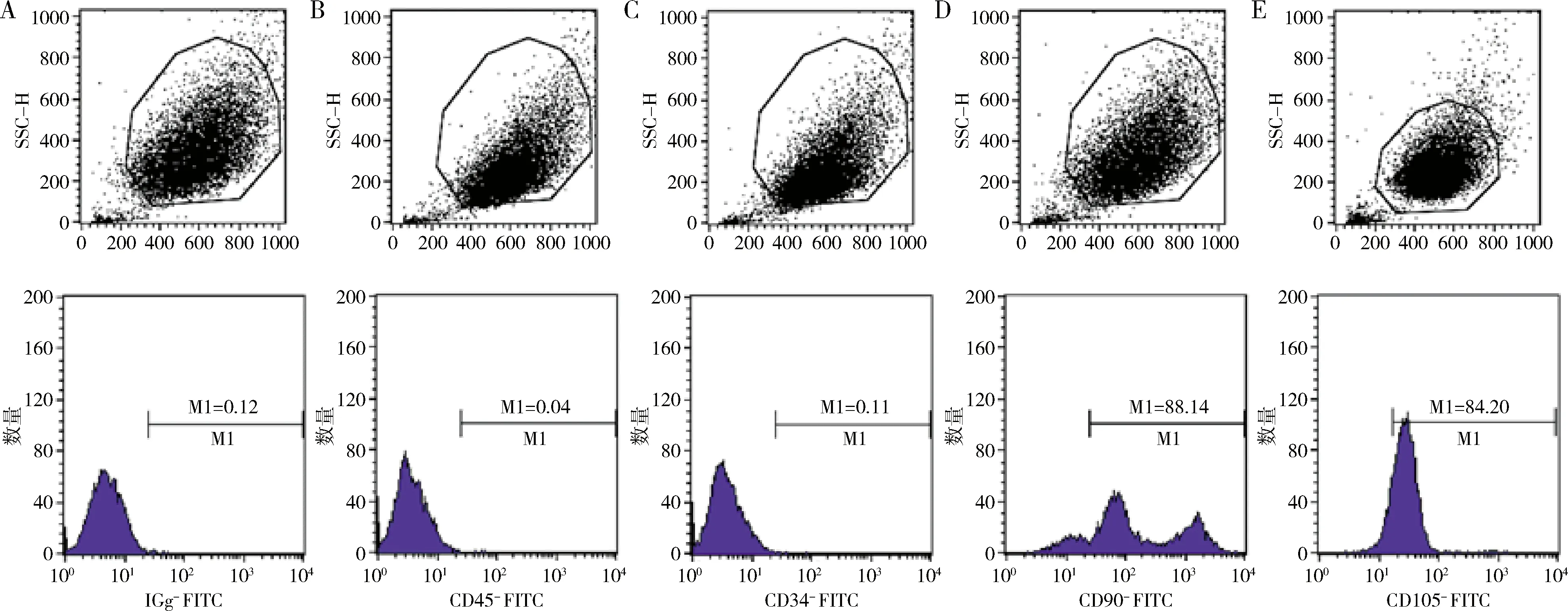
2.细胞分离、培养、鉴定:(1)MC3T3-E1(吉林省牙齿发育与颌骨重建与再生重点实验室赠予),用含10% FBS的高糖培养基于 37℃、5% CO细胞孵箱中培养。(2)提取原代DFSC:牙囊组织由吉林大学口腔医院口腔颌面外科提供,术前检测无传染性疾病,并经患儿家长知情同意。拔除多生牙的同时刮出牙囊组织,冰盒运至实验室。剪取约0.5cm×0.5cm大小,加入2.5g/L Ⅰ型胶原酶,消化30min,1000r/min离心5min。用含20% FBS、1%青霉素-链霉素混合液的α-培养基,放入细胞孵箱中培养。当细胞融合至90%,可1∶2传代,第3~5代DFSC进行后续实验。(3)细胞免疫化学:第4代DFSC,固定细胞20min,抗原修复后滴加1∶150 兔抗人波形丝蛋白抗体、1∶200兔抗人角蛋白8抗体,4℃孵育24h,次日用DAB试剂盒检测细胞着色情况。(4)流式细胞术:第4代DFSC,细胞密度为1×10个/100微升,加入5μl抗体,分别为IGg、CD34、CD45、CD90、CD105,IGg为同型对照,冰上孵育30min, 避光,清洗2次,400μl PBS重悬细胞沉淀,换用流式管,上机检测。(5)DFSC多向分化能力鉴定:第3代 DFSC,分别使用成骨诱导培养基(10mmol/L β-磷酸甘油二钠,50μg/ml维生素C,0.01μmol/L地塞米松)、成脂诱导培养基培养细胞21天,分别行茜素红、油红染色,显微镜下观察钙结节、脂滴形成情况。
3.制备DFSC-CM:第3~5代DFSC,当细胞融合度达90%时,加入0、1和10μmol/L ICA,换用无血清的α-培养基培养24h,以1000×离心收集的培养上清5min,去沉淀后分装,-80℃保存备用,与新鲜培养液1∶1 混合后用于后续实验。实验分为6组,分别为对照组(完全培养基)、0ICA-CM组(含0μmol/L ICA的DFSC-CM)、1ICA-CM组(含1μmol/L ICA的DFSC-CM)、10ICA-CM组(含10μmol/L ICA的DFSC-CM)、1ICA组(含1μmol/L ICA的完全培养基)、10ICA组(含10μmol/L ICA的完全培养基)。
4.细胞增殖检测:按照2×10个/孔的细胞密度将MC3T3-E1接种在96孔板上,放入孵箱中培养,次日更换实验组培养基。分别在培养的第1、3和5天时,取10μl的CCK-8检测液加入100μl的培养基中,1.5h后酶标仪检测450nm处的吸光度值。检测结束后,弃液,结晶紫染色30min,显微镜下拍照。
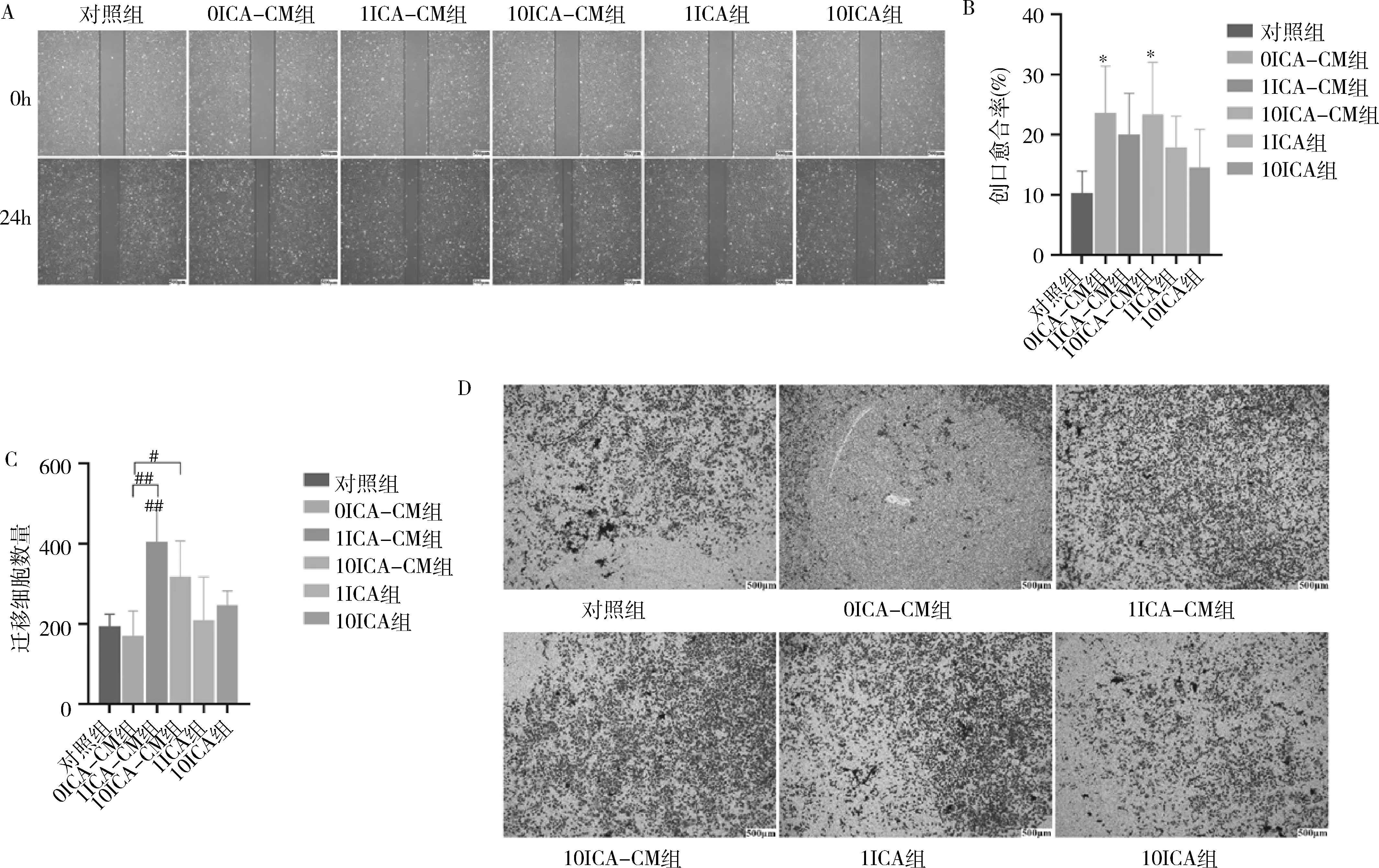
5.细胞迁移检测:(1)划痕实验:按20×10个/孔细胞密度将MC3T3-E1接种在预先底部水平画线的6孔板上,细胞长满后,用200μl枪头垂直水平线划开3处创口,PBS洗去划脱细胞,更换无血清实验组培养基,孵育24h后取出拍照,运用ImageJ软件计算创口愈合面积。(2)Transwell小室实验:选用24孔板小室,下室加入500μl实验组培养基,MC3T3-E1按2×10个/200微升置于上室,12h后固定,结晶紫染色拍照,运用ImageJ软件计算穿膜细胞数。
6.qRT-PCR检测成骨基因表达水平:按照20×10个/孔细胞密度将MC3T3-E1接种在6孔板上,使用成骨诱导培养基(5μmol/L β-磷酸甘油钠、50μg/ml维生素C、0.01μmol/L地塞米松)诱导7天,使用TRIeasy试剂分离总RNA,反转录合成为cDNA。在CFX96 RT-PCR检测系统中使用 SYBR-Green实时PCR预混液扩增mRNA。表1为引物序列,使用比较2方法计算基因的相对表达水平,3-磷酸甘油醛脱氢酶(GAPDH)用作内部对照。

结 果
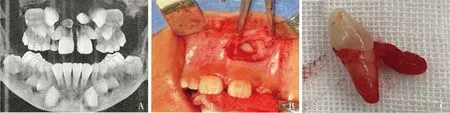
1.细胞分离及鉴定:本实验取自多生牙患者的牙囊组织(图1),原代培养3天,可见DFSC从组织块中爬出,呈长梭形(图2A),细胞集落呈旋涡状(图2D)。免疫细胞化学染色显示,当DFSC细胞质无着色,上皮标志物角蛋白8表达阴性(图2B);DFSC细胞质呈棕黄色,间充质标志物波形丝蛋白表达阳性(图2E)。成骨诱导后,DFSC内可见红色钙结节(图2C);成脂诱导后,DFSC可见到橙红色脂滴(图2F)。并且DFSC阳性表达间充质表面标志物CD90(88.14%)、CD105(84.20%),而阴性表达血液细胞表面标志物CD45(0.04%)、CD34(0.11%),同型对照IGg(0.12%)。图2、图3结果表明,埋伏多生牙来源的DFSC符合间充质干细胞特征。
2.ICA诱导的DFSC-CM对MC3T3-E1增殖影响:如图4A所示,1ICA组和10ICA组在第3天、第5天抑制了MC3T3-E1细胞活力(<0.01),然而10ICA-CM组在培养5天后仍未见明显毒性,0ICA-CM组与1ICA-CM组在第1天、3天、5天时细胞活力明显高于对照组(分别为<0.05、<0.01、<0.001)。结晶紫染色显示(图4B),0ICA-CM组与1ICA-CM组培养基在第3天、第5天时,细胞数量明显多于对照组,1ICA组和10ICA组在第5天时细胞数量明显减少。CCK-8实验和结晶紫染色实验结果相符合,因此表明,单纯的DFSC-CM可以促进MC3T3-E1的增殖,DFSC-CM缓解了高浓度ICA对MC3T3-E1的毒性作用。

3.ICA诱导的DFSC-CM促进了MC3T3-E1迁移:如图5中A、B示,MC3T3-E1在划痕创口形成24h后,0ICA-CM组、1ICA-CM组、10ICA-CM组划痕创口面积均较对照组小(对照组0.104±0.036;0ICA-CM组0.236±0.078,<0.05;1ICA-CM组0.200±0.069;10ICA-CM组0.234±0.087,<0.05)。Transwell结果表明,各组培养基培养MC3T3-E1 24h后,均有细胞迁移至下室,各CM组随着ICA诱导剂量的增加,呈现剂量依赖方式(对照组194.000±29.816;0ICA-CM组170.333±62.164;1ICA-CM组404.333±79.651,<0.01;10ICA-CM组318.000±88.792)。1μmol/L ICA诱导的DFSC-CM细胞迁移数量显著高于0μmol/L和10μmol/L ICA诱导的DFSC-CM(分别为<0.05、<0.01)。
4.ICA诱导的DFSC-CM上调了成骨标志基因的表达:与对照组比较,1ICA-CM组显著上调了RUNX2的表达水平(图6A,<0.001),在图6C中,0ICA-CM组和1ICA-CM组均上调了OCN表达水平(分别为<0.01、<0.001),且与0ICA-CM组比较,1ICA-CM组升高的更多(<0.01),图6D和图6C的结果相符,0ICA-CM组和1ICA-CM组均上调了OPN表达水平,差异均有统计学意义(均<0.001)。从qPCR结果可以看出,成骨诱导7天时,ICA诱导的DFSC-CM可以上调成骨标志基因的表达水平。

讨 论
多生牙在牙齿发育过程中属于数目异常。多生牙可以产生如恒牙迟萌,牙列不齐,颌骨囊肿等多种口腔颌面部发育的问题,本实验应用多生牙患者的牙囊提取牙囊干细胞,无取材和伦理限制,且患者年龄小(4~10周岁),细胞增殖活跃,多生牙来源的DFSC有可能成为间充质干细胞临床应用的候选种子细胞。
研究表明,间充质干细胞可分泌多种生物活性因子,如血小板生长因子、血管内皮生长因子等,通过细胞外囊泡或者条件培养基的形式改变组织细胞所处的微环境,促进周围干细胞的增殖、迁移及分化,从而发挥旁分泌作用。近年来研究发现,DFSC-CM可以促进牙周创口愈合,并且鼠DFSC-CM通过下调ERK1/2和NF-κB信号通路拯救发炎的大鼠牙髓再生。
研究表明,ICA常被作为骨诱导因子加载在支架或者纳米纤维膜上,通过持续可控的方式释放,在骨缺损的修复中得到了良好的修复效果。本研究利用ICA作为骨诱导因子,定向调节DFSC-CM的旁分泌作用,促进MC3T3-E1成骨分化。在增殖实验中,1ICA-CM组与0ICA-CM组比较,ICA与DFSC-CM之间并未起到协同促进MC3T3-E1增殖的作用。据文献报道,ICA促进鼠MSCs增殖浓度在0.01~0.10μmol/L。笔者前期实验结果也表明,不同种属对ICA的耐受程度不同,ICA(0.1~1.0μmol/L)可以促进人DFSC增殖,而ICA(5~20μmol/L)对人DFSC有抑制增殖并促进成骨作用。猜测原因可能是加入的ICA浓度是促进人DFSC成骨分化的最适浓度,DFSC-CM促进细胞增殖和促进细胞成骨可能存在不同的分子机制,因此ICA诱导DFSC旁分泌作用,释放更多调节成骨分化的细胞因子,而释放很少的促进增殖的细胞因子。
研究表明,缺损区创口的愈合、组织的生长、炎症的调节等生理活动都离不开细胞的迁移与趋化。本研究验证了DFSC-CM可以促进MC3T3-E1的横向与纵向迁移,说明ICA可以上调DFSC旁分泌作用促进MC3T3-E1迁移。
ALP、OCN、OPN、COL-1等骨特异性基质蛋白、RUNX2、OSX等转录因子的表达可以调控ICA诱导的骨形成。本研究发现,0ICA-CM组可以上调OCN及OPN的表达,并且1ICA-CM组与其他组比较,RUNX2、OCN、OPN的表达具有显著差异性。提示1μmol/L的ICA可能通过促进DFSC成骨的旁分泌作用,从而上调了MC3T3-E1的成骨相关基因的表达。
综上所述,多生牙来源的DFSC可能成为候选的种子细胞,ICA诱导的DFSC-CM可以促进MC3T3-E1迁移和成骨分化。ICA可能通过调控DFSC旁分泌作用来发挥效果,具体的分子机制需要进一步的实验研究来验证。

