双参芎连颗粒对动脉粥样硬化大鼠腹主动脉斑块的影响
李然,谢朋呈,辛高杰,李磊,任建勋,刘建勋,付建华,2
1.中国中医科学院西苑医院基础医学研究所,北京 100091;2.国家中医心血管疾病临床医学研究中心,北京100091
动脉粥样硬化(atherosclerosis,AS)是动脉硬化血管病中最重要的一种,其病变特点主要是由内膜开始出现复合糖类积聚和纤维组织增生,并伴有继发性病变及斑块破裂等。斑块的不稳定性可导致急性心肌梗死。双参芎连颗粒是本课题组根据AS病机特点拟定的方剂,具有益气活血、化痰解毒功效。前期研究发现,双参芎连颗粒可调节AS大鼠脂质代谢,减轻炎症反应,抑制细胞凋亡。本实验采用高脂饲料喂养联合腹主动脉拉伤法制备AS大鼠模型,进一步观察双参芎连颗粒对大鼠腹主动脉粥样硬化斑块的影响,明确其改善AS的作用机制。
1 材料与方法
1.1 动物
健康SPF级SD大鼠202只,雄性,体质量(230±10)g,北京维通利华实验动物技术有限公司提供,动物许可证号SCXK(京)2012-0001。饲养于中国中医科学院西苑医院SPF级实验动物中心,温度20~25 ℃,相对湿度40%~70%,12 h光暗循环,自由摄食饮水。髙脂饲料,北京科澳协力饲料有限公司,含78.35%普通饲料、2% L-蛋氨酸、2%胆固醇、0.5%胆酸钠、0.15%丙硫氧嘧啶、7%猪油、5%蛋黄粉和5%全脂奶粉。
1.2 药物
双参芎连颗粒(人参、川芎、黄连、泽泻等),由中国中医科学院西苑医院基础医学研究所提供,批号20111012,1 g颗粒相当于原药材2.44 g,用蒸馏水配制成浓度分别为0.08、0.16、0.32 g/mL。丹蒌片,吉林康奈尔药业有限责任公司,0.3 g/片,批号20110702,实验时用蒸馏水配制成0.08 g/mL溶液。舒降之片,杭州默沙东制药有限公司,20 mg/片,批号110594,用蒸馏水配制成浓度为0.4 mg/mL。
1.3 主要试剂与仪器
同型半胱氨酸(Hcy)对照品,美国Sigma公司,批号037K3798,纯度>95%;辛烷基磺酸钠,美国Thermo Fisher Scientific公司,批号0 800739;磷酸氢二铵,分析纯,天津光复精细化工研究所,批号20 190512;甲醇,分析纯,美国Thermo Fisher,批号 095586;乙二胺四乙酸二钠(EDTA-2Na),美国Sigma,批号 950511;二硫苏糖醇,美国Sigma,批号 925512;PBS,北京索莱宝科技有限公司,批号20 190425;基质金属蛋白酶2(MMP-2)抗体、核因子(NF)-κB p65抗体、p-NF-κB p65抗体,美国Proteintech公司,批号分 别 为10373-2-AP、CL488-54535、10625-1-AP;2.0F 动脉取血栓导管,美国Fogarty 公司,批号58867347。MIKRO-22R 高速台式冷冻离心机,德国Hettich 公司;BX-41 光学显微镜,日本OLYMPUS;VE186型电泳槽,美国Bio-Rad公司;MPIAS-500型多媒体彩色病理图文分析系统,北京正恒博诚科技发展有限公司;16通道Coularray库伦阵列式电化学高效液相色谱仪、5600A电化学检测器、582液相泵,美国ESA公司。
1.4 造模、分组及给药
186只大鼠适应性饲养7 d后随机选取36只作为空白组,予普通饲料喂养,其余大鼠予高脂饲料喂养,连续4周。第4周从空白组和高脂饲料喂养大鼠中随机抽取10只心脏取血,4 ℃、3 000 r/min离心15 min,分离血清,测定血清总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)含量。确定大鼠TC、LDL-C含量明显升高后,将高脂饲料喂养的大鼠腹腔注射水合氯醛麻醉,沿颈前正中线无菌切开皮肤,暴露颈前三角区左侧颈总动脉,结扎远心端,微动脉夹阻断近心端,用眼科剪剪一“V”形切口,插入2.0F动脉取血栓导管(预先用肝素钠生理盐水浸润),插入深度15 cm。向球囊内打气使其充分扩张至有阻力感,匀速回拉球囊8~10 cm,重复上述操作5次。操作完成后回抽球囊内气体,撤出球囊导管,结扎左侧颈总动脉近心端,无菌缝合切口,局部予青霉素生理盐水消毒。
将手术大鼠随机分为模型组、丹蒌片组、舒降之组和双参芎连颗粒低、中、高剂量组,每组26只。术后3 d开始给药,丹蒌片组予丹蒌片溶液0.8 g/kg灌胃,舒降之组予舒降之溶液4 mg/kg灌胃,双参芎连颗粒低、中、高剂量组予不同浓度双参芎连颗粒溶液灌胃,给药剂量分别为0.8、1.6、3.2 g/kg(按颗粒计),灌胃体积1 mL/100 g,每日1次,连续8周,空白组和模型组予等体积蒸馏水灌胃。除空白组外,给药期间其余各组大鼠继续高脂饲料喂养。
1.5 取材
给药第2、4、6、8周分批腹腔注射水合氯醛麻醉大鼠,腹主动脉取血1 mL,加入100 μL EDTA-2Na抗凝,20 ℃、2 500 r/min离心25 min,分离大鼠血浆,冻存备用。分离腹主动脉,一部分置于-80 ℃冰箱冻存,用于Western blot检测,另一部分置于10%中性福尔马林固定,用于HE染色及免疫组化分析。
1.6 HE染色
取出固定后的腹主动脉组织,选取6段不同位置腹主动脉(每段约5 mm),石蜡包埋,切片,HE染色,显微镜下观察,应用显微数码图像拍摄系统拍摄腹主动脉粥样硬化斑块面积最大处,计算校正斑块面积和管腔狭窄率。校正斑块面积(%)=斑块面积÷斑块部位外弹性膜内面积×100%,管腔狭窄率(%)=斑块面积÷斑块部位内弹性膜内面积×100%。
1.7 血浆同型半胱氨酸含量测定
取200 μL血浆加入新鲜配制的0.05 mol/L二硫苏糖醇溶液50 μL,室温放置还原20 min,加入0.3 mol/L高氯酸800 μL沉淀蛋白,4 ℃、15 000 r/min离心20 min,取上清液,用0.22 μm微孔滤膜过滤,即得大鼠血浆样品。
色谱条件:采用Waters-Spherisorb ODS2 色谱柱(4.6 mm×250 mm,5 μm),流动相为10 mmol/L磷酸氢二铵-12 mmol/L辛烷基磺酸钠-10%甲醇(pH 2.33±0.01),流速1 mL/min,电势+450 mV、+800 mV,柱温30 ℃,进样量10 μL。
1.8 免疫组化染色
腹主动脉组织石蜡切片于75 ℃烘箱中烤片85 min,二甲苯Ⅰ、二甲苯Ⅱ分别浸泡30 min脱蜡;100%乙醇Ⅰ、100%乙醇Ⅱ各浸泡10 min,95%乙醇、85%乙醇、80%乙醇浸泡5 min 水化;蒸馏水洗3 次,每次2 min,PBS洗3次,每次5 min;高压锅煮沸枸橼酸钠溶液,高压120 s进行抗原修复;滴加MMP-2一抗(1∶100),4 ℃冰箱过夜;次日室温恢复30 min,PBS洗3次,每次5 min;滴加二抗,室温孵育45 min;PBS清洗,DAB显色,蒸馏水冲洗2次;80%乙醇、85%乙醇、95%乙醇、100%乙醇Ⅰ、100%乙醇Ⅱ浸泡10 min,二甲苯Ⅰ、二甲苯Ⅱ浸泡10 min脱水透明,中性树脂封片;显微镜下观察,阳性表达为棕色颗粒,计算斑块位置阳性表达的平均光密度。
1.9 Western blot检测
用PBS缓冲液裂解腹主动脉组织提取总蛋白,以牛血清白蛋白作为标准品,按蛋白定量试剂盒说明书绘制标准曲线,紫外分光光度计波长562 nm处测定光密度,计算蛋白浓度。聚丙烯酰胺凝胶电泳分离,电转至硝酸纤维素膜上,牛血清白蛋白室温封闭30 min,加入NF-κB p65和p-NF-κB p65多克隆抗体(1∶2 000),4 ℃孵育过夜。加入HRP标记二抗(1∶2 000),室温孵育1 h。化学发光法显影,用图像分析系统测定蛋白灰度值,以GAPDH为内参,计算蛋白相对表达量。
1.10 统计学方法

2 结果
2.1 双参芎连颗粒对模型大鼠校正斑块面积和管腔狭窄率的影响
与空白组同一时点比较,模型组大鼠腹主动脉组织校正斑块面积增加、管腔狭窄率显著升高(<0.01);与模型组同一时点比较,双参芎连颗粒高剂量组、丹蒌片组和舒降之组大鼠给药第6、8周腹主动脉组织校正斑块面积减少、管腔狭窄率降低(<0.05,<0.01)。见图1、表1、表2。

表1 各组大鼠不同时点校正斑块面积比较(,%)

表2 各组大鼠不同时点管腔狭窄率比较(,%)
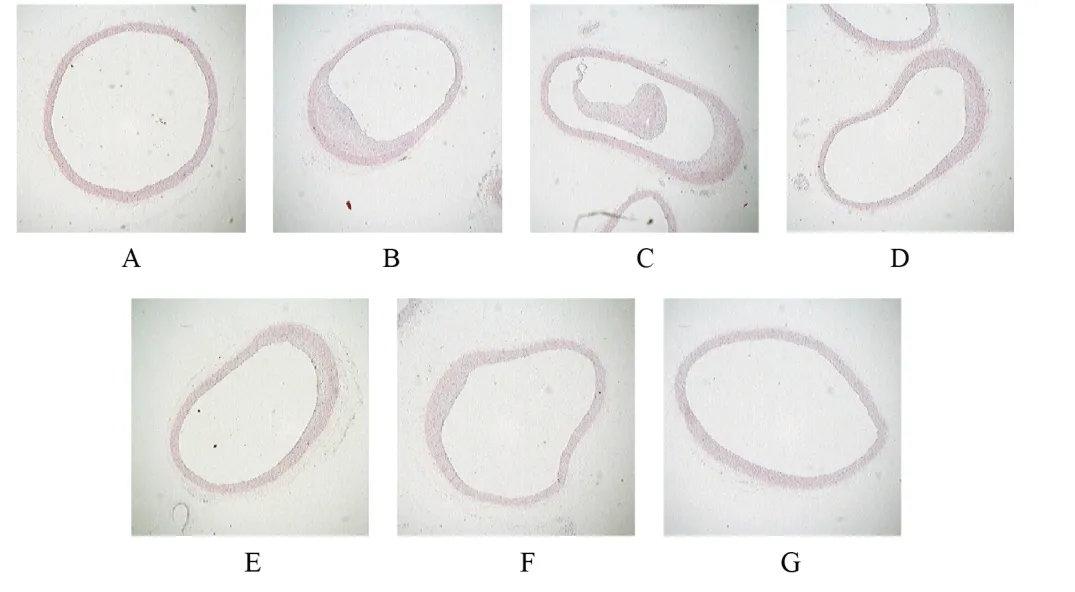
图1 各组大鼠腹主动脉组织形态(HE染色,×40)
2.2 双参芎连颗粒对模型大鼠血浆同型半胱氨酸含量的影响
与空白组同一时点比较,模型组大鼠各时点血浆Hcy含量显著增加(<0.05,<0.01);与模型组同一时点比较,各给药组大鼠第6、8周血浆Hcy含量显著减少(<0.05,<0.01)。见表3。

表3 各组大鼠不同时点血浆Hcy含量比较(,μmol/L)
2.3 双参芎连颗粒对模型大鼠腹主动脉组织基质金属蛋白酶-2表达的影响
与空白组比较,模型组第8周大鼠腹主动脉组织MMP-2表达显著升高(<0.01);与模型组比较,各给药组第8周大鼠腹主动脉组织MMP-2表达显著降低(<0.01)。见表4、图2。

图2 各组大鼠腹主动脉组织MMP-2阳性表达(免疫组化染色,×200)

表4 各组大鼠腹主动脉组织MMP-2表达比较()
2.4 双参芎连颗粒对模型大鼠腹主动脉组织核转录因子-κB p65表达的影响
与空白组比较,模型组大鼠第8周腹主动脉组织p-NF-κB p65/NF-κB p65比值升高,差异有统计学意义(<0.01);与模型组比较,各给药组大鼠第8 周腹主动脉组织p-NF-κB p65/NF-κB p65比值降低,差异有统计学意义(<0.01)。见图3、表5。

图3 各组大鼠腹主动脉组织NF-κB p65、p-NF-κB p65蛋白免疫印迹

表5 各组大鼠腹主动脉组织p-NF-κB p65/NF-κB p65比值比较()
3 讨论
AS是急性冠状动脉综合征及脑卒中的主要病理机制,尤其斑块的稳定性被认为是影响AS重大心血管不良事件的关键因素。动脉硬化斑块分为稳定斑块和不稳定斑块,不稳定斑块即易损斑块,具有血栓形成倾向。易损斑块的主要特点包括脂质核心增大伴纤维帽变薄、炎症标志物(单核/巨噬细胞聚集,伴或不伴T淋巴细胞浸润)、斑块撕裂、内皮细胞脱落伴表层血小板聚集等,其他少见特点如斑块浅表处钙化结节、斑块内出血、斑块所在血管正性扩张等。本实验结果显示,随着给药时间延长,各给药组大鼠校正斑块面积减少、管腔狭窄率不同程度降低,其中以丹蒌片组、舒降之组和双参芎连颗粒高剂量组作用明显。
有研究显示,体内Hcy含量增加可加速AS发展,促进斑块破裂形成血栓,引起心脑血管疾病。血浆Hcy含量增加与Hcy代谢酶异常及参与Hcy代谢维生素缺乏等有关。研究表明,高Hcy血症导致AS的主要机制是通过在代谢过程中发生自身氧化,进而损害血管内皮细胞结构和功能,导致内皮细胞凋亡。Hcy也是一种炎症因子,可加速血管弹性纤维溶解,促进胶原纤维合成及平滑肌细胞增殖,进而加速AS发生发展。Hcy主要为蛋氨酸脱甲基后生成的代谢产物,本实验所用高脂饲料中加入蛋氨酸,造成大鼠高Hcy血症,各时点模型组大鼠血浆Hcy含量均高于空白组,而给药后血浆Hcy含量有不同程度降低。
AS发病早期,高脂血症引起血管内皮细胞功能改变,使内皮细胞活化,中性粒细胞、淋巴细胞及单核巨噬细胞黏附并释放多种细胞因子,如白细胞介素-1、血小板衍生生长因子等,从而产生MMP。纤维斑块时期,血管组织抗损伤作用启动,中性粒细胞和巨噬细胞同时释放MMP及金属蛋白酶组织抑制因子,限制MMP降解,纤维斑块中MMP活性持续增强,降解胶原纤维,使纤维帽变薄,斑块不稳定性增加。MMP-2可特异性分解多种细胞外基质,包括弹性蛋白、层黏连蛋白等,其对AS斑块的影响主要有通过降解包绕在中层平滑肌细胞外的基质,促进血管中层平滑肌细胞向内膜迁移,从而分泌更多细胞外基质;降解细胞外基质使纤维帽变薄,减弱抵抗应力作用,使AS斑块易发生破裂;破坏细胞与基质之间的相互作用,促进血管平滑肌细胞释放肿瘤坏死因子,从而加速AS 发展。本实验结果显示,MMP-2在AS斑块的内皮细胞和平滑肌细胞中大量表达,并在间质中沉积,尤其斑块肩部、纤维帽部表达密集,双参芎连颗粒能有效降低AS斑块中MMP-2表达。
炎性反应是引起斑块易损的主要驱动力,而调节炎症最重要的转录因子是NF-κB。NF-κB活化并转移至核内,启动促炎因子转录和表达,促进炎症因子大量释放。炎症因子可以引起巨噬细胞分化和浸润、平滑肌细胞迁移和增殖、MMP-2/9表达升高。本实验结果显示,双参芎连颗粒可降低模型大鼠腹主动脉组织p-NF-κB p65/NF-κB p65比值,抑制NF-κB p65磷酸化后激活的一系列炎症反应。
综上,双参芎连颗粒可降低AS大鼠腹主动脉斑块面积和管腔狭窄率,通过降低血浆Hcy含量、斑块组织MMP-2表达及NF-κB p65磷酸化水平稳定AS斑块。

