锌-2银-0.4镁多孔合金支架的体外生物相容性、成骨性及抗菌性能评价
王顺,冯微,廖燚,夏海军,张德华,毛峰,王健
(1.新疆克拉玛依市中心医院骨科中心,新疆 克拉玛依市 834000;2.新疆克拉玛依市中心医院神经内科,新疆 克拉玛依市 834000;3.同济大学附属同济医院骨科,上海 200092)
骨科应用可吸收内植物的历史非常悠久,最早在1 900年Payer就将金属镁制作为内固定器械应用于动物实验中进行骨修复,到今已有100多年历史,期间人们进行了大量的研究[1]。2014年,郑玉峰教授提出了可生物降解金属植入物的概念,也就是在活体内可以逐步降解,机体对降解产物反应和谐,材料最终完全消失,局部组织损伤得到修复[2]。
2016年,美国材料与试验协会(American Society for Testing and Materials,ASTM)给出了ASTM-F3160标准,为可生物降解金属植入物应满足植入的金属可以直接降解,或者可以通过设定好的途径进行降解,最终被细胞或者组织完全代谢或者吸收。对体内可生物降解金属的要求是100%的可降解性及100%的生物相容性[3-4]。主要的金属合金有三种,包括铁合金、镁合金及锌合金,铁合金降解速度过慢,镁合金的降解速率过快,且局部易产生氢,因此人们逐步将研究工作转向锌合金[5-6]。
骨组织缺损是指因创伤、炎症、骨病所致的骨质短缺,超过临界尺寸(>骨直径1.5倍)的骨组织缺失称为骨缺损,这种骨缺损超过自体修复的临界状态,常造成骨吸收、骨不连、延迟愈合或不愈合,最终导致局部功能障碍,给患者带来巨大痛苦。目前,临床治疗骨缺损的金标准是自体骨移植[7-8]。骨移植在临床应用中受到较多限制,常见原因有:来源有限且获得自体骨组织时增加了患者其他部位的创伤、继发感染、慢性疼痛、骨折等;同种异体骨移植临床应用受限,是因为其具有发生传染疾病和产生免疫排异反应的可能。因此,自体骨移植与同种异体骨移植的临床应用均受到较多限制。随着材料和生物科学的发展,应用骨组织工程理念发展起来的生物替代品有望实现骨缺损重建、修复,甚至改善骨组织功能的目的[9-10]。
本文制备了一种锌基合金,为了提高其成骨性,加入了镁元素,为了提高其抗菌性能,加入了银元素,通过对其体外生物相容性、抗菌性及成骨活性的检测,为骨组织工程验证一种新的锌基合金,为进一步开展骨组织工程支架的研究提供新的思路。
1 资料与方法
1.1 主要试剂及仪器 本文研究所用的主要试剂包括细胞计数试剂(cell counting kit-8,CCK-8)(C0038,碧云天)盒,0.25% Trypsin-乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)(25200-072,Gibco),胎牛血清(FBS,10270106,Gibco),α-MEM培养基(12571089,Gibco),磷酸缓冲盐溶液(phosphate buffered saline,PBS)(20012,吉诺生物),鬼笔环肽(FITC Phalloidin)(40735ES75,YEASEN),青-链霉素(BL505A,Biosharp),多聚甲醛(80096618,国药试剂),TritonX-100(30188970,国药试剂),DAPI荧光染料(Sigma),碱性磷酸酶(alkaline phosphatase,ALP)检测试剂盒(TE0007,LEAGENE)。
研究中应用的主要仪器包括生物安全柜(HFsafe-1200C,Heal Force);CO2培养箱(HF 90,Heal Force);冰箱(BCD-189Z,Haier);荧光显微镜(BX53,Olmpus);全波长酶标仪(Multiskan GO,Thermo),多功能酶标仪(MULTISCAN GO,Thermo),手持电动匀浆器(S-18KS,莱普特)。
1.2 锌-2银-0.4镁三元合金多孔支架的制备及初筛 合金原材料的准备:纯锌、纯镁、纯银及合金材料由宁波博威合金材料股份有限公司制备,选择99.99wt.%纯锌、99.99wt.%纯镁、99.99wt.%纯银作为合金材料;将纯锌、纯镁、纯银按照锌-2银-0.4镁(wt.%)的比率称重,混合后置于温度为650℃的圆柱形石墨坩埚内,Ar+2%六氟化硫(SF6)保护环境下高温熔化并搅拌10 min使之充分混匀,随后倒入预热至100℃的低碳钢模具内,获得合金铸锭。
采用电感耦合等离子体原子发射光谱仪(7700 ICPMS,Agilent)测量合金中各组成的质量百分比。筛分一定尺寸的NaCl颗粒,在一定的压力和温度下进行烧结获得NaCl预制体。将铸锭置于NaCl预制体模具之上,加热至430℃左右,待合金完全熔化后,通过压力浸渗工艺获得锌合金与预制体的复合体,采用流水清洗,去除NaCl预制体获得锌合金多孔支架[6]。
1.3 细胞毒性测试 实验采用小鼠颅顶前成骨细胞株(MC3T3-E1),P/S(Gibco)。采用第3-8代细胞,培养箱要求含有5% CO2且温度控制在37℃。细胞培养基采用α-MEM(Gibco,USA),含10%胎牛血清(FBS,Gibco)以及100 unit P/S(Gibco)。采用噻唑蓝法(methyl thiazolyl tetrazolium,MTT)测试细胞毒性。
1.4 细胞黏附 将MC3T3-E1细胞悬液浓度稀释至1×104/mL,样品经过紫外消毒后分别放入24孔板中,每孔加入1 mL细胞悬液,在细胞培养箱中培养6 h、1 d、3 d。细胞在材料表面黏附形貌分别采用Live/Dead染色法和扫描电镜观察。
1.5 细胞骨架染色 采用Alexa Fluor 488染料和DAPI染料分别用于细胞骨架染色和细胞核染色,激发波长分别为488 nm和340 nm。
1.6 细胞迁移 将MC3T3-E1细胞悬液浓度稀释至5×104/mL,以2 mL/孔接种于6孔板中培养24 h,用20 μL枪头在细胞层中划出直径约250 μm的线。吸出培养基,加入浸提液2 mL。再培养6 h、12 h、24 h并在显微镜下观察细胞在划线处的迁移情况,使用Imaje J软件测量的面积缩小比率。
1.7 ALP表达水平 稀释MC3T3-E1细胞悬液浓度至5×103/mL,以2 mL/孔接种于6孔板中。培养24 h,吸出培养基,加诱导浸提液2 mL。每3天更换1次诱导浸提液,继续培养1、2、3周,吸光度值/总蛋白含量即为ALP表达水平。
1.8 矿化及Ⅰ型胶原染色 矿化采用溶度为40 mmol/L茜素红染色,pH值用氨水调整至4.2,Ⅰ型胶原表达检测采用溶度为0.1%的天狼星红染色。稀释MC3T3-E1细胞悬液浓度为5×103/mL,以2 mL/孔接种于6孔板中。培养24 h,吸出培养基,加诱导浸提液2 mL,之后再培养2周。2.5%戊二醛作用30 min,PBS试剂清洗2次进行固定。采用天狼星红染液或者茜素红染液染色30 min,PBS试剂清洗2次,显微镜下观察。
1.9 锌合金支架的体外抗菌性能评价 金葡菌及表葡菌购自中国普通微生物菌种保藏管理中心,将金葡菌和表葡菌分别接种于胰豆酵母提取物培养基中与锌-2银-0.4镁合金支架在生物反应器内共培养,PBS液洗脱未贴附于支架表面的细菌,将支架连同贴壁的细菌以20 kHz 超声浴处理15 min,使贴壁的细菌与支架完全分离,并收集起来用于后续量化,以live-dead染色及细胞核计数仪测定贴附于支架表面的细菌数量及活性,并与对照组比较。
1.10 锌合金的体外成骨诱导性能评估 锌合金支架与成骨细胞共培养,采用Western-blot和逆转录聚合酶链式反应(reverse transcriotion-polymerase chain reaction,RT-PCR)方法分别测定锌合金组织工程支架对细胞骨相关基因和Osterix蛋白(OSX)、骨钙素(osteocalcin,OC)的表达,在分子水平上研究锌合金组织工程支架降解对成骨细胞增殖、分化和矿化功能的影响,探讨骨响应机理。
2 结 果
2.1 细胞毒性检测 细胞毒性检测结果显示锌银镁合金具备较低的细胞毒性,与对照组接近(见图1),实验采用的1/8浸提液进行细菌培养,这符合目前常见的浸提液浓度的稀释,也符合人体内浸提液浓度的梯度选择。
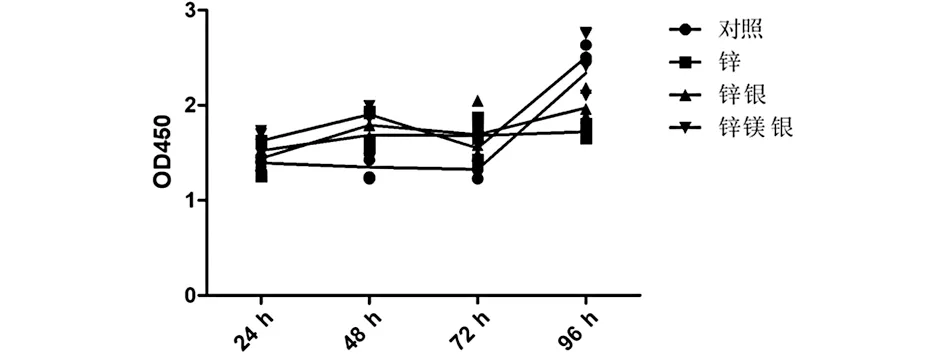
图1 细胞毒性检测
2.2 细胞骨架染色 用荧光标记的鬼笔环肽染色可以清晰地显示细胞中微丝的分布,进而表达细胞的活性(见图2),最终的细胞计数实验结果进一步证实了锌银镁合金具备更低的毒性,因而具备更优的细胞相容性(见图3)。
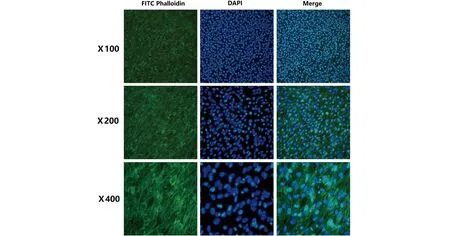
a 对照组
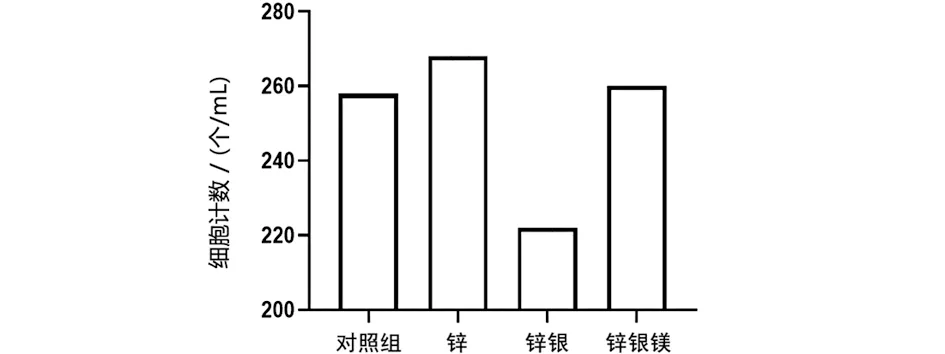
图3 细胞骨架染色结果
2.3 细胞迁移检测 细胞迁移指细胞在接收到迁移信号或感受到某些物质的浓度梯度后而产生的移动。过程中细胞不断重复着向前方伸出突足,然后牵拉胞体的循环过程。
分组细胞培养细胞铺于6孔板中,贴壁24 h后,用20 μL枪头在细胞层中划出约250 μm宽的划痕。24 h拍照记录划痕处的细胞迁移情况。使用Image J软件打开图片后,随机划取6~8条水平线,计算细胞间距离的均值。细胞划痕24h后观察到对照组细胞划痕宽度恢复至35%,锌组24%,锌银组27%,锌银镁组33%,说明锌银镁组相对于锌组、锌银组细胞能力更好,进一步证实了锌银镁合金具备更优的细胞相容性(见图4~5)。
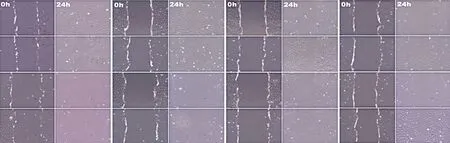
a 对照组 b 锌组 c 锌银组 d 锌银镁组
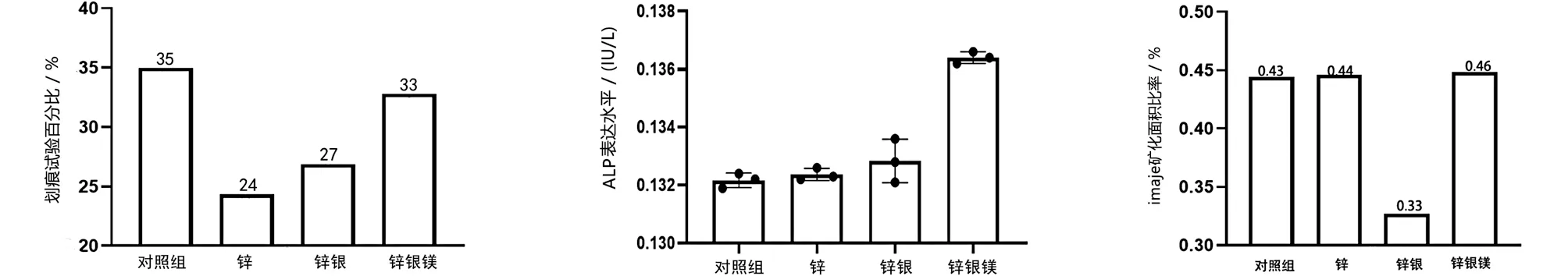
图5 划痕试验面积缩小百分比 图6 ALP表达水平比较 图7 imaje矿化面积比率
2.4 ALP表达水平检测 对照组、锌组、锌银组、锌银镁组ALP表达水平比较,结果显示ALP表达水平与成骨性密切相关,证实锌银镁合金具备更优的成骨性(见图6) 。
2.5 茜素红染色 Imaje J软件测量四组矿化面积比率,显示锌银镁合金组矿化面积比率更高(见图7)。对照组、锌组、锌银组、锌银镁组茜素红染色对比,结果显示锌银镁合金的矿化性能优异,进一步证实了锌银镁合金具备更优的成骨性能(见图8)。
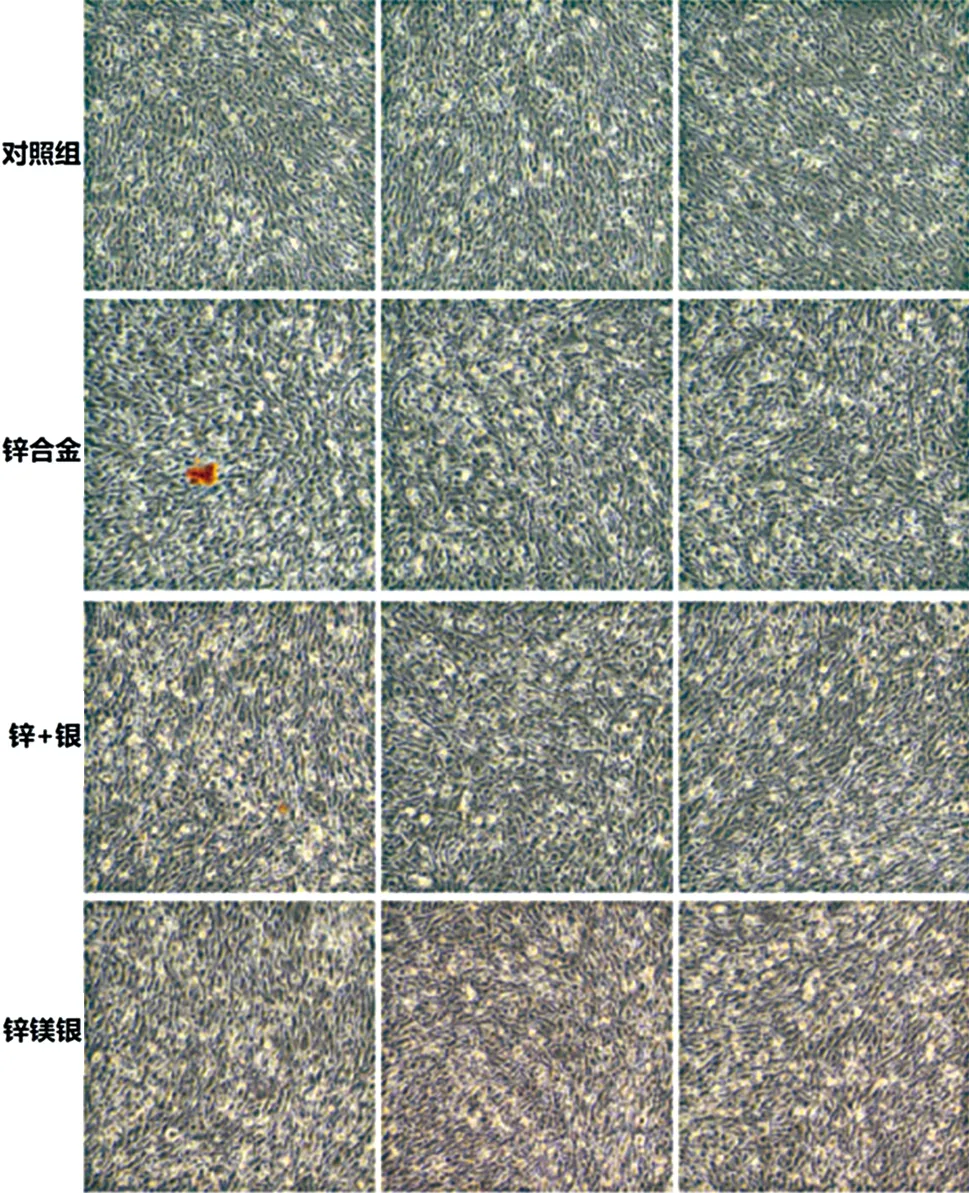
图8 茜素红染色结果比较(茜素红染色,×100)
2.6 体外抗菌测试 将金黄色葡萄球菌稀释1×105,对照组菌落总数值为1 036株,锌组菌落总数值为8株,锌银组菌落总数值为14株,锌银镁组菌落总数值为13株;表皮葡萄球菌稀释1×105,对照组菌落总数值为1 010株,锌组菌落总数值为0株,锌银组菌落总数值为1株,锌银镁组菌落总数值为2株。抗菌性能结果表明三种合金具备良好的抗菌性能(见图9~11)。
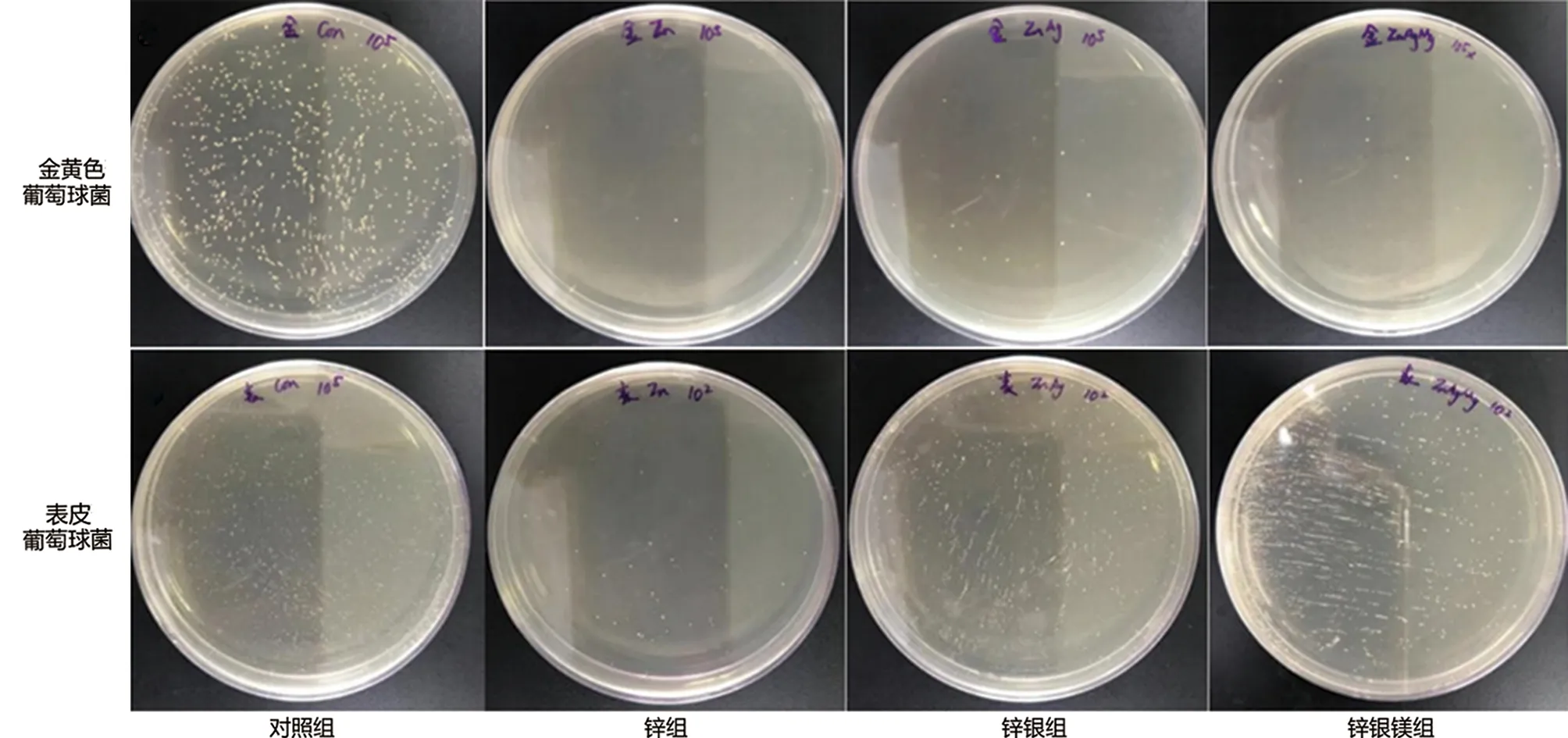
图9 金葡菌及表葡菌抗菌水平比较
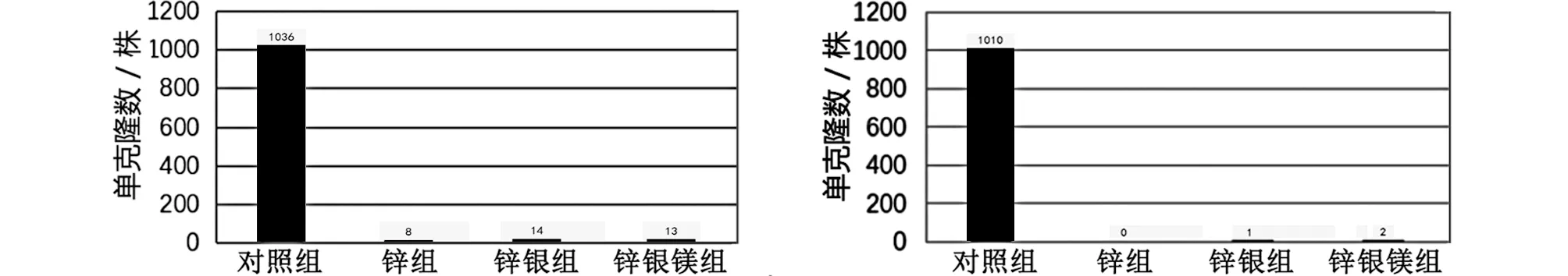
图10 金葡菌抗菌水平比较 图11 表葡菌抗菌水平比较
2.7 锌合金的体外成骨诱导性能评估 成骨诱导培养基和金属浸提液进行混合培养1~2周。OSX、OC引物在RNA水平上的表达比率随着时间延长而增高,显示镁的加入提高了材料的成骨性能,提高了纯锌的细胞相容性和成骨特性(见图12)。
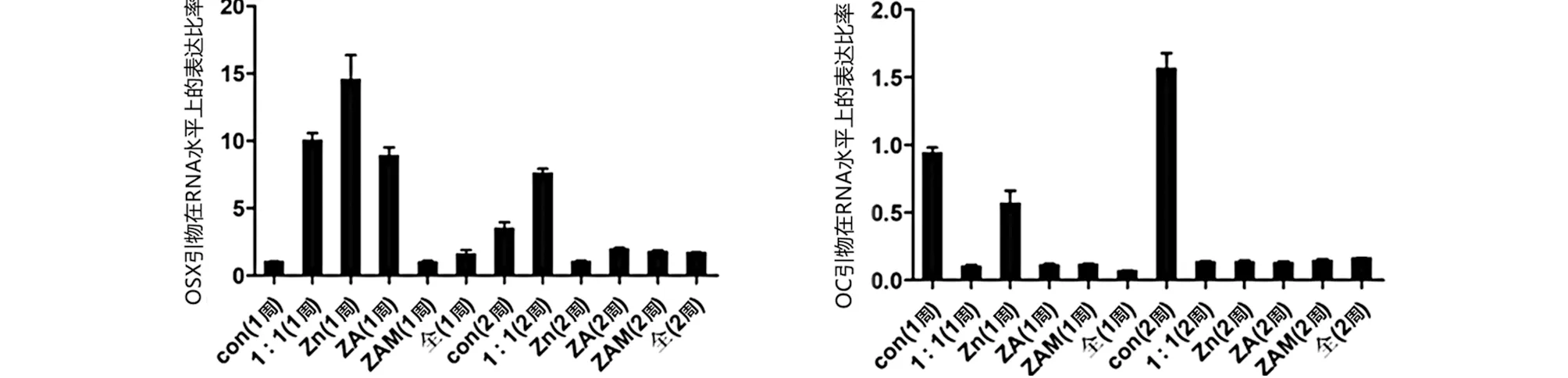
a OSX b OC
3 讨 论
近年来,随着新型生物医用材料的不断研发以及临床需求的不断提高,可降解金属材料已经成为科研工作者研究的前沿课题。锌及其合金良好的生物相容性、易生物降解性,展现了作为可降解生物医用材料的巨大优势和潜力。
Vojtěch等[11]首先提出了用于骨固定的锌合金,指出铸态锌-3镁合金腐蚀性能良好,但力学性能较差。针对目前锌合金力学性能较差的问题,本研究将银、镁元素添加到锌基体中,制备锌-2银-0.4镁三元合金。旨在改善锌合金的力学性能,同时调控锌合金的降解速率,使骨组织的生长与锌基合金的降解相一致。此外,作为医用植入材料中添加银后,通过银离子的释放,可对植入材料和周围环境起到消炎和避免感染的作用。
锌银镁合金具有更好的体外生物相容性、成骨性以及抗菌性能[12-15],主要原因有:镁元素是一种人体内的必须微量元素,镁能够在体内降解为镁离子。镁离子主要贮存于骨骼中,是多种酶的辅助因子;镁离子还能够刺激骨折端硬骨痂的生成、诱导成骨,促进骨折愈合,并刺激软骨生成[16-18]。在锌镁合金的基础上加入少量银元素,利用银的广谱抗菌性和不产生耐药性的特点[19],开发出具有抗菌性能的医用锌银镁合金。
综上所述,镁的加入提高了材料的成骨性能,银的加入显著提高了材料的抗菌性能,两种元素的加入提高了纯锌的细胞相容性和成骨特性,表现为能促进MC3T3-E1细胞增殖、黏附、扩散和成骨。因此,锌银镁合金有望成为骨科种植体的新选择材料,特别是在骨缺损修复领域。

