外周血中IGF-1、TNF-α水平与肺间质纤维化合并肺气肿的相关性
魏 方
(长垣中西医结合医院,河南 新乡 453400)
肺气肿是肺间质纤维化患者常见并发症,可加重肺损伤程度,增加肺动脉高压、肺癌等严重疾病发生风险,威胁患者生命安全[1]。本研究主要分析外周血中IGF-1、TNF-α水平与肺间质纤维化合并肺气肿的关系,现报告如下。
1 资料与方法
1.1 一般资料:收集2019年3月至2021年1月长垣中西医结合医院接收的35例肺间质纤维化患者临床资料,纳入无肺气肿组,并收集同期医院收治的35例肺间质纤维化合并肺气肿患者临床资料,纳入肺气肿组。纳入标准:①肺间质纤维化符合《特发性肺纤维化诊断和治疗中国专家共识》[5]中相关规定,且经血液学、肺功能、胸部高分辨率CT等检查确诊;②入院前未接受激素、免疫抑制剂等药物治疗者;③病例资料完整,包括本研究所需资料者。排除标准:①合并肺炎、肺癌、慢性阻塞性肺疾病等其他肺部疾病者;②合并甲状腺疾病、结缔组织疾病者;③合并严重感染性疾病者。
1.2 方法
1.2.1 资料中肺气肿判定方法:肺气肿符合《临床疾病诊断与疗效判断标准》[6]中相关规定:患者感到乏力、体重下降、食欲减退、上腹胀满,伴有咳嗽、咯痰等症状,X线检查结果显示胸廓扩张、肋间隙增宽,肋骨平行,膈降低且变平,两肺野透亮度增加。
1.2.2 外周血中IGF-1、TNF-α水平测定方法:患者入院时,取其空腹外周肘静脉血5mL,以3000r/min速率离心10min,取血清,采用酶联免疫法测定外周血IGF-1、TNF-α水平,操作严格按照试剂盒说明进行。
1.2.3 基线资料收集分析方法:收集患者年龄、性别(男、女)、肺间质纤维化病程、饮酒史(有、无)、入院时外周血IGF-1、TNF-α水平等资料。
1.3 统计学方法:运用SPSS24.0软件处理数据,全部计量资料均经Shapiro-Wilk正态性检验,符合正态分布计量资料以表示,组间比较用独立样本t检验;计数资料用n和%表示,采用χ2检验;绘制受试者工作曲线(ROC),并计算曲线下面积(AUC)值,以检验外周血IGF-1、TNF-α水平对肺间质纤维化合并肺气肿的评估价值,AUC>0.9表示评估价值较高,0.71~0.9。表示有一定评估价值,0.5~0.7表示评估价值较低,P<0.05为差异有统计学意义。
2 结果
2.1 肺气肿组与无肺气肿组患者基线资料比较:肺气肿组入院时外周血IGF-1、TNF-α水平高于无肺气肿组,差异有统计学意义(P<0.05);组间其他资料对比,差异无统计学意义(P>0.05),详见表1。
表1 肺气肿组与无肺气肿组患者基线资料比较(±s)
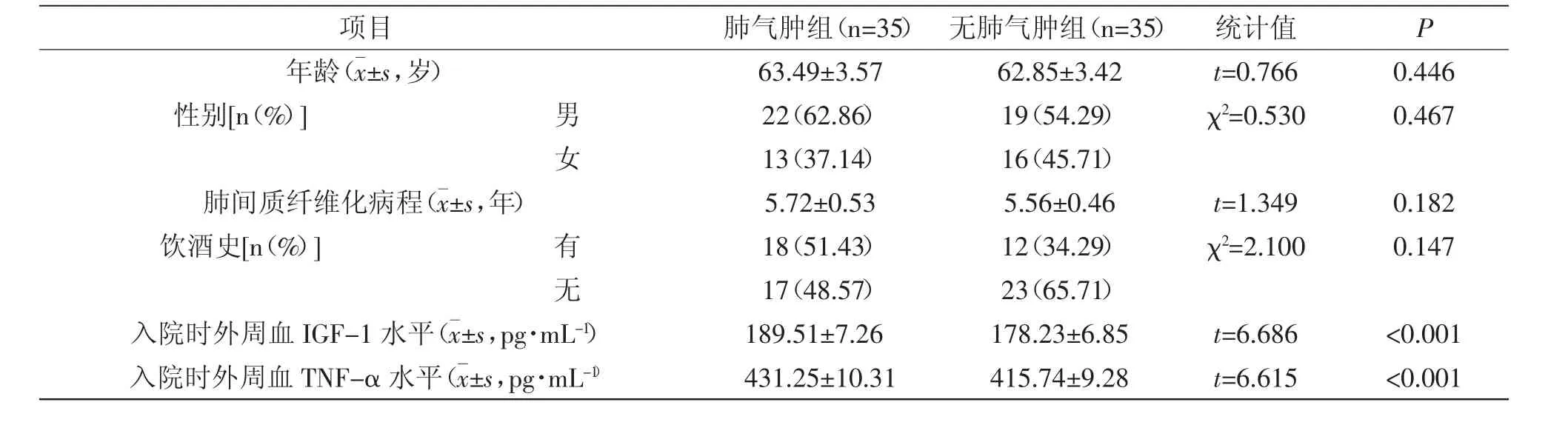
表1 肺气肿组与无肺气肿组患者基线资料比较(±s)
项目 肺气肿组(n=35) 无肺气肿组(n=35) 统计值 P年龄(images/BZ_117_947_1974_964_2011.png±s,岁)63.49±3.5762.85±3.42 t=0.7660.446性别[n(%)] 男 22(62.86) 19(54.29) χ2=0.5300.467女13(37.14) 16(45.71)肺间质纤维化病程(images/BZ_117_947_1974_964_2011.png±s,年)5.72±0.535.56±0.46 t=1.3490.182饮酒史[n(%)] 有 18(51.43) 12(34.29) χ2=2.1000.147无17(48.57) 23(65.71)入院时外周血IGF-1水平(images/BZ_117_947_1974_964_2011.png±s,pg·mL-1)189.51±7.26178.23±6.85 t=6.686 <0.001入院时外周血TNF-α水平(images/BZ_117_947_1974_964_2011.png±s,pg·mL-1)431.25±10.31415.74±9.28 t=6.615 <0.001
2.2 外周血IGF-1、TNF-α单独及联合检测对肺间质纤维化合并肺气肿的评估价值:将肺间质纤维化患者合并肺气肿情况作为状态变量(1=合并肺气肿,0=未合并肺气肿),将入院时外周血IGF-1、TNF-α水平作为检验变量,绘制ROC曲线,详见图1,结果显示,外周血IGF-1、TNF-α单独及联合检测评估肺间质纤维化合并肺气肿的AUC分别为0.800、0.799、0.896,均有一定评估价值,且当外周血IGF-1、TNF-α分别取183.650pg·mL-1、424.195pg·mL-1时,其敏感度、特异性较高,详见表2。

表2 外周血IGF-1、TNF-α水平对肺间质纤维化合并肺气肿的诊断价值

图1 外周血IGF-1、TNF-α单独及联合对肺间质纤维化合并肺气肿评估价值的ROC曲线
3 讨论
IGF-1是一类多功能细胞调控因子,可介导生长激素的分泌,调节成纤维组织生长、增殖,促进组织细胞纤维化进程[2]。TNF-α是巨噬细胞、T淋巴细胞等分泌的重要促炎因子,可刺激其他细胞产生多种炎症因子,增加机体炎症反应程度[3]。而组织细胞纤维化及炎症反应与肺间质纤维化合并肺气肿的发生与发展密切相关。因此推测外周血中IGF-1、TNF-α水平与肺间质纤维化合并肺气肿存在一定联系。
本研究结果显示,肺气肿组入院时外周血IGF-1、TNF-α水平高于无肺气肿组,初步提示外周血中IGF-1、TNF-α水平与肺间质纤维化合并肺具有一定关系。分析原因在于,外周血IGF-1过表达可通过抑制c-myc启动促成纤维细胞凋亡通路的方式抑制成纤维细胞凋亡,促进成纤维细胞大量增殖,增加胶原纤维的合成与分泌;并能抑制胶原酶活性,减少胶原纤维降解,从而导致胶原纤维在肺组织周围大量堆积,引起肺组织重建及功能性损伤,进而降低肺泡弹性,增加肺泡内压力,引发肺气肿[4]。外周血TNF-α过表达可刺激炎症细胞分泌白细胞介素-6、白细胞介素-8等多种炎症因子,增加机体炎症反应程度,损伤肺组织;还能诱导血管内皮细胞分泌白三烯、血小板激活因子等具有黏附作用的细胞因子,使肺表面小血管在炎症反应基础上形成微血栓,影响肺部微循环,进一步增加肺组织损伤程度,降低肺泡弹性,增加肺泡内压力,从而引发肺气肿[5-6]。为验证假说,进一步绘制ROC曲线结果显示,外周血IGF-1、TNF-α单独及联合检测评估肺间质纤维化合并肺气肿的AUC分别为0.800、0.799、0.896,均有一定价值,且当IGF-1、TNF-α分别取183.650pg·mL-1、424.195pg·mL-1时,可获得最佳评估价值。
综上所述,外周血中IGF-1、TNF-α高表达提示肺间质纤维化患者合并肺气肿风险较大,建议临床今后可通过检测外周血中IGF-1、TNF-α水平评估患者肺气肿发生情况。

