C5a/C5aR1通过促γδ T细胞IL-17A表达介导IMQ诱导的小鼠银屑病样皮炎
郑权友,梁申菊,舒 勇,周 山,钟 渝,盛 芬,唐铭君*
(1.中国人民解放军陆军军医大学 陆军军医大学第一附属医院 中国人民解放军陆军第九五八医院 肾病泌尿科,重庆 400020;2.中国人民解放军陆军特色医学中心 风湿免疫科,重庆 400042)
银屑病(psoriasis)是一种免疫反应介导的慢性炎性皮肤疾病,全球范围内发病率约2%~3%[1]。其典型病理表现为表皮角质细胞异常增殖、角质细胞分化不良、免疫炎性细胞浸润及真皮毛细血管增生紊乱[2]。补体系统是天然免疫的重要组分,是由30多种可溶性蛋白和膜结合蛋白构成的复杂调控体系[3]。补体异常激活产生炎性介质补体5a (complement 5a, C5a),其与C5a受体1(C5a receptor 1, C5aR1)结合后,参与调节天然免疫及适应性免疫应答,促进多种疾病的发生发展,如脓毒血症、缺血/再灌注损伤及慢性肾盂肾炎等[4-5]。前期研究结果表明,补体C5a/C5aR1参与银屑病病理过程[6]。然而,其具体作用及其机制尚不明确。
咪喹模特(imiquimod, IMQ)乳膏可诱导小鼠银屑病样皮肤炎性反应,是一种常用的银屑病研究动物模型[7]。小鼠耳部或者背部皮肤涂抹5~6 d后出现具有临床特征的银屑病样皮肤炎性反应,如鳞屑、红斑及表皮增厚等;机制研究表明IL-17A在IMQ诱导银屑病样皮炎病理过程中扮演重要角色,已成为银屑病治疗的新靶点[7-8]。然而,银屑病病理过程中补体C5a/C5aR1通路是否参与调节IL-17A应答,尚无相关报道。因此,本研究拟建立IMQ诱导银屑病皮炎模型及体外实验以探讨C5a/C5aR1通路在银屑病病理过程中的作用及其对IL-17A应答的影响。
1 材料及方法
1.1 材料
1.1.1 动物:C5aR1-/-小鼠(BALB/C背景, 美国Jackson实验室);对照野生型C5aR1+/+小鼠(北京华阜康生物技术有限公司)。所有小鼠繁殖于SPF动物房,选择8~12周龄健康雌性小鼠用于实验。实验操作及动物伦理严格遵守陆军军医大学伦理委员会制定动物伦理规范。
1.1.2 试剂及试剂盒:咪喹模特乳膏(IMQ,四川明欣药业公司);C5aR1阻断多肽(C5aR1a, Ac-Phe-Orn-Pro-dCha-Trp-Arg; 1 mg/kg;吉尔生物技术公司);抗小鼠CD3、Ly-6G及TNF-α抗体(Abcam公司);抗小鼠IL-17A抗体(Santa Cruz公司);HRP标记山羊抗小鼠二抗及DAB显色液(北京中杉金桥生物技术公司);Ⅳ型胶原酶、Pyromellitic acid、Ionomycin及DNA酶Ⅰ(Sigma-Aldrich公司);TruStain fcX antibody、重组小鼠IL-23、荧光标记抗小鼠C5aR1、CD3、γδ TCR及IL-17A流式抗体(BioLegend公司);Brefeldin A及Fixation-Permeabilization Kit (eBioscience公司);1640完全培养基 (Hyclone公司);重组小鼠C5a(rmC5a, Peprotech公司)。
1.2 方法
1.2.1 小鼠的分组及处理:取8~12周龄雌性C5aR1+/+及C5aR1-/-小鼠5~6只,实验前1 d用刀片仔细刮除小鼠背部毛发(约为2.0 cm×3.0 cm),实验组(IMQ组)用50 mg 5% IMQ乳膏均匀涂抹小鼠背部皮肤,连续涂抹6 d;对照组(control组)用凡士林(Vasline)乳膏涂抹相同部位6 d。C5aR1阻断实验中,C5aR1+/+小鼠于涂IMQ乳膏2 h前,腹腔注射C5aR1a。每次涂药前及实验结束后用数码相机进行拍照,双盲法分析小鼠银屑病样皮肤炎性反应。
1.2.2 组织病理的分析:涂药6 d后,收集其背部皮肤组织,4%多聚甲醛固定。组织石蜡包埋切片(4 μm),HE染色明确各组小鼠皮肤组织病理学变化。IHC检测方法:石蜡切片经脱蜡水化后于柠檬酸缓冲液中进行微波高温抗原修复20 min,自然冷却至室温后,3% H2O2溶液孵育20 min去除内源性过氧化物酶,5% BSA室温封闭1 h后,加入抗小鼠CD3(1∶100)、Ly-6G(1∶200)、IL-17A(1∶200)及TNF-α抗体(1∶200)于4 ℃冰箱孵育过夜。次日用PBS溶液洗去未结合抗体,加入HRP标记的二抗(1:800)室温孵育1 h,配制DAB溶液并显色2 min左右,苏木精染液复染,梯度乙醇脱水,二甲苯透明,中性树胶封片。在光学显微镜(Olympus)下观察组织中CD3、Ly-6G、IL-17A及TNF-α的阳性染色。随机选择5~6个高倍镜视野半定量统计切片中CD3、Ly-6G、IL-17A及TNF-α阳性染色细胞数。
1.2.3 流式细胞测量术(FCM)检测:涂药6 d后,收集各组小鼠背部皮肤组织,去除皮下脂肪组织,眼科剪剪碎,以含Ⅳ型胶原酶(2 mg/mL)及DNA酶Ⅰ(200 U/mL)的1640培养基于37 ℃孵育箱中消化1 h,含5% EDTA及1% BSA溶液终止消化,用70目筛网过滤两次制备皮肤单细胞悬液备用。腋窝淋巴结取出后,用70目筛网轻柔碾磨过滤制备单细胞悬液备用。
细胞表面染色:取已制备好的细胞悬液(1×106细胞/L),TruStain fcX antibody (2 μL/test)冰上孵育20 min封闭,加入不同荧光标记抗小鼠C5aR1、CD3及γδ TCR抗体 (1 μL/test)冰上避光孵育25 min,流式洗液(含1% FBS的PBS)清洗2次后行流式细胞仪检测(BD FACS Canto Ⅱ)或进行胞内细胞因子染色。
IL-17A 胞内因子检测:制备好的皮肤或淋巴细胞悬液以含50 ng/mL pyromellitic acid, 500 ng/mL ionomycin和3 μg/mL Brefeldin A的1640 完全培养基37 ℃刺激4 h。表面染色后,用Fixation-Permeabilization kit固定通透细胞,然后加入抗IL-17A(1 μL/test)抗体冰上染色25 min。流式洗液(含1% FBS的PBS)清洗2次后行流式细胞仪检测,用Flow Jo软件分析所得数据。
1.2.4 脾脏淋巴细胞刺激及IL-17A表达的检测:C5aR1+/+小鼠经IMQ或凡士林乳膏刺激背部皮肤3 d 后,无菌条件下取其脾脏,用70目筛网过滤制备单细胞悬液,按1×106个细胞/L浓度接种于6孔板加入分别含重组小鼠C5a(200 ng/mL), 重组小鼠IL-23(10 ng/mL)或C5aR1a(200 ng/mL) 的1640完全培养基刺激24 h。收集刺激细胞,按FCM胞内染色方法进行细胞表面及胞内IL-17A染色,流式洗液(含1% FBS的PBS)清洗两次后行流式细胞仪检测,用Flow Jo软件分析所得数据。
1.3 统计学分析
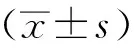
2 结果
2.1 C5aR1缺陷显著减轻IMQ诱导银屑病样皮肤炎性反应
与对照组相比,IMQ能够诱导小鼠背部皮肤产生银屑病典型皮损表现,如银屑、红斑及硬皮改变等;与C5aR1+/+组相比,C5aR1-/-组小鼠上述银屑病皮损表型则明显减轻。用银屑病皮损面积和严重程序指数(psoriasis area and severity index,PASI)来评估严重程度(图1A)。此外,IMQ刺激后出现银屑病典型病理改变,如表皮细胞异常增殖、表皮微脓肿、棘皮征、角化不全及真皮大量炎性细胞浸润等,而C5aR1-/-组上述表现较C5aR1+/+组显著减轻(图1B)。定量分析表皮细胞厚度发现,C5aR1敲除后IMQ诱导的表皮细胞异常增厚明显缓解(P<0.01)(图1B)。
A,B.macroscopic phenotype of back psoriatic lesions and modified PASI scores; B,C.HE staining for psoriatic skin lesions(×40), and quantification for epidermal thickness; *P<0.05, **P<0.01, ***P<0.001 compared with C5aR1+/+ mice with IMQ treatment
2.2 C5aR1基因缺陷后炎性细胞浸润显著减少及炎性因子表达明显下调
与C5aR1+/+组相比,C5aR1-/-组CD3+T细胞及Ly-6G+中性粒细胞浸润显著减少(图2A);相似的,炎性因子IL-17A及 TNF-α表达明显下调(图2B)。

A.IHC staining and semi-quantification graphs of CD3 positive T and Ly-6G positive neutrophils; B.IHC staining and semi-quantification graphs of IL-17A and TNF-α positive staining; *P<0.05, **P<0.01 compared with C5aR1+/+ mice with IMQ treatment; scale bar=20 μm; Arrow shows positive cells
2.3 C5aR1敲除下调IMQ诱导γδ T细胞IL-17A的表达
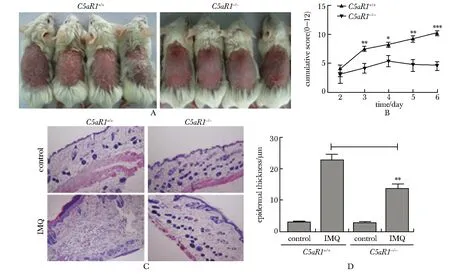
如(图3A)所示,腋窝引流淋巴细胞中约80%的IL-17A来源于γδ TCR+CD3+T,表明其为IL-17A的主要分泌细胞亚群。与C5aR1+/+组相比,C5aR1-/-组腋窝引流淋巴细胞中IL-17A+CD3+T及IL-17A+γδ TCR+T细胞百分率明显降低(图3BC)。与上述结果相似,C5aR1基因缺陷后IMQ诱导银屑病皮损组织局部IL-17A表达明显下调,且IL-17A的主要由γδ TCR+T细胞分泌(图3D,E)。
A.flow plots shown the major sources of IL-17A are γδ T cells; B.flow plots and cumulative graphs showing the percentages of IL-17A+ CD3+ T cells; C.flow plots and cumulative graphs showing the percentages and IL-17A+TCR γδ+ T cells; D.representative contour plots of skin-infiltrating IL-17A+ and γδ TCR+cells in skin cell suspensions after 5 days of IMQ treatment; left panel: flow plots and graphs showing the IL-17A+ cells from C5aR1+/+ and C5aR1-/- mice; Right panel: flow plots and quantification of γδ TCR+in IL-17A positive cells;*P<0.05, **P<0.001 compared with C5aR1+/+ mice with IMQ treatment
2.4 C5aR1a阻断C5a/C5aR1通路后IMQ诱导银屑病样皮肤炎性反应及IL-17A应答显著减弱
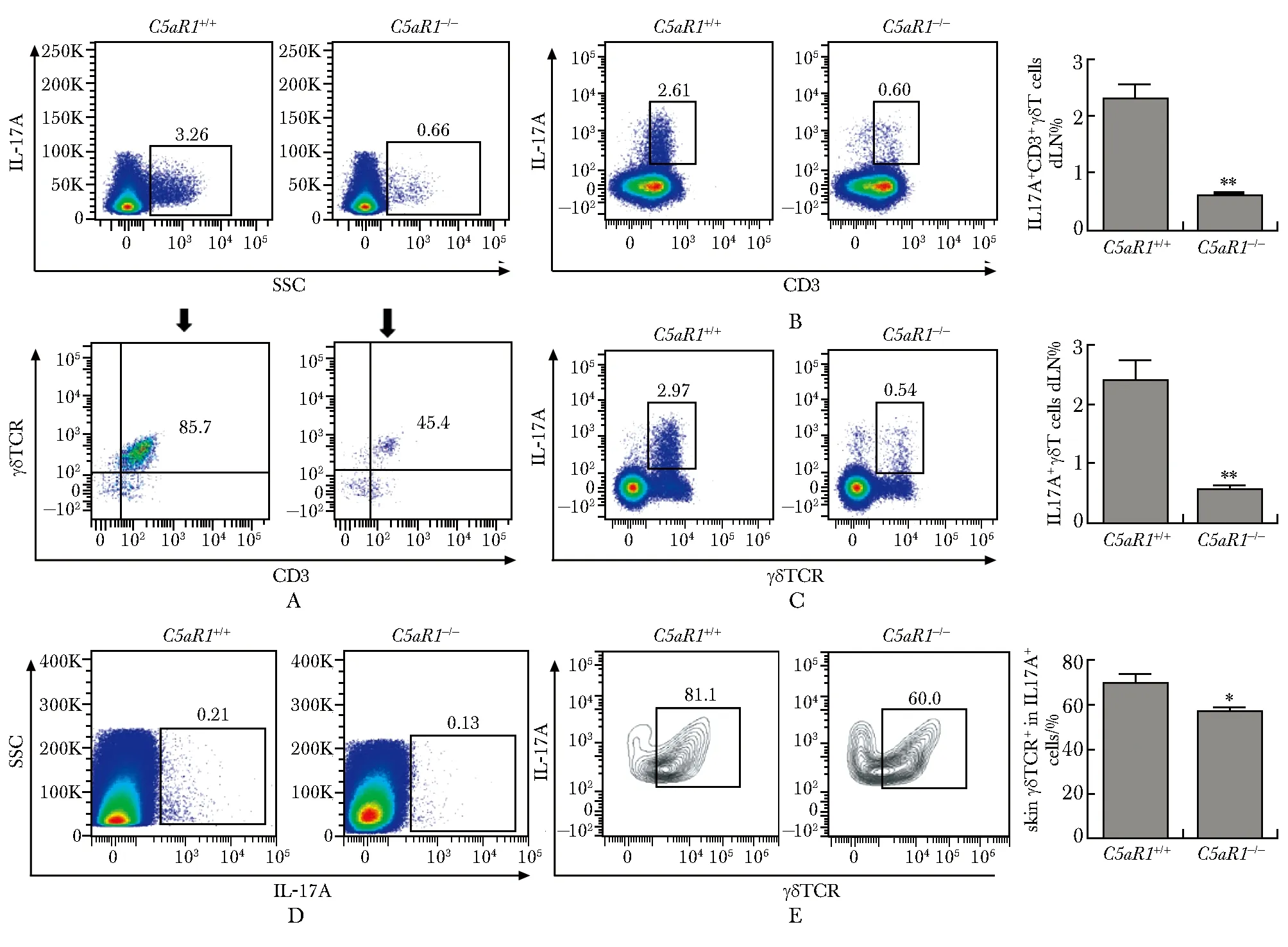
与对照组相比,C5aR1a组IMQ诱导小鼠银屑病典型皮损表型(银屑、红斑及硬皮改变等)明显减轻(图4A,B)。此外,C5aR1a阻断显著缓解IMQ诱导表皮细胞异常增殖、表皮微脓肿及真皮炎性细胞浸润,且表皮细胞层数明显减少(图4C)。与之一致的是,C5aR1a组腋窝引流淋巴细胞中IL-17A+CD3+T及IL-17A+γδ TCR+T细胞百分率较对照组明显降低(P<0.05)(图5A,B),进一步证实,补体C5a/C5aR1通路促进银屑病病理过程。

A.macroscopic phenotype of back psoriatic lesions on days 6; B.disease severity (PASI) is scored and analyzed; C.HE staining for psoriatic skin lesions, and quantification for epidermal layers(×40); *P<0.05, **P<0.01 compared with saline(control)
C5aR1+/+ mice were pre-treated with a C5aR1 antagonist (C5aR1a, 1 mg/kg) or 0.9% saline for 2 hours before imiquimod (IMQ) treatment; on day 6, axillary draining lymphocytes were stained with indicated antibodies; A.flow plots and cumulative graphs showing the percentages of IL-17A+ CD3+ T cells; B.flow plots and cumulative graphs showing the percentages of of IL-17A+ CD3+ T cells; *P<0.05 compared with control group
2.5 补体C5a/C5aR1通路促进γδ T细胞IL-17A表达
与未刺激组相比,C5a单独作用不能显著促进γδ T细胞表达IL-17A;与IL-23单独刺激相比,C5a联合IL-23显著上调γδ T细胞表达IL-17A;而C5aR1a阻断C5aR1后,γδ T细胞分泌IL-17A显著降低(图6)。
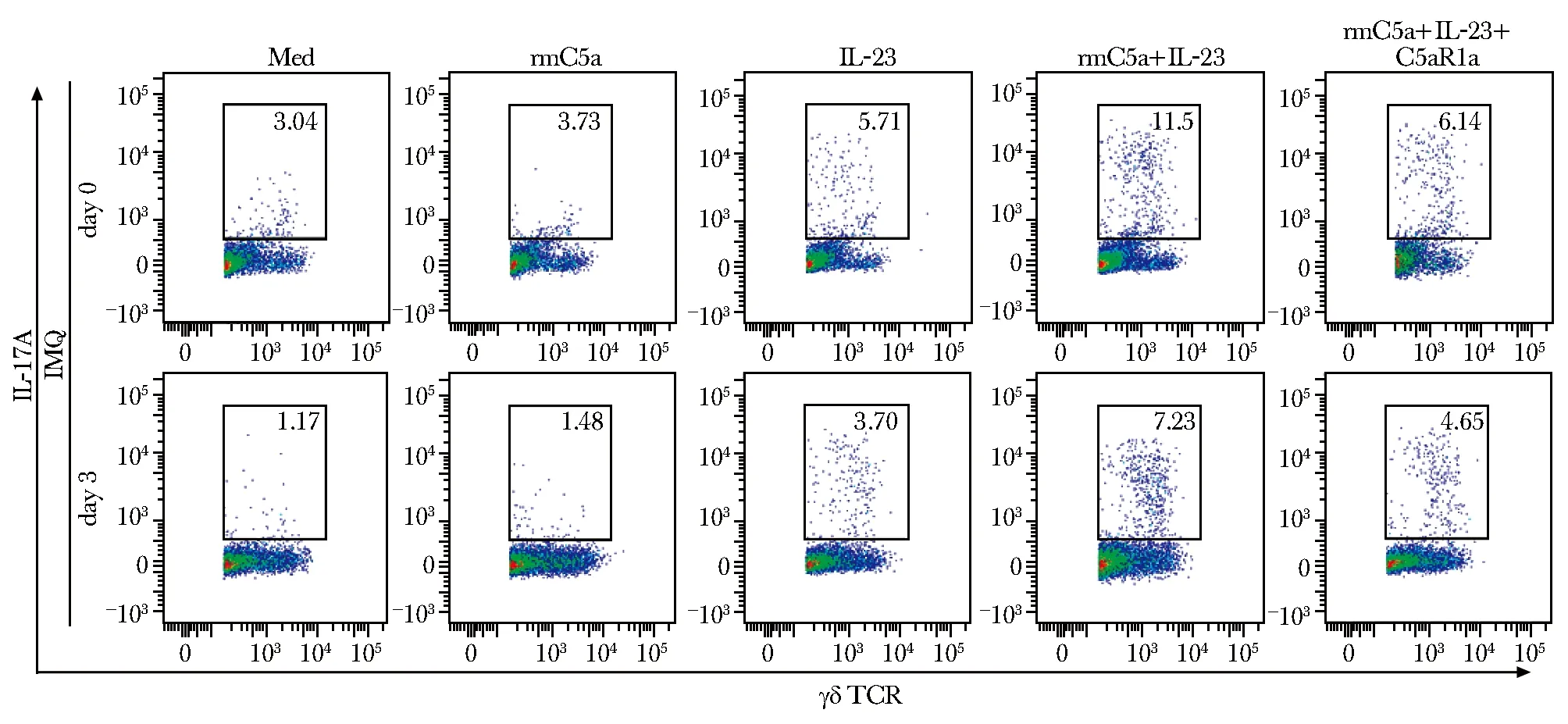
C5aR1+/+ were treated with IMQ on the shaved back for the indicated times; spleen lymphocytes were isolated, stimulated with recombinant mouse C5a (rmC5a, 200 ng/mL), recombinant mouse IL-23 (IL-23, 10 ng/mL), or a C5aR1-antagonizing peptide (C5aR1a, 200 ng/mL) for 24 hours and then stained with indicated antibodies; flow plots of IL-17A expression on CD3+ γδ TCR+T cells are presented
3 讨论
本研究结果显示,IMQ诱导小鼠背部皮肤炎性反应具备表皮角质细胞异常增殖及免疫炎性反应反应等银屑病典型病理表现,与已有研究结果一致[9]。本课题组研究发现,IMQ诱导小鼠银屑病皮炎及银屑病患者中C5a/C5aR1表达明显上调;机制研究表明,其可促类浆细胞炎性因子分泌介导银屑病病理过程[6]。尽管如此,C5a/C5aR1通路在银屑病中的作用及机制尚不完全明确。本研究结果显示,C5aR1敲除后银屑病皮炎程度明显减轻;组织病理学提示,表皮角质细胞增厚明显缓解,真皮炎性细胞浸润及炎性因子表达显著下调。此外,C5aR1a阻断C5a/C5aR1通路后,IMQ诱导银屑病样皮炎较对照组明显减轻。进一步证实,补体C5a/C5aR1通路介导银屑病病理过程,阻断该通路可能成为银屑病治疗的新策略。
分泌IL-17A的γδ T细胞是银屑病进展的主要推手之一,并与银屑病严重程度密切相关[10-11]。本研究结果表明,IL-17A主要来源于γδ T细胞,与已发表研究结果一致[12]。进一步研究结果发现,C5aR1缺陷后腋窝引流淋巴结及皮损组织局部IL-17A+细胞及γδ T cells细胞百分率明显减少。C5aR1信号阻断后(C5aR1缺陷或者C5aR1a阻断)IL-17A+γδ TCR+Tγδ17 细胞频率明显下降。此外,体外实验结果显示,C5a单独刺激对γδ T细胞IL-17A表达无明显影响,而C5a联合IL-23则能显著上调γδ T细胞IL-17A分泌,但C5aR1a阻断C5aR1后这种协同刺激作用则明显减弱。因此,上述结果表明,补体C5a/C5aR1通路促γδ T细胞IL-17A表达介导银屑病病理过程。然而,该动物实验结果是否能够反映临床银屑病病理过程尚需后期更多的实验进行验证。
综上所述,本研究利用C5aR1敲除及C5aR1a阻断实验发现补体C5a/C5aR1通路介导银屑病病理过程, 机制研究表明C5a/C5aR1通路促进γδ T细胞IL-17A分泌,表明C5a/C5aR1通路促γδ T细胞IL-17A表达介导银屑病病理过程。因此,研制特异性阻断C5a/C5aR1通路的药物可能成为银屑病治疗的新途径。

