HIFU联合药物治疗不同类型子宫腺肌病的临床研究
蒋奕阳,彭丽秀
1 资料与方法
1.1 研究对象
选取2018年2月至2019年4月在郴州市第一人民医院就诊且要求行HIFU治疗保留子宫的子宫腺肌病患者136例,根据子宫腺肌病的影像学特点将患者分为弥漫型子宫腺肌病组(D组,97例)和局限型子宫腺肌病组(F组,39例)。根据患者子宫大小、生育要求并结合个人意愿采取不同的治疗方案:① 宫腔深度≤9 cm,暂无生育要求的患者,采取HIFU联合左炔诺孕酮宫内缓释系统(levonorgestrel-releasing intrauterine system,LNG-IUS)治疗方案;② 宫腔深度>9 cm,有生育意愿的患者,HIFU联合GnRH-a治疗3个月;③ 妊娠宫腔深度>9 cm,暂无生育要求的患者,HIFU术后予以GnRH-a治疗3~6疗程后适宜放置LNG-IUS。将两种类型的子宫腺肌病患者再各分为4小组,分别为:D1/F1组:弥漫型/局限型单纯HIFU治疗组、D2/F2组:弥漫型/局限型HIFU+GnRH-a治疗组、D3/F3组:弥漫型/局限型HIFU+LNG-IUS治疗组、D4/F4组:弥漫型/局限型HIFU+GnRH-a+LNG-IUS治疗组。收集患者治疗后3、6、12个月的随访资料。
1.2 仪器与方法
1.2.1 单纯HIFU治疗(D1/F1组) 仅行HIFU消融治疗。本研究使用重庆海扶医疗科技股份有限公司JC200D型高强聚焦超声肿瘤治疗系统,该设备的换能器可产生治疗性聚焦超声能量,并与超声成像设备作为实时成像来指导HIFU治疗程序。
1.2.2 HIFU联合GnRH-a治疗(D2/F2组) HIFU术后第1次月经来潮第1天注射GnRH-a(亮丙瑞林3.75 mg),此后每28 d皮下注射1次,共3~6次。
1.2.3 HIFU联合LNG-IUS治疗(D3/F3组) HIFU术后第1次月经来潮时2~5 d置入LNG-IUS。
1.2.4 HIFU联合GnRH-a及LNG-IUS治疗(D4/F4组) HIFU术后完成3~6次GnRH-a注射后28 d复查彩超,宫腔深度小于9 cm者置入LNG-IUS。
1.3 观察指标
1.3.1 体积测量及消融评价 患者于HIFU术前1周统一行3.0T盆腔MRI平扫+增强扫描及术后1 d行MRI盆腔MRI增强扫描检查。术前MRI有助于确定子宫腺肌病的类型、体积以及子宫的位置,术后MRI用于测量无灌注区体积(non-perfused volume,NPV);消融率(non-perfused volume ratio,NPVR)作为评价HIFU消融效果指标。
1.3.2 痛经评分 采用视觉模拟评分法 (visual analog scale,VAS)将疼痛程度进行量化。
1.3.3 月经量评分 采用Spies的五级评分法[7]评价月经量:正常(1分),轻微增多(2分),中度增多(3分),重度增多(4分),极重度增多(5分)。
针对上述问题,采取如下处理方法:① 发现滤布破损时,及时进行更换,按要求与刮刀间隙保持2~4 mm;② 做好风路维护工作,及时更换损坏的部件,消除跑风现象;③ 针对储浆槽液位存在的虚泡现象,在浮选入料池的上方敷设了两排分散的喷水管,使得水流分散,由于落差高,喷水面积及水流力度有保证,消泡效果极佳;④ 调整入料浓度,及时处理系统中存在的跑粗现象,保证入料指标满足设备运行要求。
1.3.4 疗效判定
1.3.4.1 痛经疗效评估 症状改善[8]:VAS评分降幅>治疗前的20%,持续3个月经周期以上;未缓解:VAS评分降幅≤治疗前的20%;加重:VAS评分较治疗前升高;痛经复发:治疗后3个月随访时为有效的患者,VAS 评分在6个月或12个月随访时任一时点恢复到治疗前80%以上水平。症状改善为临床有效。未缓解或加重为无效。
1.3.4.2 经量疗效评价 临床有效[9]:评分至少降低2分;无效:评分降低1分或者无变化;复发:评分在治疗后有降低,但又恢复至治疗前分值。
1.3.5 随访 所有病例均以HIFU治疗后第1天开始计算时间,于第3、6及12个月进行随访。随访内容包括痛经评分、月经量评分情况。
1.4 统计学方法
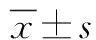
2 结果
2.1 两组一般资料比较
HIFU治疗子宫腺肌病患者共纳入136例,其中弥漫型子宫腺肌病组(D组)97例,局限型子宫腺肌病组(F组)39例。所有患者平均年龄为43±3.97岁(27~55岁),BMI为22.99±2.18 kg/m2(17.69~32.04 kg/m2),病程为5.27±4.12年(1~20年),妊娠次数为4.20±1.92次(0~10次),分娩次数为1±0.84次(0~5次),子宫体积281.19±151.76 cm3(75.42~938.55 cm3),病灶体积94.24±76.36 cm3(12.09~448.18 cm3)。两组患者的年龄、BMI、孕产次、病程、疼痛评分及月经量评分相比较,差异均无统计学意义(P>0.05)。D组子宫体积大于F组(t=2.425,P=0.017),D组病灶体积大于F组(t=2.051,P=0.042),差异均有统计学意义。
2.2 两组HIFU治疗情况比较
136例患者均顺利完成HIFU治疗,D组与F组辐照时间、NPV差异均无统计学意义(P>0.05),但F组消融率大于D组,差异有统计学意义(P<0.05)。详见表1。

表1 两组HIFU治疗情况比较
2.3 两组随访症状缓解情况
2.3.1 两组不同时间段痛经疗效评价 D组与F组术后3、6个月痛经改善有效率差异均无统计学意义(P>0.05),而术后12个月时F组痛经改善有效率高于D组,差异有统计学意义(P<0.05)。详见表2。

表2 两组不同时间段痛经疗效比较[例(%)]
2.3.2 两组月经量改善情况 D组与F组在术后3个时间段月经量改善有效率差异均无统计学意义(P>0.05)。详见表3。

表3 两组月经量改善情况比较[例(%)]
2.3.3 术后12个月接受同一治疗方案的弥漫型及局限型子宫腺肌病疗效评价
2.3.3.1 痛经疗效评价 术后12个月D2组与F2组、D3组与F3组、D4组与F4组在痛经疗效的组间比较,差异均无统计学意义(P>0.05),但F1组在术后12个月时的痛经缓解有效率高于D1组(P<0.05)。详见表4。

表4 术后12个月接受同一治疗方案的痛经疗效比较[例(%)]
2.3.3.2 月经量疗效评价 术后12个月接受同一治疗的弥漫型组与局限型组月经量疗效比较,差异均无统计学意义(P>0.05)。详见表5。

表5 术后12个月接受同一治疗方案的月经量疗效比较[例(%)]
3 讨论
子宫腺肌病可分为弥漫型和局限型两种类型,有关该分类特点的形成及疾病严重程度的病理生理基础目前尚不明确,最近有研究显示,与局限型相比,弥漫性子宫腺肌病对妊娠率的影响较大[10]。该分类方式与临床决策治疗相关[11],故一直沿用至今。
HIFU的原理[12]是通过超声换能器,将体外的低强度超声波精准聚焦于体内病灶处,聚焦点高强度超声波使病灶组织产生微小气泡并发生振荡、破灭等动力过程,使靶区温度急剧升高发生凝固性坏死[13],几乎不损伤聚焦区域以外的正常组织[14]。有文献认为当消融率大于60%时可视为HIFU治疗有效[15]。本研究中局限型子宫腺肌病组消融率均数为83.68%,显著高于弥漫型子宫腺肌病组的消融率均数71.71%。提示局限型和弥漫型子宫腺肌病均适合HIFU治疗,其中局限型子宫腺肌病消融率更高。该结论与Feng Y等[16]的研究结果一致。分析可能由于子宫腺肌病病灶与周边子宫肌层分界不清,在HIFU治疗过程中通过超声波将能量聚焦于病灶处,但腺肌症病灶无假包膜,能量易扩散,所以消融过程中需与子宫浆膜层及子宫内膜均保持1~1.5 cm的安全距离。因此,对于腺肌病病灶需进行减容治疗,加之弥漫型病变范围广使其消融治疗的限制更为苛刻,更加难以覆盖所有的子宫腺肌病病灶,可能使残留病灶范围较大。由于这些因素可使得弥漫型子宫腺肌病组的HIFU消融率显著低于局限型组,那么提示在临床中局限型腺肌病的HIFU治疗可能获益更大。
进行性痛经是子宫腺肌病的主要症状之一。局限型腺肌病患者在术后12个月的痛经缓解有效率为94.9%,显著高于弥漫型痛经缓解有效率79.4%。另外,接受单纯HIFU治疗的局限型子宫腺肌病患者痛经缓解有效率为93.9%,显著高于弥漫型患者痛经缓解有效率62.9%,其余3种治疗方案间的弥漫型及局限型患者痛经改善有效率间差异均无统计学意义。该结果表明,在痛经症状疗效方面,单纯HIFU治疗可能更适用于局限型子宫腺肌病患者,该结论与Liu X等[17]研究结果一致,且HIFU联合辅助治疗可弥补单纯HIFU治疗弥漫型腺肌病患者的不足,提高痛经缓解有效率。分析其原因,超声消融使组织发生凝固性坏死,镜下可见病灶组织出现细胞活性丧失的典型表现,子宫腺肌病痛经症状的严重程度与病灶范围大小有关[18],病灶消融体积越大则症状缓解率越高且症状缓解持续的时间越长[19],消融率越高再干预率越低[20],而弥漫型较局限型病变范围广,消融难度大,导致消融率较局限型低,从而症状缓解疗效低于局限型。进一步比较不同治疗方案的疗效,结果显示HIFU联合GnRH-a及LNG-IUS治疗的所有子宫腺肌病患者术后12个月的痛经缓解有效率高于单纯HIFU治疗,该结论与既往研究结果一致[21-23];其余各组间的痛经缓解率差异均无统计学意义。然而,从HIFU联合GnRH-a与单纯HIFU治疗的痛经缓解率(85.3% vs 72%)以及HIFU联合LNG-IUS与单纯HIFU治疗的痛经缓解率(91.7% vs 72%)中可明显看出联合治疗有效率高于单纯HIFU治疗,差异无统计学意义的原因可能受于样本量的限制。
月经量增多也是子宫腺肌病主要症状之一。与痛经缓解率不同的是,无论是单纯HIFU治疗还是HIFU联合药物治疗,术后不同时间段的局限型与弥漫型月经量缓解率差异均无统计学意义,提示HIFU和(或)联合药物治疗弥漫型和局限型子宫腺肌病均可有效缓解月经量增多症状,且两种类型疗效相当。痛经及月经量增多发生的病理生理机制不同,但通过组织病理学特征来评估该症状与疾病严重程度之间的关系可发现,痛经程度主要与病灶浸润深度及异位内膜小岛数量有关,月经量增多程度主要与病灶浸润深度有关[10]。因此单纯HIFU消融对局限型及弥漫型的月经量改善均能获益,而痛经缓解率可能与两种类型的异位内膜小岛数量不同而有所偏差,该结论需要进一步研究明确。从不同治疗方案结果显示,HIFU联合GnRH-a及LNG-IUS治疗的所有子宫腺肌病患者术后12个月的月经量改善有效率高于单纯HIFU治疗,该结论与既往研究结果一致[21-23];其余各组间的月经量改善率差异均无统计学意义。进一步观察治疗效果发现HIFU联合GnRH-a(85.3%)或联合LNG-IUS(91.7%)均优于与单纯HIFU治疗(70%)。子宫腺肌病具有雌激素依赖性,HIFU治疗难以将消融覆盖至整个病灶组织,且不会损伤卵巢功能,不影响体内激素水平,这导致其效果存在一定缺陷,药物治疗则可通过降低体内雌激素起到缓解症状的目的。在HIFU消融基础上辅以药物治疗,通过消融病灶及抑制激素水平双重作用提高子宫腺肌病疗效。Abou-Setta AM等[24]报道保守手术后使用LNG-IUS可以减少子宫腺肌病的复发。Yang X等[25]研究表明HIFU联合GnRH-a及LNG-IUS治疗子宫腺肌病可降低子宫切除术的风险,提高患者生活质量,并且局限型子宫腺肌病患者疗效优于弥漫型患者。以上均表明HIFU消融对子宫腺肌病的有效性,并可与其他药物协同提高疗效。本研究结论与其一致。
子宫腺肌病患者经保守治疗后症状未缓解及复发是一项具有挑战性的难题,目前没有统一的治疗标准,且有关影响HIFU治疗子宫腺肌病疗效的研究结论观点也存在争议。本研究总复发率为2.9%,3例为弥漫型,1例为局限型,两种类型复发率差异无统计学意义,4例复发患者来自联合治疗方案,其中HIFU联合GnRH-a治疗3例,HIFU联合GnRH-a及LNG-IUS治疗1例,对复发病例进行分析,本研究中HIFU联合GnRH-a治疗组术前子宫体积大于其余3组,3组治疗组间子宫体积差异无统计学意义,结合其他学者研究联合治疗组间术前子宫体积差异无统计学意义[26-27],与本研究结果基本一致。我中心建议将宫腔深度>9 cm者予以行HIFU联合GnRH-a和(或)LNG-IUS治疗,但治疗方案的选择存在患者意愿及有无生育要求等因素的干扰,且子宫腺肌病的病因、发病机制及流行病学均不明确,临床上无统一治疗指南,各中心治疗方案的纳入导向存在差异,可能对部分结果产生影响。另外,三联治疗复发1例术后出现环脱落,结合上述认为子宫体积可能为影响本次联合治疗患者复发的因素之一。由于本研究对子宫腺肌病患者进行分层处理,不同宫腔深度的子宫腺肌病患者结合不同的治疗方法,使总复发率低于既往报道单纯HIFU治疗的复发率10.3%~27.5%[15,20],提示需根据患者的个体情况、生育要求及子宫大小采取不同治疗措施,可降低子宫腺肌病的复发率、该结论与Haiyan S等[22]报道一致。本研究表明HIFU治疗子宫腺肌病患者是有效的,建议术后联合治疗以巩固其疗效,根据子宫大小选择HIFU联合GnRH-a和(或)LNG-IUS可提高HIFU治疗子宫腺肌病的效果。

