烟草根表可培养细菌群落组成及典型菌群的促生特性研究①
刘冬晖,李凤巧,靳志丽,李孝刚*
烟草根表可培养细菌群落组成及典型菌群的促生特性研究①
刘冬晖1,李凤巧1,靳志丽2*,李孝刚1*
(1 南京林业大学生物与环境学院,南京 210037;2 湖南省烟草公司永州市公司,湖南永州 425000)
植物微生物组是维护植物生长发育、提升抗逆防病的重要调控因素。为发挥植物微生物促进烟草生长、改善烟草根区微生态功能作用,本研究从烟草根表分离筛选可培养细菌组,并对不同菌株的促生能力进行测定。结果表明:①从烟草根表分离并鉴定出可培养菌株310株,隶属于31个属,其中主要为芽孢杆菌属()、假单胞菌属();②对比分析发现假单胞菌属、芽孢杆菌属、寡养单胞菌属()和成对杆菌属()为4种供试土壤烟草根表共有的细菌类群;③对进一步筛选得到的16株菌株进行促生能力的测定,发现6株菌具有固氮能力,5株菌产铁载体,4株菌可溶解无机磷,4株菌产IAA;④盆栽试验验证16株菌株的促生效果,其中37.5% 的菌株对烟草生长具有显著促进作用,烟草株高、总鲜物质量和地下部干物质量分别比对照提高35.1%、27.9% 和30.7%。总之,从烟草根表分离获得多种具有促生能力的菌株,为未来构建促进烟草健康生长的复合菌剂提供了理论基础。
烟草根表;可培养细菌;促生筛选;植物微生物组
烟草作为一种重要的经济作物,在我国黄淮、西南、东南等地区有着广泛的种植[1]。然而,由于不合理的种植制度、施肥和水分管理等因素,对植烟区烟株生长有益的促生菌难以在植物根部定殖和增殖,导致烟叶产量降低、品质持续下降[2-3]。对此,一般采取轮作、添加土壤改良剂和实行不同的施肥方式等措施,但效果有限,且针对性不强[3-5]。
根际促生菌(plant growth-promoting rhizobacteria,PGPR)是指生活在根际或根表区域内对植物的生长起促进作用的微生物[6-7]。已有研究证明,根际“有益菌群”在促进植物生长、提升抗逆性、抗病等方面发挥重要作用[8-10]。例如,何斐等[11]从健康的魔芋根际中发现2种优势细菌B18和B17,对魔芋生长具有促生和抗病能力。张从宇和孔德树[12]从大豆根际分离出20株对植物病原真菌具有拮抗作用的细菌,表现出对多种病害的良好防效。然而,已有研究大多采用“抖根法”获取植物根际土壤样品,无法避免非根际土壤或植物根表土对根际土壤样品的“污染”或影响。例如,本课题组前期研究发现,花生根际微生物数量显著低于根表,这说明根表微生物与根系生理生化代谢活性密切相关,是植物健康状况关键指示器[13]。因此,根据其自身生态位特性,分离筛选植物根表定殖力强的功能微生物,是未来获取高效微生物资源、优化根区生态功能和改善植物生长健康的重要基础。对此,从样品采集及分析方法上对“根表”与“根际”土进行区别研究,有助于利用关键微生物种群对植物生长健康开展精确调控。
本研究采集了湖南永州烟草种植区代表性田块壤样品,通过温室盆栽试验结合16S rRNA基因序列鉴定和对比分析,分析烟草根表可培养微生物群落特征。由于分离获得的微生物群落组成之间存在较大差异,为寻找更多具有促生能力的菌株,从3种及以上代表性土壤中共同存在的属中,选择代表性菌株开展促生能力分析[14]。研究旨在获得植烟根表稳定定殖的微生物菌群,鉴别对烟草生长具有促进能力的菌株,为改善烟草根区微生物生态功能提供参考和理论依据。
1 材料与方法
1.1 供试土壤与烟草
供试土壤选自湖南省永州市烤烟产区蓝山、江华、冷水滩等4种代表性的烟田,在每种田块中选取多点采集耕层土壤100 kg,共采集4种不同质地代表性土壤样品用于后续盆栽试验,各土壤样品的具体理化性质见表1。供试烟草(L.)为永州当地烟区普遍栽植的云烟87。
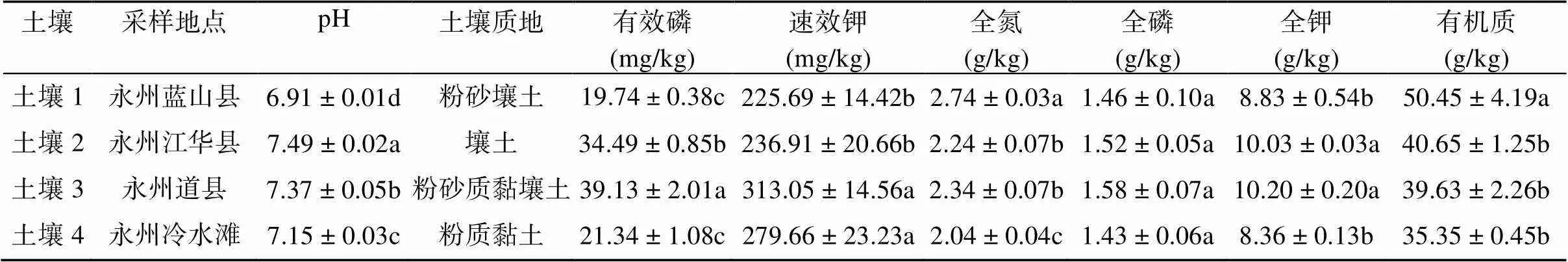
表1 四种供试土壤理化性质
注:同列小写字母不同表示不同土壤间差异显著(<0.05;Tukey HSD test)。
1.2 盆栽试验及根表微生物组获取
在温室进行盆栽试验,每个土壤处理设置10盆重复,每盆栽种1株烟苗,盆钵随机摆放,期间定时定量浇水。移栽40 d后,选取长势一致的烟株进行破坏性取样,拔出整棵植株以获得完整根系,抖落根部明土。按照Edwards等[15]方法将根系放入装有磷酸盐缓冲液(PBS)的无菌烧瓶中,用无菌镊子摇动根系,以清除根系残留的根际土壤。用PBS缓冲液冲洗根部3次后将根系放入装有PBS缓冲液的锥形瓶中振荡,40 KHz超声1 min,使根表微生物全部进入缓冲液中,得到烟草根表微生物悬液,离心后去掉上清液即获得烟草根表微生物组。
1.3 根表微生物分离及鉴定
根表微生物分离所用培养基为胰酪大豆胨琼脂培养基(TSA)和TSA液体培养基。吸取0.2 ml根表微生物悬液,梯度稀释后,在1/10 TSA培养基上涂布,每个土壤处理3个重复。在20 ℃下培养7 d后,选择形态各异的菌株,用无菌接种环挑取单个菌落到TSA培养基上进行纯化培养。纯化多次后,即可得到单个菌株,根据平板细菌形态观察,舍弃重复菌株。
用细菌基因组DNA提取试剂盒(购于天根生物试剂公司)提取细菌总DNA,采用16S rRNA基因的通用引物:上游引物16S F:5′-AGAGTTTGAT CCTGGCTCAG-3′;下游引物16S R:5′-GGCTACCTT GTTACGACTT-3′对菌株进行16S rRNA基因序列扩增。将PCR反应产物送至上海生工测序,测序结果在NCBI上进行Blast比较分析,并与Genbank中的其他菌株基因序列进行同源性比较。
1.4 根表微生物促生能力测定
菌株接种到TSA液体培养基中,摇床振荡培养48 h(30 ℃,170 r/min),活化得到种子液。吸取2 µl种子液分别点接在无氮培养基、CAS检测培养基、无机磷培养基上,封口膜封口后于25 ℃下培养7 d。观察是否出现水解圈,以鉴定菌株的固氮、产铁载体以及溶解无机磷能力。用水解圈直径()与菌落直径()的比值(/)初步比较菌株促生能力强弱[16]。每个处理设置4个重复。
IAA产生能力测定:按1% 的接种量将种子基接入含有5 mmol/L色氨酸的TSA液体培养基中,30 ℃、170 r/min振荡培养48 h后,取1 ml菌液,10 000 r/min离心5 min。取上清液,加入等量Salkawski显色剂,黑暗中显色30 min后用酶标仪测定吸光值(OD530nm),同时制作浓度为0、10、20、30、40和50 µg/ml的标准曲线,计算IAA浓度[17]。
1.5 根表微生物促生效果验证
无菌烟苗制备:烟草种子于75% 酒精浸泡3 ~ 5 min,5% 次氯酸钠再次浸泡3 min,最后用无菌水冲洗3次。无菌种子转移至铺有无菌滤纸的培养皿中,每个皿中加入5 ml无菌蒸馏水。置于培养箱中30 ℃下培养10 d,每48 h检查是否污染杂菌。将发芽的烟苗移栽至灭菌基质中,培养到合适苗龄,用于后续促生效果试验。
无菌土获得:盆栽所用土壤同样是来自于永州市烤烟产区典型烟田土,高温高压灭菌后备用。
菌悬液制备:将上述通过促生能力测定筛选到的菌株进行温室盆栽促生效果验证。菌株种子液以1% 接种量接入到100 ml TSA液体培养基中,30 ℃、170 r/min振荡培养48 h,调整菌液浓度为OD600=1;离心8 min,沉淀用无菌水洗涤一次后重振,定容到50 ml以获得菌悬液。
将苗龄50 d的无菌云烟87幼苗移植装有200 g土壤的无菌纸杯中,每株幼苗根部接种5 ml菌剂,以根部接种5 ml无菌水为对照组(CK)。每种菌株处理设置7个重复,在无菌室中培养,随机摆放并定时改变摆放位置,45 d后测量烟草株高、地下部干物质量等相关促生指标。同时,在烟株收获时挑选部分处理的烟株,获得根系微生物组悬液,利用稀释平板涂布法测定菌株在根部的定殖情况。
1.6 数据处理与统计分析
用 Microsoft Excel 2010和IBM SPSS Statistics 26进行数据处理,并利用GraphPad Prism 8和Origin 2021进行作图。
2 结果与分析
2.1 烟草根表微生物组获取
植烟根表共分离纯化出细菌310株,经16S rRNA基因序列比对分析,分离的可培养微生物组主要有变形菌(Proteobacteria)、拟杆菌(Bacteroidetes)、厚壁菌(Firmicutes)和放线菌(Actinobacteria)4个细菌门(图1A)。在4种土壤中,变形菌门均是烟草根表的优势菌门,占总分离菌株的60.0%。纲水平上,4种土壤中的可培养微生物主要包含芽孢杆菌纲(Bacilli)、黄杆菌纲(Flavobacteriia)、噬纤维菌纲(Cytophagia)、鞘脂杆菌纲(Sphingobacteriia)、放线菌纲(Actinobacteria)、γ-变形菌纲(Gammaproteobacteria)、β-变形菌纲(Betaproteobacteria)和α-变形菌纲(Alphaproteobacteria)等(图1B)。其中,从土壤1中分离鉴定出的放线菌门和拟杆菌门明显少于其余3种土壤,而土壤2和土壤3中厚壁菌门分离数量较少。从土壤1和2中分离鉴定γ-变形菌纲的数量明显少于其他两种土壤,而β-变形菌纲呈相反趋势。土壤2中未分离出鞘脂杆菌纲微生物,土壤3中未分离出α-变形菌纲的微生物。
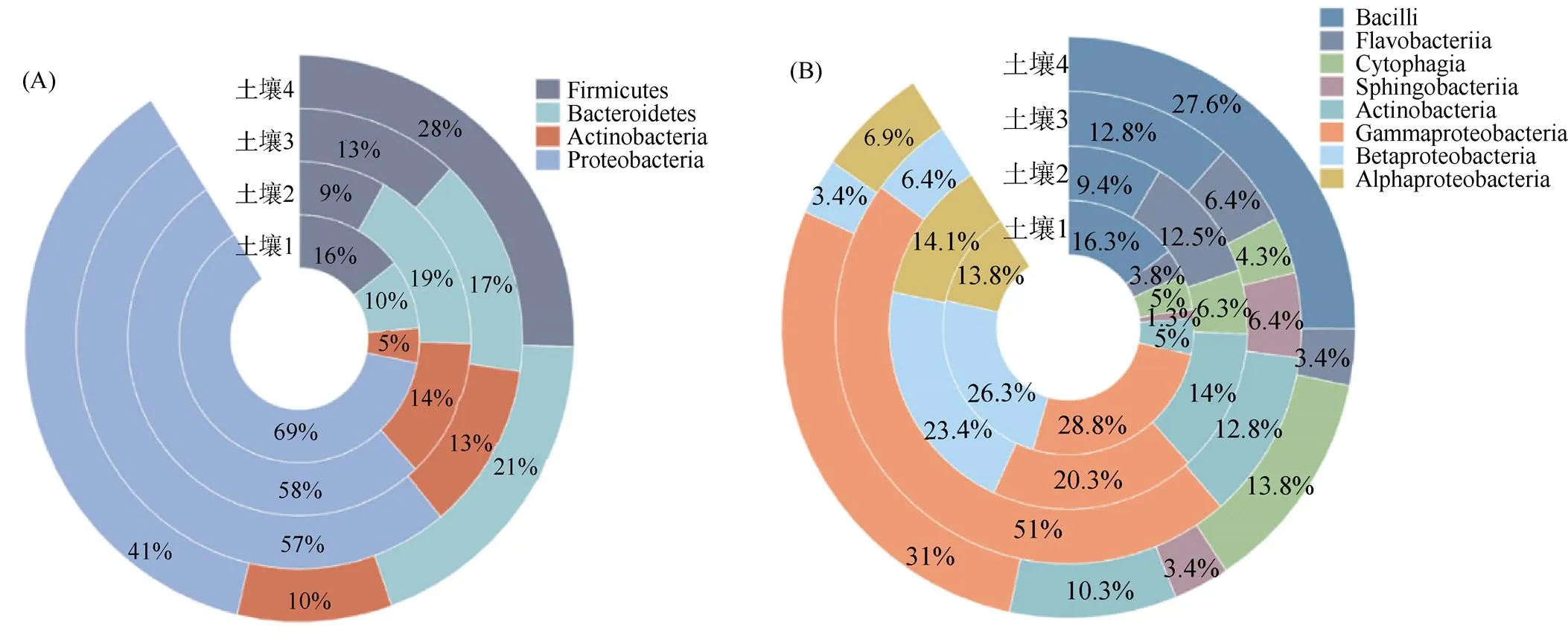
图1 不同土壤中烟草根表可培养微生物门(A)和纲(B)水平上的组成
在属水平上,这些可培养微生物组共包括31个细菌属类。其中,变形菌门中的假单胞菌属()和寡养单胞菌属(),拟杆菌门中的成对杆菌属(),以及厚壁菌门中的芽孢杆菌属()为4种供试土壤植烟根表共有的细菌类群。进一步结合维恩图分析发现,4种代表性土壤中烟草根表微生物群落在属水平上具有较大的差异(图2)。因此,为更多获得在烟草根表稳定定殖的、具有潜在促生作用的菌株,本研究选取了同时存在于3种及以上土壤中的细菌属类群来进行菌株筛选,对此挑选出代表性菌株共16株,隶属于4个门、6个纲、9个属(表3)。

图2 不同土壤中植烟根表微生物类群Venn图(属水平)
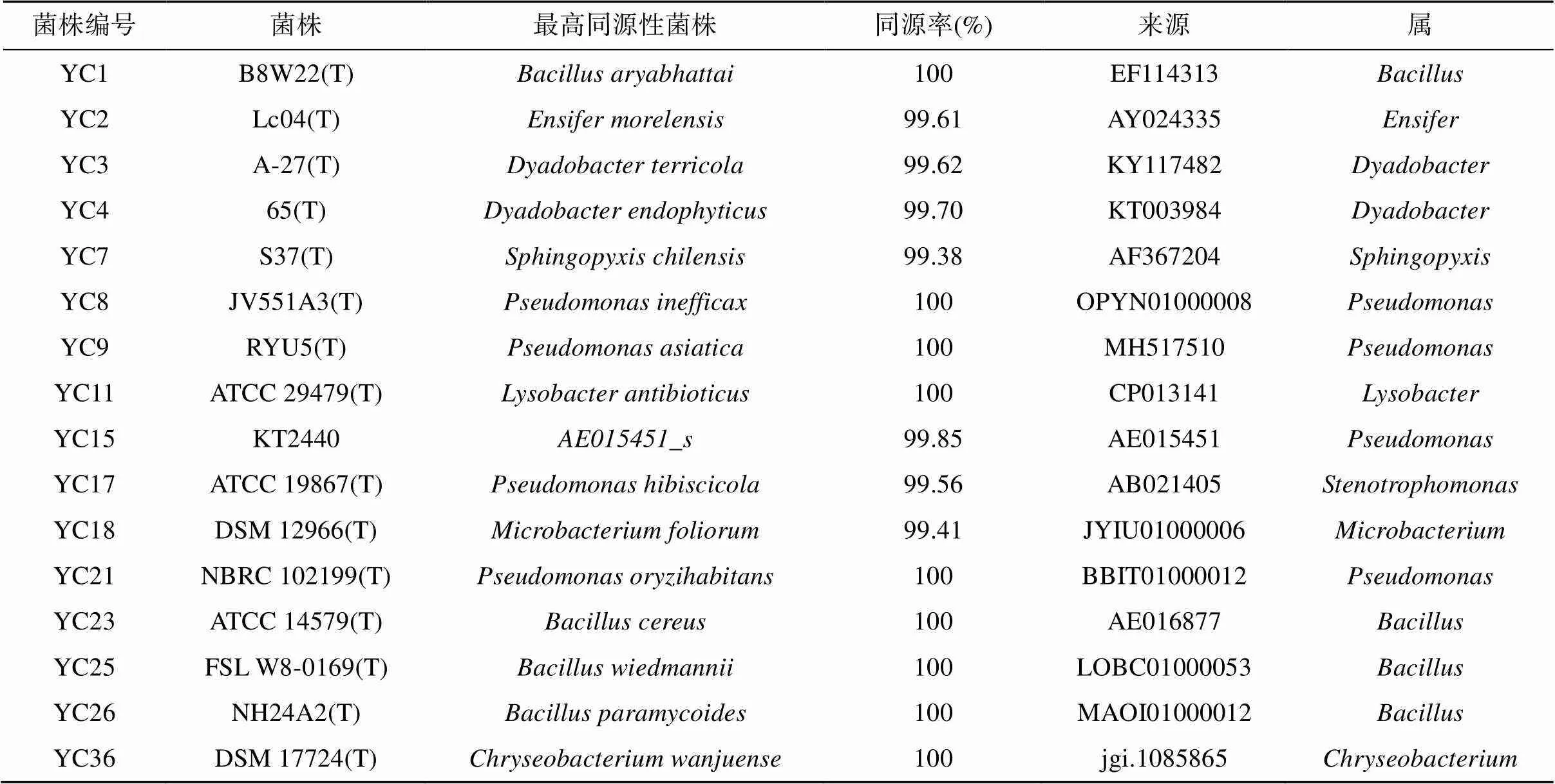
表3 烟草根表分离鉴定的代表性菌株
2.2 代表性菌株的促生能力分析
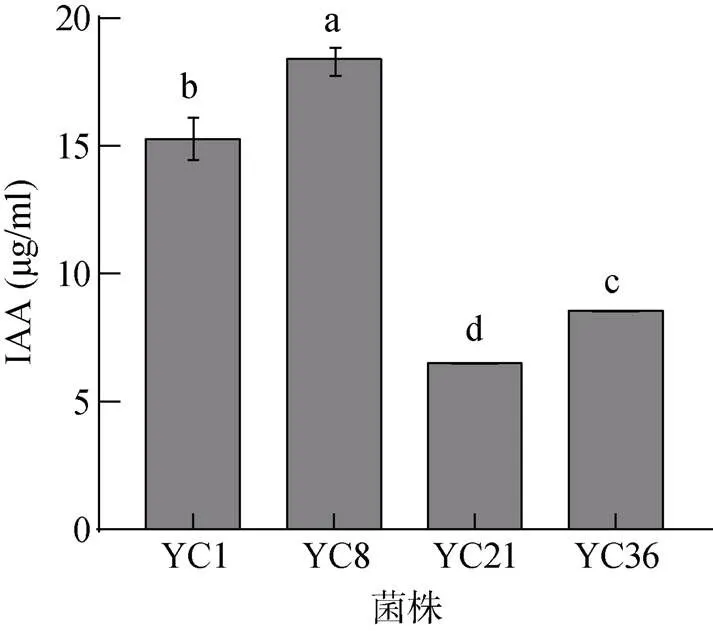
测定结果表明,16株菌中6株有固氮能力,其中菌株YC8表现出较强的固氮能力;有5株菌株具有产铁载体能力,其中YC8和YC15表现出了较强的产铁载体能力;4株菌株可以对无机磷进行溶解,其中YC8、YC9和YC21三株菌株具有较强的解无机磷的能力(表4)。有4株菌可产IAA,分别是YC1、YC8、YC21、YC36(图3)。其中菌株YC8产IAA能力最强,菌液中IAA含量为18.40 µg/ml;其次是YC1,菌液中IAA含量为15.27 µg/ml;分泌IAA能力最弱的是菌株YC21,含量为6.50 µg/ml。
2.3 温室盆栽试验
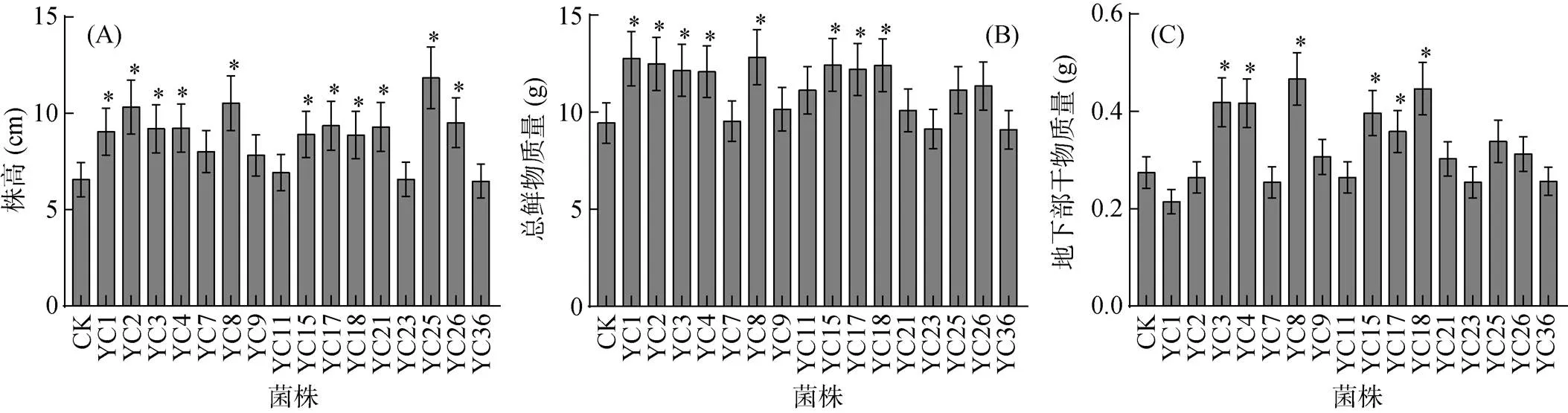
将16株菌株进行温室盆栽试验,通过对比烟草苗移栽前和采收后的促生指标的变化(图4),YC3、YC4、YC8、YC15、YC17和YC18处理下的烟草在多个指标中都表现出显著促进作用,占总接种菌株的37.5%。与CK处理相较,接种这6株菌株对烟草株高、总鲜物质量和地下部干物质量分别提高35.1%、27.9% 和30.7%。
3 讨论
植物根系微域微生物对促进植物生长、防治病害具有重要作用[18-20]。已有研究表明,烟草根系区域有多种不同的微生物类群,是烟草生长发育的关键影响因素[21-22]。周亚男等[23]从不发病烟田中的K326烟草根际分离筛选属于4个门、17个属的可培养微生物160株,其中γ-变形菌纲、芽孢杆菌纲和β-变形菌纲为主要优势类群,假单胞菌属和芽孢杆菌属是主要优势菌。在本研究中,从湖南省永州市烤烟产区4种代表性土壤的烟草根表分离鉴定出310株可培养细菌,分属于4个门、8个纲、31个属。相较于烟草根际可培养细菌类群,本研究在烟草根表发现了黄杆菌纲和噬纤维菌纲,而γ-变形菌纲、β-变形菌纲和芽孢杆菌纲在根际和根表中共同存在,但相对丰度明显不同,这种差异可能是由烟草根系对微生物的选择所造成。在属水平上,本研究发现多样性更高的根表微生物,而假单胞菌属、寡养单胞菌属、成对杆菌属和芽孢杆菌属为4种供试土壤烟草根表共有的细菌类群。目前有研究表明,很多来自于假单胞菌属和芽孢杆菌属等的菌株能通过溶磷、解钾和产IAA等方式促进烟草的生长[24-25]。因此,烟草根表共有的细菌种群可能包含对烟草健康生长有益的菌株。
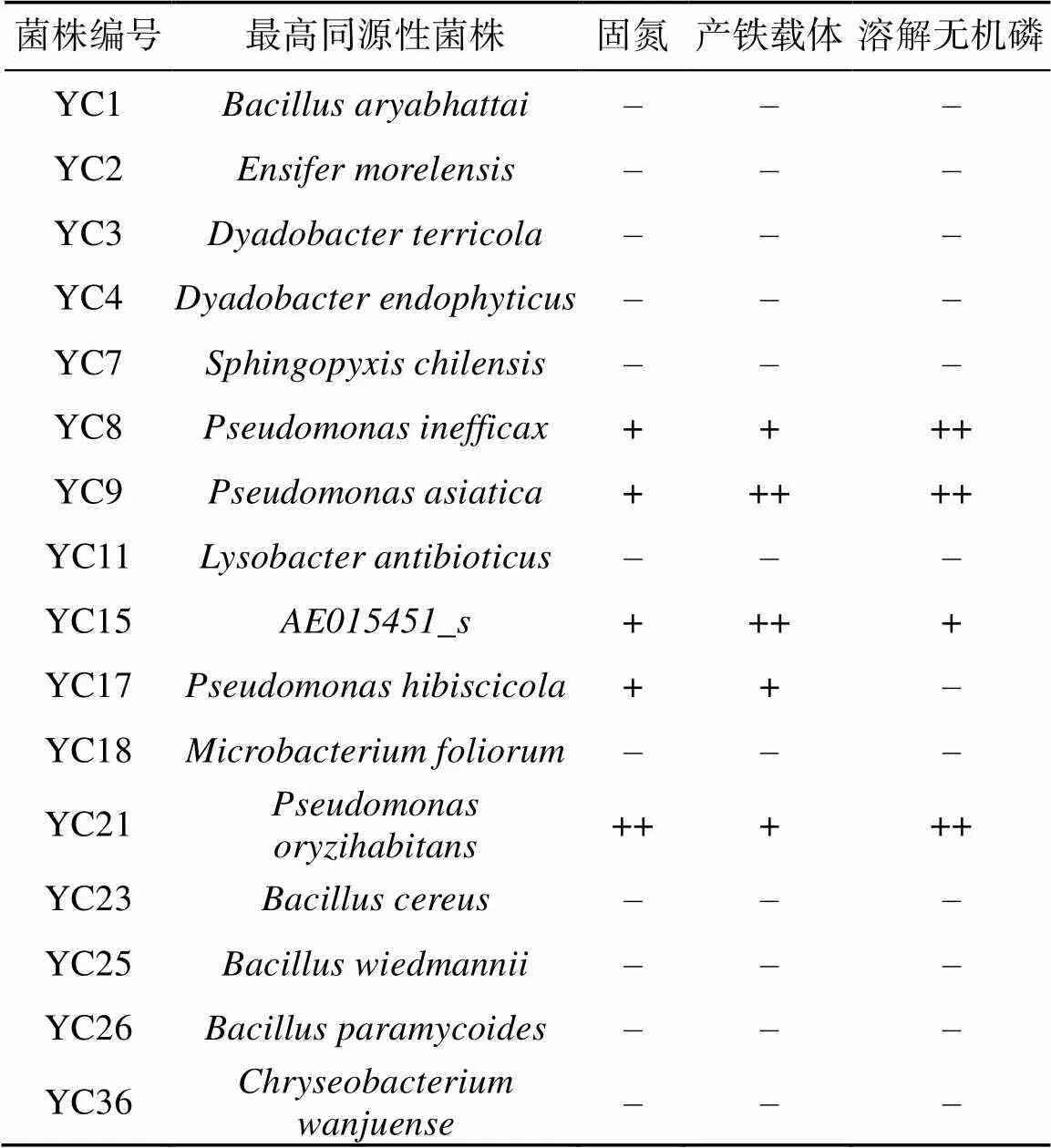
表4 菌株的促生能力
注:+:0
(柱状图上不同小写字母表示处理间差异显著(P<0.05))
(柱状图上的*表示处理组与对照组差异显著(P<0.05))
为获得的功能菌具有广谱适用性,本研究所选菌株以同时在3种及以上供试土壤中存在为筛选原则,从获得的根表微生物组挑选出代表性菌株进行微生物促生能力测定。结果发现,各微生物菌株在固氮能力、产铁载体能力、无机磷溶解及产IAA均具有一定功能特性,其中假单胞菌属的菌株YC8和YC21促生特性更为突出。孙晓莹等[26]发现假单胞菌属耐盐菌YZX4在不同盐浓度下同时具有较强的ACC脱氨酶活性、IAA合成能力、嗜铁素合成能力、固氮能力和溶磷(有机磷和无机磷)能力。假单胞菌株因具有多种促生能力可能会成为促进植物生长的潜在生物资源。进一步通过盆栽试验发现,有6株菌株在株高、总鲜物质量、地下部干物质量等指标中表现出显著的促进作用,其主要属于假单胞菌属、成对杆菌属、寡养单胞菌属和微杆菌属。因此,除了假单胞菌外,其他菌属也具有很多促进植物生长的细菌类型[27-28]。如,Kumar等[29]分离出sp.可通过根际生物固氮的方式促进植物氮素的获取。Egamberdieva等[30]发现嗜根寡养单胞菌DSM 14405T能促进植物的生长。同时,假单胞菌属、成对杆菌属和寡养单胞菌属为本研究4种代表性土壤中烟草根表共有的细菌属类,这为改善烟草根区微生态功能提供了依据和新思路。
综上所述,本研究通过烟草根表微生物组进行规模化分离鉴定,并获得了多株具有促生潜力的菌株,为后续应用研究提供了微生物资源和研究思路,也为进一步研究不同微生物之间的协同互作促进植物生长,改善植物根系微观微生物生态功能提供理论基础。
[1] 付秋娟, 刘加红, 张怀宝, 等. 初烤烟叶外观质量与其主流烟气有害成分释放量关系研究[J]. 中国烟草科学, 2015, 36(6): 94–99.
[2] 张仕祥, 过伟民, 李辉信, 等. 烟草连作障碍研究进展[J]. 土壤, 2015, 47(5): 823–829.
[3] 王梅勋, 陈利军, 王家民, 等. 玉米秸秆生物炭对烟田褐土水分库容及烤烟生物量的影响[J]. 土壤, 2015, 47(6): 1076–1084.
[4] 谭慧, 彭五星, 向必坤, 等. 炭化烟草秸秆还田对连作植烟土壤及烤烟生长发育的影响[J]. 土壤, 2018, 50(4): 726–731.
[5] 余小芬, 杨树明, 邹炳礼, 等. 菜籽油枯有机无机复混肥对烤烟产质量及养分利用率的影响[J]. 土壤学报, 2020, 57(6): 1564–1574.
[6] Wang Y, Li W Q, Du B H, et al. Effect of biochar applied with plant growth-promoting rhizobacteria (PGPR) on soil microbial community composition and nitrogen utilization in tomato[J]. Pedosphere, 2021, 31(6): 872–881.
[7] Begum N, Wang L, Ahmad H, et al. Co-inoculation of arbuscular mycorrhizal fungi and the plant growth-promoting rhizobacteria improve growth and photosynthesis in tobacco under drought stress by up-regulating antioxidant and mineral nutrition metabolism[J]. Microbial Ecology, 2022, 83(4): 971–988.
[8] 姜焕焕, 李嘉钦, 陈刚, 等. 解磷微生物及其在盐碱土中的应用研究进展[J]. 土壤, 2021, 53(6): 1125–1131.
[9] Yu P, He X M, Baer M, et al. Plant flavones enrich rhizosphere Oxalobacteraceae to improve maize performance under nitrogen deprivation[J]. Nature Plants, 2021, 7(4): 481–499.
[10] Cantabella D, Teixidó N, Segarra G, et al. Rhizosphere microorganisms enhanceroot and plantlet development ofandrootstocks[J]. Planta, 2021, 253(4): 1–11.
[11] 何斐, 张忠良, 崔鸣, 等. 健康魔芋根表土壤优势细菌鉴定及其抗病促生作用[J]. 西北农业学报, 2015, 24(8): 75–83.
[12] 张从宇, 孔德树. 大豆根表拮抗细菌的筛选及其防病作用[J]. 农药, 2005, 44(2): 90–92.
[13] 姚小东, 李孝刚, 丁昌峰, 等. 连作和轮作模式下花生土壤微生物群落不同微域分布特征[J]. 土壤学报, 2019, 56(4): 975–985.
[14] Niu B, Paulson J N, Zheng X Q, et al. Simplified and representative bacterial community of maize roots[J]. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(12): E2450–E2459.
[15] Edwards J, Johnson C, Santos-Medellín C, et al. Structure, variation, and assembly of the root-associated microbiomes of rice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(8): E911–E920.
[16] 赵翔, 谢志雄, 陈绍兴, 等. 适合高产铁载体细菌筛选、检测体系的改进与探析[J]. 微生物学通报, 2006, 33(6): 95–98.
[17] Glickmann E, Dessaux Y. A critical examination of the specificity of the salkowski reagent for indolic compounds produced by phytopathogenic bacteria[J]. Applied and Environmental Microbiology, 1995, 61(2): 793–796.
[18] 戚秀秀, 魏畅, 刘晓丹, 等. 根际促生菌应用于基质对水稻幼苗生长的影响[J]. 土壤, 2020, 52(5): 1025–1032.
[19] 桂莎, 刘芳, 张立丹, 等. 复合菌剂防控香蕉枯萎病的效果及其微生物学机制[J]. 土壤学报, 2020, 57(4): 995–1007.
[20] 王丹丹, 殷志秋, 孙丽, 等. 缓解花生连作障碍的根际促生菌分离及功能鉴定[J]. 微生物学报, 2021, 61(12): 4086–4096.
[21] 滕凯, 陈前锋, 周志成, 等. 烟草连作障碍与土壤理化性质及微生物多样性特征的关联[J]. 微生物学通报, 2020, 47(9): 2848–2856.
[22] 黎妍妍, 王林, 彭五星, 等. 烟草青枯病不同发病阶段根际土壤微生物群落变化趋势分析[J]. 中国烟草科学, 2020, 41(5): 73–78.
[23] 周亚男, 韩小斌, 魏可可, 等. 烟草根际可培养微生物多样性及防病促生菌的筛选[J]. 微生物学通报, 2021, 48(12): 4649–4663.
[24] 黄智华, 崔永和, 计思贵, 等. 云南烤烟根际土壤PGPR菌株的筛选与鉴定[J]. 中国烟草科学, 2017, 38(5): 18–23.
[25] 龚文秀, 曹媛媛, 倪海婷, 等. 烟草亲和性解钾PGPR菌株筛选及其促生效果研究[J]. 中国烟草学报, 2016, 22(1): 55–63.
[26] 孙晓莹, 陈意超, 曹沁, 等. 耐盐菌YZX4的筛选、鉴定及其植物促生特性[J]. 应用与环境生物学报, 2019, 25(5): 1133–1138.
[27] 朱梦卓, 孙洋洋, 赵晓妍, 等. 野大豆内生假单胞菌YDX26的鉴定及促生抗逆特性[J]. 微生物学通报, 2021, 48(11): 4100–4110.
[28] 杨杉杉, 李国光, 张胜男, 等. 假单胞菌BP16的分离鉴定及其植物促生性状和效应[J]. 微生物学通报, 2018, 45(10): 2121–2130.
[29] Kumar S, Suyal D C, Bhoriyal M, et al. Plant growth promoting potential of psychrotolerantsp. for pulses and finger millet and impact of inoculation on soil chemical properties and diazotrophic abundance[J]. Journal of Plant Nutrition, 2018, 41(8): 1035–1046.
[30] Egamberdieva D, Kucharova Z, Davranov K, et al. Bacteria able to control foot and root rot and to promote growth of cucumber in salinated soils[J]. Biology and Fertility of Soils, 2011, 47(2): 197–205.
Culturable Bacterial Community of Tobacco Root Surface and Their Growth-promoting Characteristics
LIU Donghui1, LI Fengqiao1, JIN Zhili2*, LI Xiaogang1*
(1 College of Biology and the Environment, Nanjing Forestry University, Nanjing 210037, China;2 Yongzhou Tobacco Company of Hunan Province, Yongzhou, Hunan 425000, China)
Plant microbiome is an important factor in plant growth, stress resistance and disease prevention. In order to find the role of plant microbiome in promoting growth and improving root microecology of tobacco, in this study, culturable bacteria were isolated from the root surface of tobacco, and the growth promoting ability of different strains was determined. The results showed that: 1) 310 culturable strains were isolated from the root surface of tobacco, belonging to 31 genera, in which most areand. 2) Comparative analysis showed that,,, andare the common bacteria in tobacco root surface of different tested soils. 3) Within 16 strains obtained by further screening, 6 strains have the ability to fix nitrogen, 5 strains can produce siderophores, 4 strains can dissolve inorganic phosphorus, and 4 strains can produce IAA. 4) Pot experiment verified the growth promoting effect of the strains, the six strains increased the plant height, total fresh weight and underground dry weight by at least 35.1%, 27.9% and 30.7%, respectively, accounting for 37.5% of all inoculated strains. In short, a variety of strains with growth-promoting ability can be isolated from the root surface of tobacco, which provides a theoretical basis for the construction of microbial community to promote tobacco growth in the future.
Tobacco root surface; Cultivable bacteria; Growth promotion screening; Plant microbiome
Q939.96
A
10.13758/j.cnki.tr.2022.04.012
刘冬晖, 李凤巧, 靳志丽, 等. 烟草根表可培养细菌群落组成及典型菌群的促生特性研究. 土壤, 2022, 54(4): 750–755.
中国烟草总公司湖南省公司科技项目(18-20Aa03)资助。
(jinzhili666@126.com; xgli@njfu.edu.cn)
刘冬晖(1997—),女,山东济南人,硕士研究生,主要研究方向为微生物生态。E-mail: 984526870@qq.com

