过一硫酸盐的化学氧化机理及在有机污染土壤修复中应用研究进展①
周明珠,仓 龙
过一硫酸盐的化学氧化机理及在有机污染土壤修复中应用研究进展①
周明珠1,2,仓 龙1*
(1 中国科学院土壤环境与污染修复重点实验室(南京土壤研究所),南京 210008;2 贵州师范大学贵州省山地环境信息系统与生态环境保护重点实验室,贵阳 550001)
基于过一硫酸盐(PMS)的高级氧化技术因反应快速高效、降解有机污染物效果优越,在环境修复领域拥有广阔的应用潜能。经过活化的PMS化学氧化技术在有机污染废水处理中被广泛应用,污染物的去除机制也在不断被发现并完善,其在有机污染土壤修复中也已得到应用。本文综述了PMS对有机污染物的化学氧化机制,分析了有机污染物降解的自由基和非自由基反应过程,探讨了不同活化方式(碱、过渡金属、碳基材料、辐射等)对PMS降解有机污染物的影响,阐述了PMS在有机污染土壤修复中的研究进展和存在问题,并进行了研究展望。
过一硫酸盐;化学氧化;有机污染土壤;修复
随着工业的发展与进步,在过去的几十年中,越来越多的有机污染物被排放到环境中。这些污染物大多具有持久性与难以生物降解性,对生态系统和人类的健康造成了巨大威胁,引起了人们越来越多的关注[1-4]。土壤中的有机污染物常常来源于大气沉降、污水灌溉、工业泄漏和工业废物倾倒等,这些污染物在土壤中积聚,与土壤有机质紧密结合,稳定且难以降解,拥有显著的生物累积性与三致效应。常用的有机污染场地修复技术有热脱附[5]、化学氧化[6]和水泥窑协同处置技术[7]等,这些处理技术各有所长,其中化学氧化技术由于其可原位修复、设备简单易操作,具有较为广泛的应用前景。鉴于传统的氧化工艺具有处理效率低、难以去除复杂的有机污染物等局限性,高级氧化工艺(advanced oxidation process,AOPs)逐渐发展起来,并有效运用于处理高浓度有机污染废水及土壤[8-10]。高级氧化工艺是一种基于自由基反应,可快速有效降解污染物的技术,其在反应时可以产生多种自由基,例如羟基自由基(·OH)、硫酸根自由基(SO4·–)和超氧阴离子自由基(O2·–)等,该技术已有较多的工程应用。因为自由基具有反应速率较快、氧化能力强大等特征,水体或土壤中的有机污染物能够得到非选择性的快速降解[11-13]。
目前用于高级氧化技术的氧化剂主要有H2O2、过二硫酸盐(peroxodisulfate, PDS)、高锰酸盐和臭氧等。过一硫酸盐(peroxymonosulfate, PMS)是一种新型的无机硫酸盐氧化剂,其作为SO4·–良好的产生前体,在降解污染物的速率和活化方式上,展现出比PDS降解污染物更优越的性能。基于PMS的高级氧化技术已被认为是应对有机污染物的有效手段之一,探究PMS在降解污染物过程中的化学氧化机理也成为了当前研究的热点[11-13]。本文从PMS的结构和性质出发,分析其高级氧化机理,论述目前活化PMS的主要方法,并探讨其降解有机污染物的机理,分析其在有机污染土壤修复中的优势及存在问题,以期推动PMS在有机污染土壤修复中的应用。
1 PMS的氧化反应机制
1.1 PMS的结构和化学反应特点
目前常用的PMS为过一硫酸盐复合物KHSO5· 0.5KHSO4·0.5K2SO4,又可称为卡罗酸(Caro’s acid),其主要活性成分为KHSO5,呈白色粉末状。过一硫酸根离子(HSO5–)是过氧化氢(H2O2)的衍生物,其中一个H原子被SO3基团所取代,因此其参与化学反应时的一些特性也兼具了H2O2的反应特点[14]。PMS在pH<6和pH=12时不稳定,而在pH <1时容易水解成过氧化氢[15]。PMS的氧化还原电位介于H2O2(1.76 V)和PDS(2.01 V)之间,为1.82 V,故在不活化的情况下它本身的氧化能力比H2O2强,但稍弱于PDS。
PMS与PDS的物质结构中均包含了O–O键,不同的是PMS具有不对称的分子结构,而PDS是对称的,这种结构上的差异使得PDS比PMS更加稳定,需要获得更高的输入能量才可以使其结构中的O–O键断裂生成自由基。与PDS相比,PMS由于本身分子结构和键解离能的差别,相对更容易被活化剂活化[16],且活化后产生的活性物质种类更丰富。在催化活化PMS和PDS的过程中,PMS也可以降低活化剂的消耗,例如在使用非均相催化剂(常见的Fe0)活化PDS时,Fe0生成Fe3+的过程是不可逆的转化[17]。活化PMS的非均相活化剂则可以通过氧化还原循环过程得以再生(例如Co2+到Co3+到Co2+)[18],这不仅减少了活化剂的消耗,还降低了修复后的环境风险。PMS和PDS的性质比较见表1。
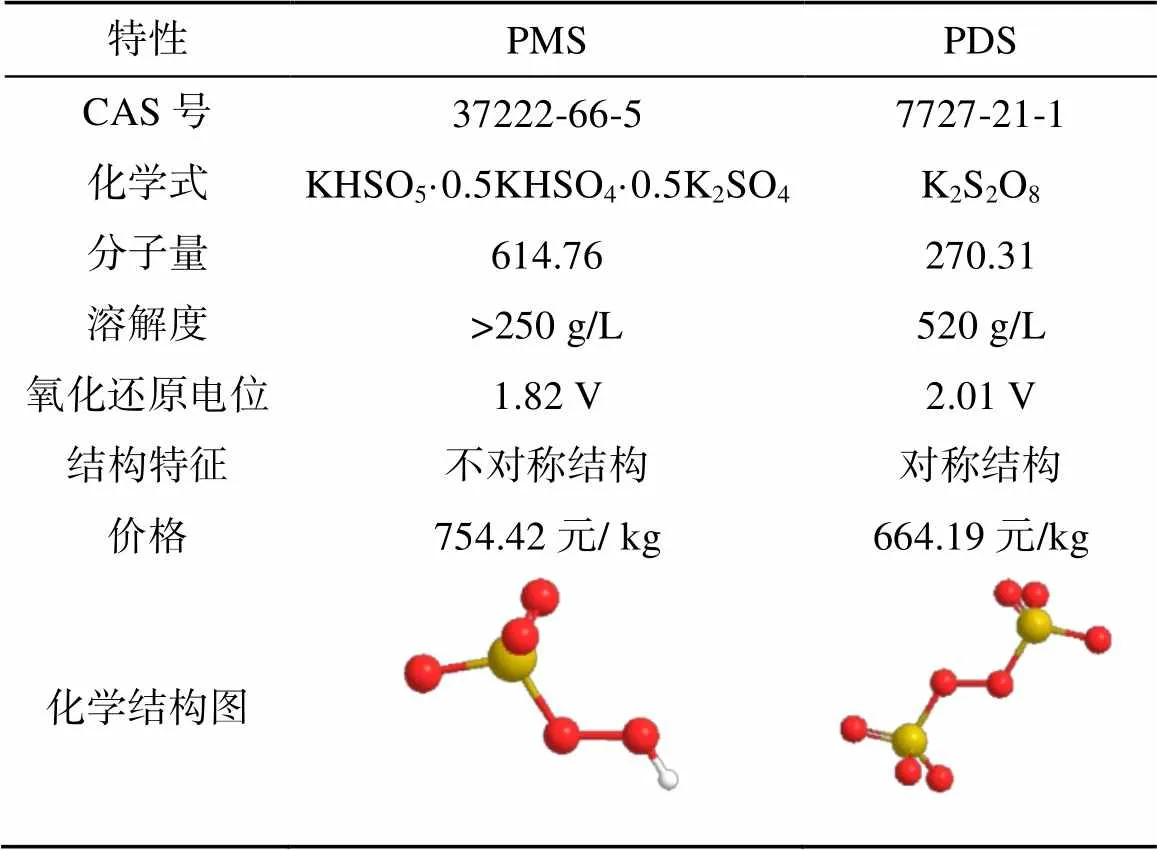
表1 PMS和PDS的性质比较
注:价格来源于Sigma-Aladrich官网(2021年8月23日)。
在对有机污染物进行氧化降解的过程中,PMS主要从2种不同的途径参与污染物的降解,即自由基过程与非自由基过程。区分这两种过程的标准就在于,其降解反应是否依赖于体系中自由基的产生。如果PMS参与的降解有机物反应,自由基完全不负责体系中有机物的降解(可用淬灭实验判断),则该反应过程可以被定义为完全非自由基过程。换言之,如果体系中产生的自由基可造成有机污染物的100% 降解,则该系统可以被定义为完全自由基过程。如果是体系中的自由基和非自由基都有助于目标有机污染物的降解,则称为混合反应。
1.2 PMS氧化的自由基反应机制
在利用PMS作为化学氧化剂时,可采取多种方式对其进行活化产生自由基,从而实现对有机污染物的高效降解[19-21]。热[22]、碱[23]、金属离子[24]、辐射[25]等方式均可以使PMS内部的分子键断裂生成具有高氧化性的自由基团。·OH和SO4·–基被认为是参与反应的主要自由基,产生自由基的过程可归结为如下反应方程式[21]:
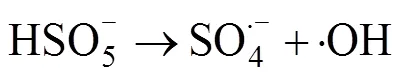


这两种自由基都有很强的得电子能力,可与大多数有机物发生化学反应,将有毒物质降解为小分子无毒的有机物或者直接矿化为无机物。当pH<9时,参与反应的主要自由基是SO4·–;而当pH>9时则主要是 ·OH参与反应。因为兼具了SO4·–和 ·OH,PMS对污染物的降解适用pH范围也更加广泛。利用不同的方法活化PMS可以生成氧化还原电位不同的自由基[21]。
1.3 PMS氧化的非自由基反应机制
PMS的直接氧化过程属于非自由基氧化反应。由于PMS具有相对较高的氧化电势,其拥有通过电子转移途径直接氧化有机污染物的潜力,尤其是对含有醌类官能团的有机物[26]。在Yin等[27]的研究中,PMS的非自由基降解过程被首次系统地证明,该研究采用理论计算及实验检测相结合的方法验证了PMS的直接氧化反应。该研究通过淬灭反应,将体系中的自由基几乎完全清除后,仍观察到磺酰胺类抗生素(SAs)被PMS高效强力降解的效果,从而证明了非自由基的氧化过程是SAs被PMS降解的有效途径。此外,该研究还通过降解苯酚的试验验证了单线态氧(1O2)的贡献,进而证明PMS降解SAs的机制为直接氧化的非自由基过程。
基于活化PMS产生自由基降解污染物的过程虽然高效,但因为自由基的寿命过于短暂以至于在实际污染物降解过程中有很多自由基还来不及与污染物作用就已经被淬灭,致使氧化剂的利用率降低。此外,在处理实际水体和土壤时,一些环境中存在的无机阴离子(Cl–[28]、SO42–[22]等)也可以起到淬灭自由基的作用,或先于污染物与氧化剂发生反应,从而影响最终降解效果。因为自由基寿命短暂,近年来PMS的非自由基氧化过程越来越受到关注。其中,1O2被认为是在其非自由基反应中的主要活性物质,其反应过程如下:
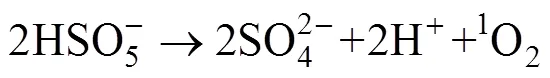
1O2是一种强力的、有选择性的氧化剂,其与一些难降解的污染物——苯酚、胺类、多环芳烃等化合物具有较高的反应性。PMS除被激发生成O2·–然后反应生成1O2之外,还可通过自身分解产生这种强氧化物质(如方程式(4)所示)。
与自由基氧化相比,非自由基的氧化过程对环境的适应能力更强。PMS生成的1O2对反应溶液的pH有更宽泛的适应范围。根据Liu等[29]的研究,由Bi25FeO40/PMS体系产生1O2去除左氧氟沙星,左氧氟沙星可以在pH 3 ~ 9的范围内获得有效降解。生活污水和工业废水往往含有大量的无机阴离子或者背景有机物,PMS的自由基降解过程往往会因此而受影响,而根据Ma等[30]的研究发现,在NCNTFs/PMS的非自由基氧化系统中,添加常见的阴离子作为背景值几乎不会影响目标污染物的降解。对于实际的污染废水处理,这两项特征充分表明了PMS基于非自由基的催化氧化反应在未来的实用前景。图1归纳了PMS在氧化有机污染物过程中的自由基和非自由基反应过程。
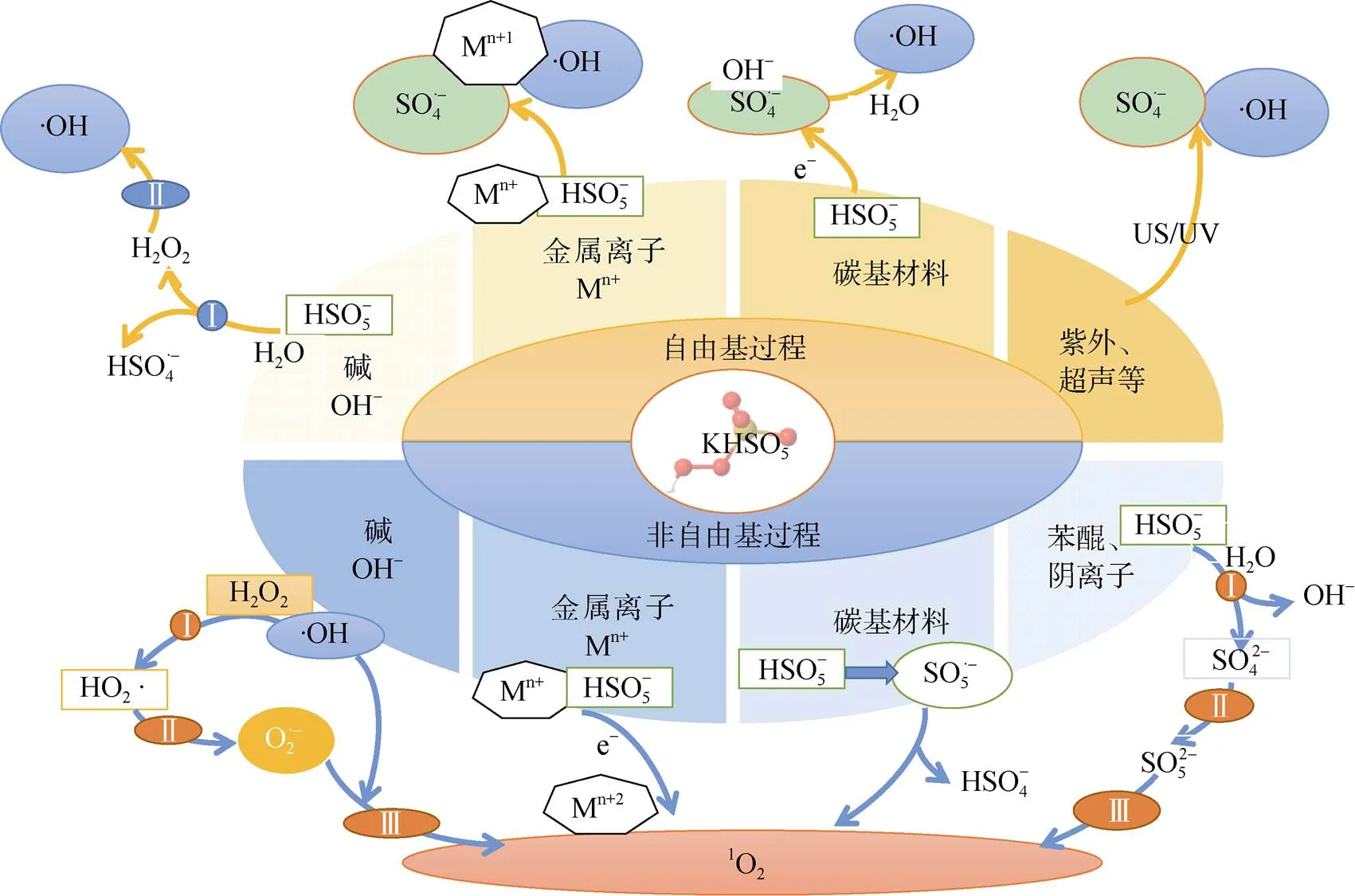
图1 PMS氧化的自由基和非自由基过程
2 PMS的活化机制
利用PMS进行氧化的活化机制多种多样,一般可通过活化措施攻击PMS的O–O键使其断裂生成自由基,也可通过表面电子转移和1O2的生成来加强PMS对有机污染物的降解性能。通过活化作用,可以在使用相对较少的氧化剂的情况下达到较为理想的修复效果。
2.1 碱活化机制
在PMS的分解反应中,pH起着关键作用。在碱性条件下,PMS所分解的SO4·–可以进一步转化为·OH。尽管SO4·–是PMS在酸性条件下的主要反应物种,但在中性条件下,SO4·–和·OH都有助于有机污染物的降解。碱活化的PMS被认为是降解有机污染物的有效方法,其通常需要与其他活化方法(例如金属离子)结合使用,以获得更好的降解有机污染物的效果[21]。在Nie等[31]的研究中,利用Ca(OH)2/PMS系统,在体系pH为8.95的碱性条件下去除废水中的双酚A(BPA),该研究实现了在复杂废水体系(多种阴离子的高背景值)中对BPA的高效去除,其中Ca(OH)2还和废水中的磷反应并生成了不溶性沉淀物作为磷的絮o凝剂。
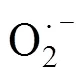

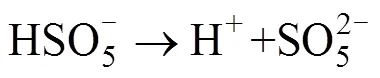
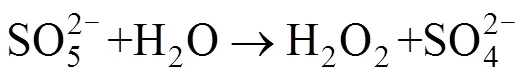
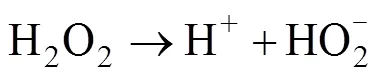
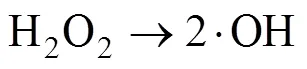
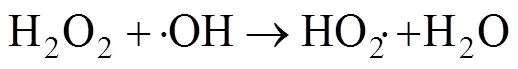


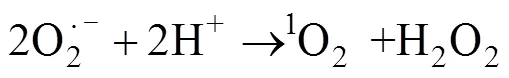

在碱性条件下,活化后的PMS也可以通过非自由基过程参与有机物的降解反应[23]:


式中:Nu为焦磷酸盐(PA)和三聚磷酸盐(PB)反应过程中的中间体。
值得注意的是,碱性条件下不同浓度的OH–的存在对活化PMS有着复杂的影响。Zhou等[33]发现,在pH为8.5的情况下,2 ~ 10 mmol/L的Cl–显著促进了甾体雌激素的降解。相比之下,Yin等[27]的研究表明,pH为7的情况下,5 mmmol/L 的HCO3–和PO43–对PMS降解磺酰胺类抗生素存在显著抑制。Ca(OH)2活化PMS降解BPA的试验也表明了无机阴离子对体系的影响,体系中Cl–的存在显著加速了PMS对BPA的降解,而随着HCO3–含量的增加,降解效果减弱[31]。这种现象的产生可能与背景中无机阴离子的含量有关。Zhou等[33]的研究指出,无机阴离子对PMS活化的促进或者抑制作用取决于有机污染物与PMS反应的速率常数(k1)和反应性氧化剂的生成速率常数(k2),若k2>k1,则与单独的 PMS相比,无机离子的存在和相应反应性氧化剂的形成可以促进有机污染物的降解;若k1>k2,则无机离子的存在可能不利于有机污染物的降解,且当无机离子的浓度过高时,甚至会抑制有机污染物的降解[33]。表2汇总了基于碱活化的PMS降解有机污染物案例。

表2 基于碱活化的PMS降解有机污染物案例
2.2 过渡金属活化机制
在氧化剂活化产生自由基的方式中,在反应体系中添加过渡金属的方法在室温下即可高效进行,无需外加能量,因此这种方法被广泛应用。其中,研究较广的Fenton反应就是利用Fe2+与H2O2反应生成·OH并在室温下高效降解污染物[36]。但基础Fenton反应的局限性就在于其pH利用范围较小,仅在pH 2 ~ 4之间才能反应,故利用Fenton反应原理而使用其他过渡金属或活性物质的类Fenton技术逐渐发展起来。
过渡金属离子活化PMS的过程是通过金属表面的电子转移来实现的。金属表面的电子被转移至氧化剂上,此时金属失去电子价态升高,而氧化剂被还原生成自由基。理论上,过渡金属其氧化形式的还原电位越高,其活化PMS的效率就越高。该类反应机理可以描述为以下方程[37]。


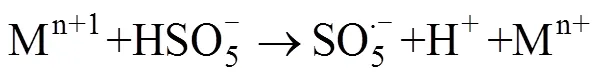
Anipsitakis等[24]研究发现,Co2+是活化PMS效果较好的金属离子;随后其进一步研究了Ag+、Ce3+、Co2+、Fe2+、Fe3+、Mn2+、Ni2+、Ru3+和V3+共9种过渡金属对PMS活化降解2,4-二氯苯酚(2,4-DCP)的效果[37],研究表明,对PMS活化效果最强的是Co2+和Ru3+,几种过渡金属离子介导的活化降解效果为Ni2+ 大量的高浓度污染废水和原位有机污染土壤使用这种方法往往需要大量的金属离子参与,金属离子回收的困难及可能造成的潜在环境风险往往成为掣肘。在此背景下,非均相的活化技术得到了越来越广泛的关注。金属离子能够以各种形式负载在不同载体上(例如氧化物、分子筛、碳质材料和金属有机骨架等),以在载体表面发生电子转移的方式进行PMS的活化,在反应之后还可以进行重复利用。Anipsitakis等[42]首次使用了固体Co3O4对PMS进行了活化,在中性pH条件下,2 h内实现了2,4-DCP污染物的全部降解,且钴的总溶出量低至70 μg/L。且在此试验的过程中,固体Co3O4表面的Co2+活化PMS产生SO4·–,Co2+被氧化为Co3+,接着Co3+与SO4·–反应又变成Co2+,通过Co3+和Co2+循环来获得可重复使用的活化能力。铁基非均相活化剂的形式多种多样,纳米零价铁、铁硫化物、纳米铁酸铜等物质均表现出了良好的催化活化效果。 在过去的研究中,大量的文献报道了金属离子活化PMS生成自由基从而参与降解反应,而对于PMS与金属离子的非自由基氧化过程则关注较少。迄今为止,仅对高价金属铁(IV)、铜(III)催化的PMS活化体系提出了非自由基介导的氧化过程[43-44],其反应方程式如下: 相较于单纯的金属离子,金属氧化物对PMS的非自由基活化机理在最近被更多地报道出来。MnO2[45]、铁掺杂的MnO2[46-47]、CuO[48]、Cu2O[49]、CuOMgO/Fe3O4[50]等金属氧化物均可通过非自由基途径活化PMS并产生活性物质。金属氧化物活化PMS的非自由基过程主要是在金属氧化物的表面发生络合作用,在激活的状态下削弱PMS内部的O–O键,使电子转移过程得以发生[49]。除了电子转移过程,生成1O2的过程也是PMS被金属氧化物活化的途径,金属氧化物表面生成的高价金属反应位(Cu(Ⅲ) 和Mn(Ⅳ)),是PMS生成1O2的关键[45,47,50]。表3汇总了基于过渡金属活化的PMS降解有机污染物案例。 碳基材料因其表面积大、稳定性高和环境友好从而被广泛用作环境修复的吸附剂和催化剂[66]。碳基材料种类繁多,基质材料的不同和组成结构的差异会影响材料本身的氧化还原电位,进而影响其与PMS之间的电子传递。常用的碳基材料包括氧化石墨烯、碳纳米管、活性炭等物质,活化PMS的机理主要是电子在其表面传递生成OH–和SO4·–(式24),一部分生成的物质可以通过自发反应生成·OH和SO42–(式25),SO4·–和水也可以发生反应生成·OH和SO42–(式26),主要反应过程如下: 表3 基于过渡金属活化的PMS降解有机污染物案例 碳基材料具有相当大的比表面积,且含有众多的含氧官能团,这使它除具有良好的物理吸附能力之外,化学吸附能力也很强大。在降解有机污染物时,这些材料不仅可以将有机物从污染介质中分离出来吸附在其材料表面,还能将PMS等氧化物质一同吸附在表面,从而发生化学反应。含碳物质可以通过方程式(27) ~ 式(33)激活PMS生成O2·–以氧化有机污染物。在污染物的降解中,O2·–通常充当形成其他活性物质(例如SO4·–、·OH和1O2)的中间体而非直接氧化污染物[32]。自由基的产生过程如下: Sun等[67]研究了表面氮改性的碳纳米管,发现原始的多壁碳纳米管(MWCNT)可以有效地激活PMS,通过硝酸铵对其进行表面氮改性后,可以将PMS对苯酚的降解效率显著提升7.8倍。颗粒状的活性炭(GAC)同样可以对PMS起到强力的催化效果。在降解偶氮染料酸性橙7(AO7)的过程中,GAC/PMS组合系统可以拥有显著的协同作用,且活性炭在重复利用4次、基本失去吸附活性后,仍对PMS具有强力的催化活化作用,使整个体系比单独使用PMS对AO7的脱色效果更快速[68]。 基于碳基材料的非自由基活化反应,一般有3种,分别是形成碳质催化剂和PMS的络合物、直接电子转移和生成1O2。在氮的掺杂域上,拥有大量流动电子的未掺杂碳晶格和具有不成对电子的边缘位点,这些位点均可以激活PMS分子,从而生成少量的SO42–和·OH,如果改变掺杂物质的种类或者缺陷位点,氮掺杂碳材料对PMS的自由基活化可由自由基途径转变为非自由基途径,主要活化原理是材料表面的电子转移[69]。Duan等[70]发现,纳米石墨的退火温度不同对其催化活化性能有很大影响,将纳米级石墨的碳化程度提高甚至会将PMS的活化主导机制由自由基机制转变为非自由基的催化氧化机制。在400~900℃的高温下煅烧碳纳米管时,其sp3杂化碳可能转变为sp2杂化碳,从而有助于有机污染物与PMS之间通过导电性碳网络进行电子转移,实现非自由基机制的活化[71]。 Gao等[72-73]研究了PMS在氧掺杂石墨氮化碳(O-CN)上的混合(非自由基和自由基)活化途径: 首先,PMS在缺电子的碳原子上单电子氧化诱导SO5·–的形成,进而和H2O反应转化为1O2;或者在富电子的氧原子上,PMS通过单电子还原导致·OH和SO4·–两种自由基的生成。有机物中存在的C=O基团、碳基材料的结构缺陷和添加带有负电性的氮均可以成为PMS分解生成1O2的反应位点[74]。表4汇总了基于碳基材料活化的PMS降解有机污染物案例。 除了以上活化机制外,许多物理方法例如辐射、超声、加热等也可以对PMS进行活化。 表4 基于碳基材料活化的PMS降解有机污染物案例 包括紫外线、伽马射线在内的辐射均可以激活PMS,这些不同的辐射技术中,紫外线被认为是良好的且具有成本效益的活化方式。量子产率是表征PMS被激活的重要因素,紫外波长对量子产率有重要影响,在光化学反应中,量子产率越低表示其对光量子的利用率越低(量子产率=(荧光发射量子数)/(被物质吸收的光子数))。在248 ~ 351 nm范围内,随着紫外波长的增加,SO4·–的量子产率逐渐降低,因此通常采用248和254 nm作为紫外活化PMS的波长[84]。紫外活化PMS可能涉及两个机制,其一是通过紫外线输入的能量破坏PMS分子结构中的O–O键,生成·OH和SO4·–: 另一个机制是紫外线照射水分子产生电子,然后通过电子传导使PMS活化产生自由基: 伽马辐射是废水处理中的一项新兴技术,适用于去除有毒有机污染物[85]。在伽马射线的辐射过程中,PMS会产生·OH、水合电子氢原子等活性物质,这些物质可以参与降解有机污染物的反应[86]。伽马射线比紫外线拥有更好的穿透能力,因此在实际污水处理和有机污染土壤修复中,可能会有更大的应用潜力。 超声也是活化PMS的有效方法。超声活化因为在空化气泡破裂时会产生局部高温,因此其活化机制与热活化相似,主要是依靠高温来破坏PMS中的O–O键,使其裂变产生自由基。一般来说,超过50℃的温度就可以使PMS活化[87]。超声活化PMS还可以与其他活化条件产生协同效果,在200 W超声的条件下,在PMS体系中加入磁性Fe3O4纳米颗粒后,可以在30 min内将AO7的降解效率从39.6% 提升至90%[88]。降解效率的提升与超声的功率有重要关系,在此项研究[88]中,还研究了超声功率从160 ~ 240 W对AO7降解效果的影响,当超声作用于溶液时,溶液中会产生空化气泡和微流,这两者都会产生湍流效果并增强溶液中的传质反应,从而提高氧化剂与活化剂间的反应速率。与此同时,超声功率的增加会加速氧化剂分解产生自由基。 除以上物理方式活化PMS外,一些无机阴离子和有机物也可以对PMS产生活化效果,这种活化机制与活化剂的浓度密切相关。Yang等[22]研究了多种阴离子(HPO42–、CO32–、HCO3–、SO42–、NO3–、Cl–)对PMS降解AO7的影响,发现低浓度(0.001 mol/L)的HPO42–、CO32–和HCO3–对PMS有活化作用,且由HPO42–和CO32–活化的PMS降解AO7比被HCO32–活化拥有更快的降解速率,这是因为阴离子对PMS的活化主要是通过亲核攻击引发的[89]。在具有不对称结构的PMS中,HPO42–和CO32–有两个亲核原子可以攻击PMS中的O–O键,而HCO32–只有一个。实验中的阴离子在水体系中是自由基的清除剂[22],因此,通过阴离子活化PMS降解有机污染物的过程主要是非自由基机制,活性物质为1O2。娄等[90]还考察了Cl–活化PMS降解水中罗丹明B(RhB),通过投加120 mmol/L的NaCl来为体系中添加Cl–,研究发现,RhB的降解速率随着PMS浓度的升高而加快,5 min的脱色率可以达到95.7%。苯醌也被发现是活化PMS的有效物质,在碱性条件下,苯醌可以活化PMS产生·OH、SO4·–和1O2来加速对磺胺甲恶唑(SMX)的降解[91]。 电催化技术也可以和高级氧化技术耦合去除有机污染物。在污染体系中添加外部电场可有效启动或加速氧化还原反应,这种反应主要涉及两种氧化过程:一是污染物在电极阳极表面直接氧化,二是通过电场将氧化剂激活并生成自由基等活性物质,参与氧化反应。Li等[92]研究了光催化燃料电池(PFC)与PMS协同去除四环素的机制,在引入PMS进入体系后,总碳去除率增加了82.83%;同时,其研究了多种变量对总碳去除率的影响,包括光强度、PMS剂量及pH等,通过淬灭实验发现,不同pH下反应途径不同,酸性条件下·OH和SO4·–起关键作用;中性条件下反应依赖于PMS的直接氧化;1O2和O2·–在碱性环境中起主导作用。 PMS在通电的阳极室和阴极室均可以被激活产生自由基,如式(39)所示[93]: 碱性条件下PMS主要是通过电活化生成1O2来降解有机污染物,1O2的生成除依靠PMS的自分解外,阴极区域电解水产生的OH–也起到了重要作用。 (40) 在电活化PMS体系中,电场参数对反应效率有很大影响,电压过低可能导致活化反应效率低下,而过高的电压会导致电化学过程与活化PMS过程之间产生竞争反应从而限制活性物质的产生[94],合适的电场条件能有效增加PMS与电极的协同作用。利用电场活化PMS,不仅可以利用活性阳极去除有机物污染物,也可以利用阴极用于还原重金属并去除,这种技术为有机污染物和重金属共存污染体系提供了新的污染去除途径。表5汇总了基于其他活化机制的PMS降解有机污染物案例。 表5 基于其他活化机制的PMS降解有机污染物案例 基于PMS被活化降解有机污染物的高级氧化过程已被应用于污水处理,其在土壤修复领域的应用也引起了研究者们的关注(表6)。2009年,Do等[104]首次在土壤中应用PMS作为氧化剂处理柴油污染,并且采用Fe2+和Co2+对PMS进行了活化,研究表明,选用的4种过渡金属活化剂(FeCl2、FeSO4、CoCl2和CoSO4)均可以增强PMS的反应活性,其增强顺序分别为CoCl2> CoSO4> FeSO4> FeCl2>无活化剂;其次固定活化剂浓度、调节PMS浓度梯度(0 ~ 0.5 mol/L)试验说明,增加氧化剂与活化剂的摩尔比可以提高降解效率,试验中以200∶3的PMS/Co2+摩尔比成功地将原始浓度为4 530(±40) mg/kg的柴油降解了47%;此外,增加注入氧化剂的次数(注入总量不变)能够实现更高的柴油降解率,最高可达88%。Oba等[105]研究了未经活化的PMS对三氯乙烯(TCE)污染土壤的降解,在装有3 g TCE污染土壤(100 mg/kg)的小瓶中,分别加入10 ml不同浓度的PMS溶液(2 ~ 15 mmol/L),发现PMS浓度越高,对TCE的降解效果越好;分5次向土壤中注射比直接一次性注射相同浓度的PMS效果更好,可以将TCE的降解率从86.90% 提高到95.25%,且在pH 3 ~ 11的较宽范围下均观察到有效降解。 表6 PMS在土壤修复中的应用 Lyu等[106]研究了天然氧化物CoOOH作为非均相活化剂活化PMS降解石油烃污染,在实验室条件下,将5 g的石油烃污染土壤和10 ml的PMS溶液(0.1 mol/L)以及1.0 g/L CoOOH混合,24 h内初始浓度为78 ~ 99 mg/kg的石油烃被降解了88.3%;在系统温度升高至50℃时,去除效率提高至90%;为了进一步评估此体系的除油效率,试验还比较了不同化学氧化体系(PS/Fe2+、PS/Fe0、PMS/Co2+和PMS/CoOOH)降解石油烃的效果,降解效率依次为PMS/CoOOH > PMS/Co2+> PS/Fe0> PS/Fe2+。在PMS被活化降解石油烃的过程中,多种自由基被检测到参与了降解反应,非均相活化剂表面的电子转移和SO4·–、·OH及1O2的生成都被认为是此反应的有效机理,因此PMS/CoOOH 系统中同时发生了自由基和非自由基过程,这种协同修复效果是石油烃污染土壤高修复率的关键。Diao等[107]研究了生物质炭负载零价铁(BC-nZVI)作为非均相催化剂,用以活化PMS在土壤中降解阿特拉津(ATZ),成功证明了BC/PMS与nZVI/PMS过程之间具有协同效应,在最佳反应条件下去除了接近96% 的ATZ,这个反应也兼具了自由基过程和非自由基过程,同时土壤中低浓度的铜还加速了ATZ的降解进程;除目标污染物外,BC-nZVI/PMS系统还从土壤中清除了例如2,4-二氯苯酚(2,4-DCP)、Cu和Cd这些共存的污染物。Diao等[107]还提出了在土壤中nZVI活化PMS的机制,如式(43) ~ 式(46)所示: 在土壤修复的过程中,被卤化后的碳氢化合物污染的土壤往往更难以修复。He等[108]选用了邻二氯苯作为典型污染物,发现新型的PMS/高铁酸盐/FeS(PFI)杂化氧化系统对其具有较好的修复效果;同时该研究使用正交试验来探究了不同氧化剂浓度和催化剂浓度对邻二氯苯降解效果的影响,得出最佳反应体系为PMS∶Fe(VI)∶FeS∶邻二氯苯=20∶20∶10∶1(摩尔浓度),这一系统可以在10 min内达到反应平衡,并去除93% 的邻二氯苯。FeS的加入不仅可以促进PMS的活化,还可以提高高铁酸盐的转化率,从而生成Fe(V)和Fe(IV)来进一步降解邻二氯苯。在这一过程中,多种活化剂和氧化剂之间存在协同或抑制作用,从而共同控制活化催化反应的进程,以获得理想的降解效果。对于老化土壤的修复,PMS也有着优秀的处理效果。在投加了纳米零价铁(nZVI)后,0.3% PMS 和0.2% nZVI的组合可使土壤总石油烃(TPH)从最初的6 625 mg/kg降低至2 573 mg/kg,在分5次投加相同剂量的氧化剂和活化剂后,观察到超过96% 的TPH被降解[109]。 添加活化措施对PMS的化学氧化性能都有相对积极的影响,且PMS活化同时存在自由基机制和非自由基机制,这与氧化剂的施加量、污染土壤背景值的复杂性有关。过量氧化剂的使用会向土壤中释放过多的活性物质,可能会起到自由基清除剂的作用,从而降低PMS的降解效率。当前PMS活化技术的一个方向就是多种活化方式的协同使用,期望通过不同活化途径的协同作用来高效彻底地降解目标污染物。上述PMS对于土壤中有机污染物的修复,均发现处理后土壤的总有机碳含量显著下降,这可能是PMS的非选择性强氧化作用导致的。 目前,PMS应用于土壤中的研究仍略显不足,主要集中在实验室规模的人为添加污染物的降解研究,较少应用于实际污染土壤体系。在原位污染土壤中,老化后的有机污染物相对于人工添加的污染更难去除,低渗透性土壤中氧化剂的迁移也有一定的难度。此外,与水体的均相体系不同,土壤体系更复杂且具有更高的有机物、无机物背景值,这使得氧化剂的投入成本和注入难度大大提升。基于PMS在污染废水中的优秀表现及其在实验室规模的土壤试验中达到的良好效果,未来将其应用于治理实际有机污染土壤非常有前景。随着催化活化PMS研究的深入,基于活化PMS的高级氧化技术会有更好的发展。 目前看来,PMS应用于污染土壤修复仍有难点,主要存在以下3点: 1) PMS活化的自由基和非自由基过程有待进一步明确。PMS经活化进行自由基或非自由基的氧化过程仍难以区分,虽然各氧化机制可以通过不同的方式进行定性或定量分析,但是各种鉴定方法都或多或少地存在争议或缺陷。此外,在同一个基于PMS的多相催化体系中,往往多种反应机制并存,这些机理在反应体系中的分布不均,使得氧化机理的分析变得困难。随着研究的不断深入,应聚焦于开发更加可靠、准确的鉴定方法,以期人为把控PMS的多相催化进程。 2) 土壤体系的复杂性对PMS降解有机污染物的影响仍不清楚。已有研究表明,土壤本身体系的复杂性对PMS修复有机污染物的效果有很大影响,但仅少量研究关注土壤背景的不同对PMS降解修复效果的影响。基于此,应该逐步分析不同土壤的理化性质(有机质、矿物组成、pH等)对PMS降解有机污染物效果的影响,对影响较大的变量有针对性地使用活化剂,从而提高修复效率。 3) 针对不同有机污染土壤的PMS最适施用条件有待进一步研究。在实际污染土壤中施用PMS对有机污染物的降解研究仍偏少,相应反应条件的摸索仍需要研究人员的不断努力。PMS无论是通过自由基机制还是非自由基机制降解有机污染物均需要被活化,因此,开发高效、稳定的多相催化剂是当前的研究热点。未来的活化技术应该具有低成本、高效率、环境友好等特性,并且在实际修复过程中能够适用于较广泛的污染背景。 [1] Davies J, Davies D. Origins and evolution of antibiotic resistance[J]. Microbiology and Molecular Biology Reviews: MMBR, 2010, 74(3): 417–433. [2] Li W C. Occurrence, sources, and fate of pharmaceuticals in aquatic environment and soil[J]. Environmental Pollution, 2014, 187: 193–201. [3] Petrie B, Barden R, Kasprzyk-Hordern B. A review on emerging contaminants in wastewaters and the environment: Current knowledge, understudied areas and recommendations for future monitoring[J]. Water Research, 2015, 72: 3–27. [4] Tian N, Tian X K, Nie Y L, et al. Biogenic manganese oxide: An efficient peroxymonosulfate activation catalyst for tetracycline and phenol degradation in water[J]. Chemical Engineering Journal, 2018, 352: 469–476. [5] Sun M M, Luo Y M, Teng Y, et al. Remediation of polycyclic aromatic hydrocarbon and metal-contaminated soil by successive methyl-β-cyclodextrin-enhanced soil washing-microbial augmentation: A laboratory evaluation[J].Environmental Science and Pollution Research International, 2013, 20(2): 976–986. [6] Xu H T, Song Y, Cang L, et al. Ion exchange membranes enhance the electrokineticchemical oxidation of PAH-contaminated soil[J]. Journal of Hazardous Materials, 2020, 382: 121042. [7] 葛亚男, 张弛, 袁进, 等. 水泥窑协同处置危险废物的环境影响研究[J]. 安全与环境工程, 2021, 28(4): 201–206. [8] Ayoub K, van Hullebusch E D, Cassir M, et al. Application of advanced oxidation processes for TNT removal: A review[J]. Journal of Hazardous Materials, 2010, 178(1/2/3): 10–28. [9] Cheng M, Zeng G M, Huang D L, et al. Hydroxyl radicals based advanced oxidation processes ()remediation of soils contaminated with organic compounds: A review[J]. Chemical Engineering Journal, 2016, 284: 582–598. [10] Jeong J, Song W H, Cooper W J, et al. Degradation of tetracycline antibiotics: Mechanisms and kinetic studies for advanced oxidation/reduction processes[J]. Chemosphere, 2010, 78(5): 533–540. [11] Gogate P R, Pandit A B. A review of imperative technologies for wastewater treatment I: Oxidation technologies at ambient conditions[J]. Advances in Environmental Research, 2004, 8(3/4): 501–551. [12] Oller I, Malato S, Sánchez-Pérez J A. Combination of advanced oxidation processes and biological treatments for wastewater decontamination—A review[J]. Science of the Total Environment, 2011, 409(20): 4141–4166. [13] Pérez G, Ibáñez R, Urtiaga A M, et al. Kinetic study of the simultaneous electrochemical removal of aqueous nitrogen compounds using BDD electrodes[J]. Chemical Engineering Journal, 2012, 197: 475–482. [14] Yu M, Teel A L, Watts R J. Activation of peroxymonosulfate by subsurface minerals[J]. Journal of Contaminant Hydrology, 2016, 191: 33–43. [15] Feng Y, Liao C Z, Kong L J, et al. Facile synthesis of highly reactive and stable Fe-doped g-C3N4composites for peroxymonosulfate activation: A novel nonradical oxidation process[J]. Journal of Hazardous Materials, 2018, 354: 63–71. [16] Oh W D, Dong Z L, Lim T T. Generation of sulfate radical through heterogeneous catalysis for organic contaminants removal: Current development, challenges and prospects[J]. Applied Catalysis B: Environmental, 2016, 194: 169–201. [17] Wu J X, Wang B, Cagnetta G, et al. Nanoscale zero valent iron-activated persulfate coupled with Fenton oxidation process for typical pharmaceuticals and personal care products degradation[J]. Separation and Purification Technology, 2020, 239: 116534. [18] Hu P D, Long M C. Cobalt-catalyzed sulfate radical-based advanced oxidation: A review on heterogeneous catalysts and applications[J]. Applied Catalysis B: Environmental, 2016, 181: 103–117. [19] Guan C T, Jiang J, Pang S Y, et al. Formation and control of bromate in sulfate radical-based oxidation processes for the treatment of waters containing bromide: A critical review[J]. Water Research, 2020, 176: 115725. [20] Wacławek S, Lutze H V, Grübel K, et al. Chemistry of persulfates in water and wastewater treatment: A review[J]. Chemical Engineering Journal, 2017, 330: 44–62. [21] Wang J L, Wang S Z. Activation of persulfate (PS) and peroxymonosulfate (PMS) and application for the degradation of emerging contaminants[J]. Chemical Engineering Journal, 2018, 334: 1502–1517. [22] Yang S Y, Wang P, Yang X, et al. Degradation efficiencies of azo dye Acid Orange 7 by the interaction of heat, UV and anions with common oxidants: Persulfate, peroxymonosulfate and hydrogen peroxide[J]. Journal of Hazardous Materials, 2010, 179(1/2/3): 552–558. [23] Lou X Y, Fang C L, Geng Z N, et al. Significantly enhanced base activation of peroxymonosulfate by polyphosphates: Kinetics and mechanism[J]. Chemosphere, 2017, 173: 529–534. [24] Anipsitakis G P, Dionysiou D D. Degradation of organic contaminants in water with sulfate radicals generated by the conjunction of peroxymonosulfate with cobalt[J]. Environmental Science & Technology, 2003, 37(20): 4790–4797. [25] Criquet J, Karpel Vel Leitner N. Electron beam irradiation of aqueous solution of persulfate ions[J]. Chemical Engineering Journal, 2011, 169(1/2/3): 258–262. [26] Steele W V, Appelman E H. The standard enthalpy of formation of peroxymonosulfate (HSO5−) and the standard electrode potential of the peroxymonosulfate-bisulfate couple[J]. The Journal of Chemical Thermodynamics, 1982, 14(4): 337–344. [27] Yin R L, Guo W Q, Wang H Z, et al. Selective degradation of sulfonamide antibiotics by peroxymonosulfate alone: Direct oxidation and nonradical mechanisms[J]. Chemical Engineering Journal, 2018, 334: 2539–2546. [28] Lee J, von Gunten U, Kim J H. Persulfate-based advanced oxidation: Critical assessment of opportunities and roadblocks[J]. Environmental Science & Technology, 2020, 54(6): 3064–3081. [29] Liu Y, Guo H G, Zhang Y L, et al. Heterogeneous activation of peroxymonosulfate by sillenite Bi25FeO40: Singlet oxygen generation and degradation for aquatic levofloxacin[J]. Chemical Engineering Journal, 2018, 343: 128–137. [30] Ma W J, Wang N, Fan Y N, et al. Non-radical-dominated catalytic degradation of bisphenol A by ZIF-67 derived nitrogen-doped carbon nanotubes frameworks in the presence of peroxymonosulfate[J]. Chemical Engineering Journal, 2018, 336: 721–731. [31] Nie M H, Deng Y W, Nie S H, et al. Simultaneous removal of bisphenol A and phosphate from water by peroxymonosulfate combined with calcium hydroxide[J]. Chemical Engineering Journal, 2019, 369: 35–45. [32] Qi C D, Liu X T, Ma J, et al. Activation of peroxymonosulfate by base: Implications for the degradation of organic pollutants[J]. Chemosphere, 2016, 151: 280–288. [33] Zhou Y, Jiang J, Gao Y, et al. Oxidation of steroid estrogens by peroxymonosulfate (PMS) and effect of bromide and chloride ions: Kinetics, products, and modeling[J]. Water Research, 2018, 138: 56–66. [34] 张黎明, 陈家斌, 李文卫, 等. 碳纳米管活化过一硫酸盐降解金橙G过程及动力学[J]. 环境科学, 2016, 37(7): 2601–2609. [35] 葛勇建, 蔡显威, 林翰, 等. 碱活化过一硫酸盐降解水中环丙沙星[J]. 环境科学, 2017, 38(12): 5116–5123. [36] Pignatello J J, Oliveros E, MacKay A. Advanced oxidation processes for organic contaminant destruction based on the Fenton reaction and related chemistry[J]. Critical Reviews in Environmental Science and Technology, 2006, 36(1): 1–84. [37] Anipsitakis G P, Dionysiou D D. Radical generation by the interaction of transition metals with common oxidants[J]. Environmental Science & Technology, 2004, 38(13): 3705–3712. [38] Xiao S, Cheng M, Zhong H, et al. Iron-mediated activation of persulfate and peroxymonosulfate in both homogeneous and heterogeneous ways: A review[J]. Chemical Engineering Journal, 2020, 384: 123265. [39] Rastogi A, Al-Abed S R, Dionysiou D D. Sulfate radical-based ferrous-peroxymonosulfate oxidative system for PCBs degradation in aqueous and sediment systems[J]. Applied Catalysis B: Environmental, 2009, 85(3/4): 171–179. [40] Zhu J P, Lin Y L, Zhang T Y, et al. Modelling of iohexol degradation in a Fe(II)-activated persulfate system[J]. Chemical Engineering Journal, 2019, 367: 86–93. [41] Vicente F, Santos A, Romero A, et al. Kinetic study of diuron oxidation and mineralization by persulphate: Effects of temperature, oxidant concentration and iron dosage method[J]. Chemical Engineering Journal, 2011, 170(1): 127–135. [42] Anipsitakis G P, Stathatos E, Dionysiou D D. Heterogeneous activation of oxone using Co3O4[J]. The Journal of Physical Chemistry B, 2005, 109(27): 13052–13055. [43] Wang Z, Qiu W, Pang S Y, et al. Relative contribution of ferryl ion species (Fe(IV)) and sulfate radical formed in nanoscale zero valent iron activated peroxydisulfate and peroxymonosulfate processes[J]. Water Research, 2020, 172: 115504. [44] Ahn Y Y, Bae H, Kim H I, et al. Surface-loaded metal nanoparticles for peroxymonosulfate activation: Efficiency and mechanism reconnaissance[J]. Applied Catalysis B: Environmental, 2019, 241: 561–569. [45] Zhu S S, Li X J, Kang J, et al. Persulfate activation on crystallographic manganese oxides: Mechanism of singlet oxygen evolution for nonradical selective degradation of aqueous contaminants[J]. Environmental Science & Technology, 2019, 53(1): 307–315. [46] Huang K Z, Zhang H C. Galvanic oxidation processes (GOPs): An effective direct electron transfer approach for organic contaminant oxidation[J]. Science of the Total Environment, 2020, 743: 140828. [47] Yu L, Zhang G, Liu C L, et al. Interface stabilization of undercoordinated iron centers on manganese oxides for nature-inspired peroxide activation[J]. ACS Catalysis, 2018, 8(2): 1090–1096. [48] Du X D, Zhang Y Q, Hussain I, et al. Insight into reactive oxygen species in persulfate activation with copper oxide: Activated persulfate and trace radicals[J]. Chemical Engineering Journal, 2017, 313: 1023–1032. [49] Li H R, Tian J Y, Xiao F, et al. Structure-dependent catalysis of cuprous oxides in peroxymonosulfate activation via nonradical pathway with a high oxidation capacity[J]. Journal of Hazardous Materials, 2020, 385: 121518. [50] Jawad A, Zhan K, Wang H B, et al. Tuning of persulfate activation from a free radical to a nonradical pathway through the incorporation of non-redox magnesium oxide[J]. Environmental Science & Technology, 2020, 54(4): 2476–2488. [51] Xu Y, Ai J, Zhang H. The mechanism of degradation of bisphenol A using the magnetically separable CuFe2O4/ peroxymonosulfate heterogeneous oxidation process[J]. Journal of Hazardous Materials, 2016, 309: 87–96. [52] Wang X L, Ding Y Z, Dionysiou D D, et al. Efficient activation of peroxymonosulfate by copper sulfide for diethyl phthalate degradation: Performance, radical generation and mechanism[J]. Science of the Total Environment, 2020, 749: 142387. [53] Liu J, Zhao Z W, Shao P H, et al. Activation of peroxymonosulfate with magnetic Fe3O4-MnO2core-shell nanocomposites for 4-chlorophenol degradation[J]. Chemical Engineering Journal, 2015, 262: 854–861. [54] Yao Y J, Cai Y M, Wu G D, et al. Sulfate radicals induced from peroxymonosulfate by cobalt manganese oxides (CoMn3−O4) for Fenton-Like reaction in water[J]. Journal of Hazardous Materials, 2015, 296: 128–137. [55] Deng J, Feng S F, Zhang K J, et al. Heterogeneous activation of peroxymonosulfate using ordered mesoporous Co3O4for the degradation of chloramphenicol at neutral pH[J]. Chemical Engineering Journal, 2017, 308: 505–515. [56] Du Y C, Ma W J, Liu P X, et al. Magnetic CoFe2O4nanoparticles supported on titanate nanotubes (CoFe2O4/TNTs) as a novel heterogeneous catalyst for peroxymonosulfate activation and degradation of organic pollutants[J]. Journal of Hazardous Materials, 2016, 308: 58–66. [57] Feng Y, Lee P H, Wu D L, et al. Surface-bound sulfate radical-dominated degradation of 1, 4-dioxane by alumina-supported palladium (Pd/Al2O3) catalyzed peroxymonosulfate[J]. Water Research, 2017, 120: 12–21. [58] Nie G, Huang J, Hu Y Z, et al. Heterogeneous catalytic activation of peroxymonosulfate for efficient degradation of organic pollutants by magnetic Cu0/Fe3O4submicron composites[J]. Chinese Journal of Catalysis, 2017, 38(2): 227–239. [59] Zhang Q H, He D, Li X R, et al. Mechanism and performance of singlet oxygen dominated peroxymonosulfate activation on CoOOH nanoparticles for 2, 4-dichlorophenol degradation in water[J]. Journal of Hazardous Materials, 2020, 384: 121350. [60] Wang L H, Jiang J, Pang S Y, et al. Oxidation of bisphenol A by nonradical activation of peroxymonosulfate in the presence of amorphous manganese dioxide[J]. Chemical Engineering Journal, 2018, 352: 1004–1013. [61] Li H C, Shan C, Pan B C. Fe(III)-doped g-C3N4mediated peroxymonosulfate activation for selective degradation of phenolic compounds via high-valent iron-oxo species[J]. Environmental Science & Technology, 2018, 52(4): 2197–2205. [62] Ahn Y Y, Yun E T, Seo J W, et al. Activation of peroxymonosulfate by surface-loaded noble metal nanoparticles for oxidative degradation of organic compounds[J]. Environmental Science & Technology, 2016, 50(18): 10187–10197. [63] Chen H, Lin T, Chen W, et al. Significant role of high-valent iron-oxo species in the degradation and detoxification of indomethacine[J]. Chemosphere, 2020, 251: 126451. [64] Li Z, Sun Y Q, Yang Y, et al. Biochar-supported nanoscale zero-valent iron as an efficient catalyst for organic degradation in groundwater[J]. Journal of Hazardous Materials, 2020, 383: 121240. [65] Zhou X Q, Luo C G, Luo M Y, et al. Understanding the synergetic effect from foreign metals in bimetallic oxides for PMS activation: A common strategy to increase the stoichiometric efficiency of oxidants[J]. Chemical Engineering Journal, 2020, 381: 122587. [66] Zhao Q X, Mao Q M, Zhou Y Y, et al. Metal-free carbon materials-catalyzed sulfate radical-based advanced oxidation processes: A review on heterogeneous catalysts and applications[J]. Chemosphere, 2017, 189: 224–238. [67] Sun H Q, Kwan C, Suvorova A, et al. Catalytic oxidation of organic pollutants on pristine and surface nitrogen-modified carbon nanotubes with sulfate radicals[J]. Applied Catalysis B: Environmental, 2014, 154/155: 134–141. [68] Zhang J, Shao X T, Shi C, et al. Decolorization of Acid Orange 7 with peroxymonosulfate oxidation catalyzed by granular activated carbon[J]. Chemical Engineering Journal, 2013, 232: 259–265. [69] Li D G, Duan X G, Sun H Q, et al. Facile synthesis of nitrogen-doped graphene via low-temperature pyrolysis: The effects of precursors and annealing ambience on metal-free catalytic oxidation[J]. Carbon, 2017, 115: 649–658. [70] Duan X G, Ao Z M, Zhang H Y, et al. Nanodiamonds in sp2/sp3 configuration for radical to nonradical oxidation: Core-shell layer dependence[J]. Applied Catalysis B: Environmental, 2018, 222: 176–181. [71] Han C, Duan X G, Zhang M J, et al. Role of electronic properties in partition of radical and nonradical processes of carbocatalysis toward peroxymonosulfate activation[J]. Carbon, 2019, 153: 73–80. [72] Gao Y W, Chen Z H, Zhu Y, et al. New insights into the generation of singlet oxygen in the metal-free peroxymonosulfate activation process: Important role of electron-deficient carbon atoms[J]. Environmental Science & Technology, 2020, 54(2): 1232–1241. [73] Gao Y W, Zhu Y, Lyu L, et al. Electronic structure modulation of graphitic carbon nitride by oxygen doping for enhanced catalytic degradation of organic pollutants through peroxymonosulfate activation[J]. Environmental Science & Technology, 2018, 52(24): 14371–14380. [74] Cheng X, Guo H G, Zhang Y L, et al. Insights into the mechanism of nonradical reactions of persulfate activated by carbon nanotubes: Activation performance and structure-function relationship[J]. Water Research, 2019, 157: 406–414. [75] da Ouyang, Chen Y, Yan J C, et al. Activation mechanism of peroxymonosulfate by biochar for catalytic degradation of 1, 4-dioxane: Important role of biochar defect structures[J]. Chemical Engineering Journal, 2019, 370: 614–624. [76] Duan X G, Ao Z M, Li D G, et al. Surface-tailored nanodiamonds as excellent metal-free catalysts for organic oxidation[J]. Carbon, 2016, 103: 404–411. [77] Wang Y X, Ao Z M, Sun H Q, et al. Activation of peroxymonosulfate by carbonaceous oxygen groups: Experimental and density functional theory calculations[J]. Applied Catalysis B: Environmental, 2016, 198: 295–302. [78] Yun E T, Lee J H, Kim J, et al. Identifying the nonradical mechanism in the peroxymonosulfate activation process: Singlet oxygenation versus mediated electron transfer[J]. Environmental Science & Technology, 2018, 52(12): 7032–7042. [79] Chu C H, Yang J, Huang D H, et al. Cooperative pollutant adsorption and persulfate-driven oxidation on hierarchically ordered porous carbon[J]. Environmental Science & Technology, 2019, 53(17): 10352–10360. [80] Hu P D, Su H R, Chen Z Y, et al. Selective degradation of organic pollutants using an efficient metal-free catalyst derived from carbonized polypyrrole via peroxymonosulfate activation[J]. Environmental Science & Technology, 2017, 51(19): 11288–11296. [81] Guan C T, Jiang J, Luo C W, et al. Oxidation of bromophenols by carbon nanotube activated peroxymonosulfate (PMS) and formation of brominated products: Comparison to peroxydisulfate (PDS)[J]. Chemical Engineering Journal, 2018, 337: 40–50. [82] Wei M Y, Gao L, Li J, et al. Activation of peroxymonosulfate by graphitic carbon nitride loaded on activated carbon for organic pollutants degradation[J]. Journal of Hazardous Materials, 2016, 316: 60–68. [83] Kang J, Duan X G, Wang C, et al. Nitrogen-doped bamboo-like carbon nanotubes with Ni encapsulation for persulfate activation to remove emerging contaminants with excellent catalytic stability[J]. Chemical Engineering Journal, 2018, 332: 398–408. [84] Herrmann H. On the photolysis of simple anions and neutral molecules as sources of O-/ OH, SO- and Cl in aqueous solution[J]. Physical Chemistry Chemical Physics, 2007, 9(30): 3935–3964. [85] Wang J L, Chu L B. Irradiation treatment of pharmaceutical and personal care products (PPCPs) in water and wastewater: An overview[J]. Radiation Physics and Chemistry, 2016, 125: 56–64. [86] Shah N S, Khan J A, Al-Muhtaseb A H, et al. Synergistic effects of HSO5−in the gamma radiation driven process for the removal of chlorendic acid: A new alternative for water treatment[J]. Chemical Engineering Journal, 2016, 306: 512–521. [87] Antoniou M G, de la Cruz A A, Dionysiou D D. Degradation of microcystin-LR using sulfate radicals generated through photolysis, thermolysis and e− transfer mechanisms[J]. Applied Catalysis B: Environmental, 2010, 96(3/4): 290–298. [88] Liu J, Zhou J H, Ding Z X, et al. Ultrasound irritation enhanced heterogeneous activation of peroxymonosulfate with Fe3O4for degradation of azo dye[J]. Ultrasonics Sonochemistry, 2017, 34: 953–959. [89] Betterton E A, Hoffmann M R. Kinetics and mechanism of the oxidation of aqueous hydrogen sulfide by peroxymonosulfate[J]. Environmental Science & Technology, 1990, 24(12): 1819–1824. [90] 娄晓祎. 无机阴离子活化过硫酸盐氧化降解典型有机污染物的研究[D]. 上海: 东华大学, 2016. [91] Zhou Y, Jiang J, Gao Y, et al. Activation of peroxymonosulfate by benzoquinone: A novel nonradical oxidation process[J]. Environmental Science & Technology, 2015, 49(21): 12941–12950. [92] Li N, Tang S F, Rao Y D, et al. Peroxymonosulfate enhanced antibiotic removal and synchronous electricity generation in a photocatalytic fuel cell[J]. Electrochimica Acta, 2019, 298: 59–69. [93] Liu Z, Ding H J, Zhao C, et al. Electrochemical activation of peroxymonosulfate with ACF cathode: Kinetics, influencing factors, mechanism, and application potential[J]. Water Research, 2019, 159: 111–121. [94] Bai C W, Yang G, Zhang S R, et al. A synergistic system of electrocatalytic-anode/α-MnO2/peroxymonosulfate for removing combined pollution of tetracycline and Cr(VI)[J]. Chemical Engineering Journal, 2021, 423: 130284. [95] Mahdi-Ahmed M, Chiron S. Ciprofloxacin oxidation by UV-C activated peroxymonosulfate in wastewater[J]. Journal of Hazardous Materials, 2014, 265: 41–46. [96] Ao X W, Liu W J. Degradation of sulfamethoxazole by medium pressure UV and oxidants: Peroxymonosulfate, persulfate, and hydrogen peroxide[J]. Chemical Engineering Journal, 2017, 313: 629–637. [97] Khan S, He X X, Khan J A, et al. Kinetics and mechanism of sulfate radical- and hydroxyl radical-induced degradation of highly chlorinated pesticide lindane in UV/peroxymonosulfate system[J]. Chemical Engineering Journal, 2017, 318: 135–142. [98] Cui C Z, Jin L, jiang L, et al. Removal of trace level amounts of twelve sulfonamides from drinking water by UV-activated peroxymonosulfate[J]. Science of the Total Environment, 2016, 572: 244–251. [99] Song H R, Yan L X, Wang Y W, et al. Electrochemically activated PMS and PDS: Radical oxidation versus nonradical oxidation[J]. Chemical Engineering Journal, 2020, 391: 123560. [100] Lin H, Wu J, Zhang H. Degradation of clofibric acid in aqueous solution by an EC/Fe3+/PMS process[J]. Chemical Engineering Journal, 2014, 244: 514–521. [101] Yang Y, Jiang J, Lu X L, et al. Production of sulfate radical and hydroxyl radical by reaction of ozone with peroxymonosulfate: A novel advanced oxidation process[J]. Environmental Science & Technology, 2015, 49(12): 7330–7339. [102] Zheng W T, Liu Y B, Liu W, et al. A novel electrocatalytic filtration system with carbon nanotube supported nanoscale zerovalent copper toward ultrafast oxidation of organic pollutants[J]. Water Research, 2021, 194: 116961. [103] Song H R, Yan L X, Jiang J, et al. Electrochemical activation of persulfates at BDD anode: Radical or nonradical oxidation? [J]. Water Research, 2018, 128: 393–401. [104] Do S H, Jo J H, Jo Y H, et al. Application of a peroxymonosulfate/cobalt (PMS/Co(II)) system to treat diesel-contaminated soil[J]. Chemosphere, 2009, 77(8): 1127–1131. [105] Oba B T, Zheng X H, Aborisade M A, et al. Remediation of trichloroethylene contaminated soil by unactivated peroxymonosulfate: Implication on selected soil characteristics[J]. Journal of Environmental Management, 2021, 285: 112063. [106] Lyu C, He D, Chang Y M, et al. Cobalt oxyhydroxide as an efficient heterogeneous catalyst of peroxymonosulfate activation for oil-contaminated soil remediation[J]. Science of the Total Environment, 2019, 680: 61–69. [107] Diao Z H, Zhang W X, Liang J Y, et al. Removal of herbicide atrazine by a novel biochar based iron composite coupling with peroxymonosulfate process from soil: Synergistic effect and mechanism[J]. Chemical Engineering Journal, 2021, 409: 127684. [108] He C F, Zhang X Y, Lv P, et al. Efficient remediation of o- dichlorobenzene-contaminated soil using peroxomonosulfate- ferrate-FeS hybrid oxidation system[J]. Journal of the Taiwan Institute of Chemical Engineers, 2021, 119: 23–32. [109] Bajagain R, Jeong S W. Degradation of petroleum hydrocarbons in soil via advanced oxidation process using peroxymonosulfate activated by nanoscale zero-valent iron[J]. Chemosphere, 2021, 270: 128627. Progress of Chemical Oxidation Mechanism of Peroxymonosulfate and Its Application in Remediation of Organic Contaminated Soil ZHOU Mingzhu1,2, CANG Long1* (1 Key Laboratory of Soil Environment and Pollution Remediation, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China; 2 Key Laboratory for Information System of Mountainous Area and Protection of Ecological Environment of Guizhou Province, Guizhou Normal University, Guiyang 550001, China) Advanced oxidation technology based on peroxymonosulfate (PMS) has broad application potential in the field of environmental remediation due to its rapid and efficient reaction and superior degradation effect of organic pollutants. Activated PMS chemical oxidation technology has been widely used in organic contaminated wastewater, and the removal mechanism of pollutants has been constantly discovered and improved, and it has also been applied in the remediation of organic contaminated soil. This paper reviews PMS chemical oxidation of organic pollutants and analyzes the free radical and the nonradical degradation mechanism. The different activation methods (alkali, transition metal and carbon material, radiation, etc.) for PMS and influence mechanism are discussed, and PMS application in the remediation of organic contaminated soil is also elucidated and prospected. Peroxymonosulfate; Chemical oxidation; Organic contaminated soil; Remediation X131.3 A 10.13758/j.cnki.tr.2022.04.001 周明珠, 仓龙. 过一硫酸盐的化学氧化机理及在有机污染土壤修复中应用研究进展. 土壤, 2022, 54(4): 653–666. 国家重点研发计划项目(2018YFC1802005)和国家自然科学基金项目(42177032)资助。 (canglong@issas.ac.cn) 周明珠(1995—),女,江苏宿迁人,硕士研究生,研究方向为有机污染土壤的化学氧化修复。E-mail:253932863@qq.com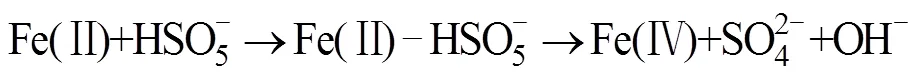



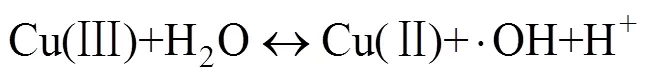
2.3 碳基材料活化机制

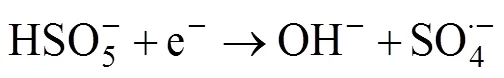
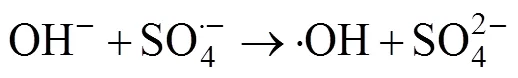
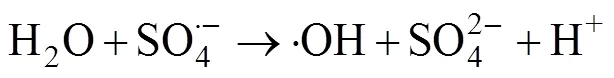
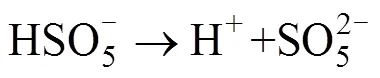
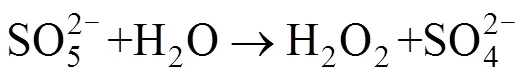
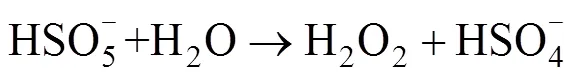
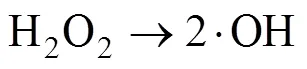
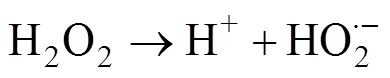
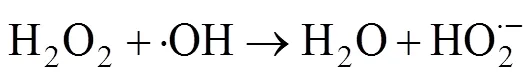

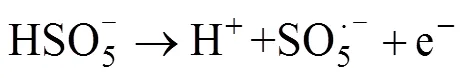
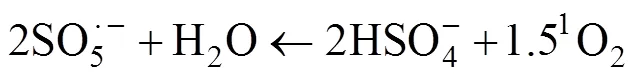
2.4 其他活化机制

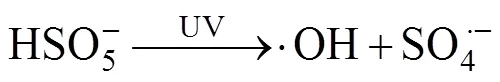
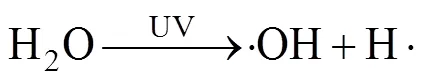



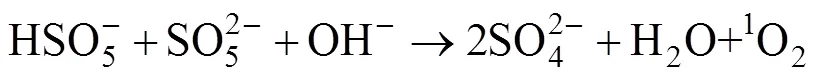
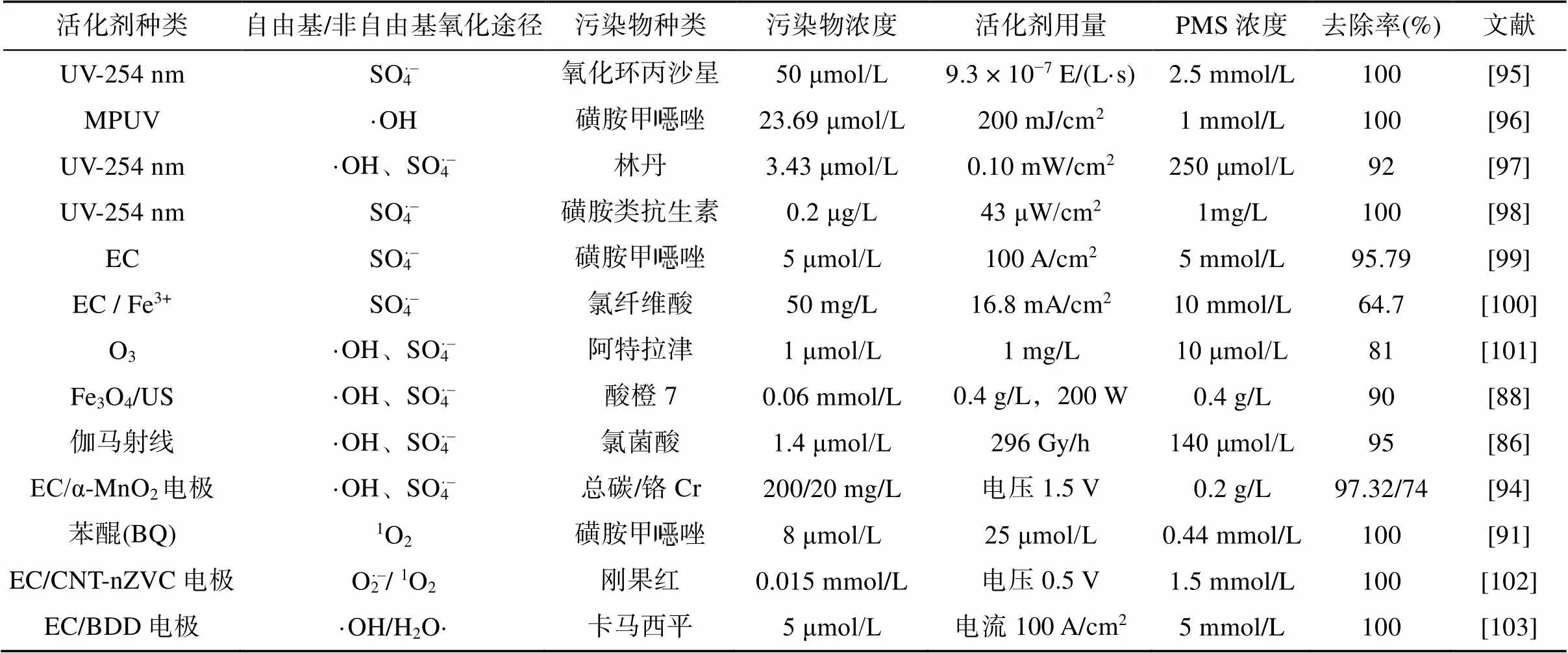
3 PMS在污染土壤化学氧化修复中的应用


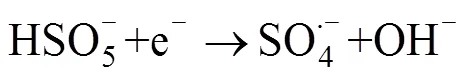
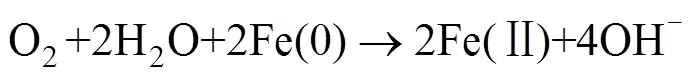
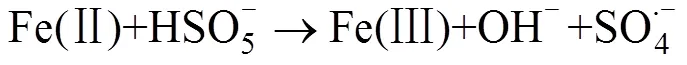
4 展望

