MgO对富钼硼硅酸盐玻璃结晶倾向、微结构及化学稳定性的影响
熊艺帆 张行泉 霍冀川, 朱永昌
(1. 西南科技大学材料科学与工程学院 绵阳 621010;2. 西南科技大学环境友好能源材料国家重点实验室 绵阳 621010;3. 西南科技大学分析测试中心 绵阳 621010;4.中国建筑材料科学研究总院 北京 100024)
0 引言
国际原子能机构(IAEA)的数据表明,随着核能的发展,全球在运行的核反应堆有453座,每年会有4000 m3的放射性废物因乏燃料后处理而产生,从环保和安全角度来看,核废料的妥善处理已经成为核能应用中需直视的核心问题[1-2]。对核废料进行固化再进行深地质处理,是现在国际上的主流观点并已被加以应用和研究[3-5]。依照固化基体的不同,可以分为水泥固化、沥青固化、陶瓷固化、玻璃固化[6-7]。其中,玻璃固化是国际上进行核废料固化处理的首选方案。
玻璃固化的主要好处首先是玻璃中缺少晶界会抑制形成高迁移率的放射性同位素迁移路径;其次是玻璃固化的工艺较为简单。目前,大部分核能国家选择使用稳定耐用的硼硅酸盐玻璃投入工业中对放射性废物进行固化[7-9]。但乏燃料后处理产生的高放废液(High level radioactive waste, HLW)中一些元素,例如Mo、镧系元素(Ln)、贵金属(Pd、Rh、Ru)在硼硅酸盐玻璃的溶解度有限,易产生分相聚集或析晶现象。其中,Mo元素在硼硅酸盐玻璃的溶解具有代表性。谭盛恒等[10]认为只有1%~2%(摩尔分数)的MoO3可加入到硼硅酸盐玻璃体系中。如果组份中Mo的掺入量超过限度,则会在玻璃化过程中出现以碱金属钼酸盐形式存在的相分离,此类盐相是黄相(yellow phase)的组成成份之一[10-11]。盐相本身不具有放射性,但盐相中可能包含有放射性核素(如135,137C s和90Sr),且在水中具有一定的溶解性, 在处理过程中容易溶于地下水中从而渗入环境中[12]。因此,需要合适的玻璃载体可以包容更多的HLW,且不会影响最终玻璃产品的物理性能和化学稳定性。
Mo元素在硼硅酸盐玻璃中主要以Mo6+的形式存在,并与周围的四个O2-链 接形成钼酸根离子MoO42 -存在于硼硅酸盐玻璃中,MoO42-离子聚集在玻璃中富含碱金属/碱土金属阳离子的解聚区[13-14]。这种特殊的结构位置解释了低Mo溶解度和富M区域的相分离的原因[15]。说明可以通过改变玻璃成份来增加对Mo的溶解度。目前已有许多方法来增加Mo在玻璃中的溶解度,如:加入适量稀土元素[16-18](Nd、La),掺入高场强离子做改性剂[19-21](V、P、Li),调节玻璃中的硼钠比或钙钠比[22-24], 提高玻璃中的B2O3的含量[25]。
谭盛恒等[10]探究过镁硼硅酸玻璃对Mo的溶解度,但是缺少Mg掺入量对硼硅酸盐玻璃中Mo溶解度变化的相关探究。本研究的目的是探究MgO掺入量对含有MoO3的硼硅酸盐玻璃的结晶倾向、微观结构和化学稳定性的影响。实验选择了SiO2- B2O3- Na2O -CaO-Al2O3- MoO3玻璃进行探究,该体系玻璃被设想用于模拟对富含Mo的高放废液的固化。
1 实验
1.1 样品制备
本文样品以纯度在99%以上的SiO2、 H3B O3、Na2C O3、 Al(OH)3、 CaCO3、 MoO3、MgO粉 末为原料进行制备。其中,MgO的掺入量梯度设置为:0%、1.8%、3.0%、3.6%、4.2%(摩尔分数),具体成分如表1所示。

表1 不同MgO含量的玻璃组分(摩尔分数) %
适量称取粉末,在玛瑙研钵中混合均匀后转移至刚玉坩埚。将装有样品的刚玉坩埚放置在高温炉中,以10 ℃/min的升温速率升温至900 ℃并保持2 h使得硼酸和碳酸盐分解。再10 ℃/min升温至1250 ℃保持3 h,然后将熔体浇筑在预热好的钢板上。待成型后迅速转移至刚玉板上,放进预热温度为500 ℃的高温炉中退火3 h后随炉降温。降温后取得成型的玻璃块,并取其部分用玛瑙研钵破碎研磨成粉末,以便进行后续表征。
1.2 样品表征
采用X射线衍射仪( XRD, X’ pert PRO,PANalytical)对系列样品进行物相分析,Cu-Ka射线扫描范围(2q)为10°~80°,步长为0.0167°,电流电压分别为40 mA和40 kV。采用激光拉曼光谱仪(Raman, Invia, Renishaw)对样品中的结构基团、化学键种类等结构信息进行分析。使用扫描电子显微镜(SEM, Ultra55, ZEISS)在背散射电子模式下研究样品微观形貌。
用密度测量仪(Density,Au300S, Quarrz )测量块体玻璃的密度(r),仪器测试原理基于阿基米德排水法。利用公式(1)计算每个玻璃样品的摩尔体积(VM)[26-27]。

通过摩尔体积(VM)和氧原子数目(n)可进一步计算得氧堆积密度(OPD),氧堆积密度(OPD)是衡量玻璃中网络结构紧密程度的指标[26],公式表示为:

1.3 化学稳定性测试
采用产品一致性试验法(PCT)测试系列样品的化学稳定性[28]。对制备的玻璃粉末进行筛选,取3 g粒径为75~150 mm的粉末样品浸泡在含有80 mL去离子水的聚四氟乙烯的反应器内并装入水热釜中,保存在90 ℃的烘箱中,分别在1、3、7 d进行取样。利用感耦合等离子光谱发生仪(ICP, icp-6500, ThermoFisher, USA)分析浸出液中元素(Na、Ca、Mo、Mg)的浓度。根据公式(4)进行归一化浸出速率计算:

t——对应浸出时间(d)。
本实验1g样品的表面积为0.07 m2。
2 结果与讨论
图1为不同MgO含量系列样品的XRD谱图。

图1 不同MgO含量系列样品的XRD谱图
由图1可以看出,Mg-0样品在2q = 18.89°、28.95°、34.43°、 47.17°、49.64°、54.17°及58.14°存在明显衍射峰,对比XRD标准卡片,其对应钼酸钙(CaMoO4,PDF NO.85-0546)的衍射峰,这和前人的研究结果一致,表明当MoO3的含量超过其在硼硅酸盐玻璃中的溶解度时,将会有钼酸盐析出[19]。但随着MgO含量的增加,CaMoO4的衍射峰峰强逐渐减弱,当MgO含量达到4.2%时,对应CaMoO4的衍射峰完全消失,样品仅在15°~35°的2q范围内表现出一个宽峰,这表明该样品表现出明显的玻璃态。由此可见,MgO的引入可以有效地抑制CaMoO4的析出,进而提高MoO3在硼硅酸盐玻璃中的溶解度。
为进一步研究MgO的引入对富钼硼硅酸盐玻璃结构及析晶倾向的影响,测试了系列样品的拉曼光谱。图2为不同含量MgO系列样品的拉曼光谱。

图2 MgO含量为0~4.2%样品的拉曼谱图
在391、791、844和878 cm-1附近出现的尖锐拉曼散射峰与CaMoO4晶体的特征拉曼峰一致,随着MgO含量的增加,峰值强度逐渐减小。当MgO含量达到4.2%时,散射峰完全消失,仅在位于914和320 cm-1附近有较强的散射峰,其分别对应于Mo离子在玻璃网络结构中的拉伸振动和弯曲振动模式,且峰强度随着MgO掺入量增加而增加。这与XRD所得结果相吻合,进一步表明MgO的引入可以有效地提高Mo在硼硅酸盐玻璃中的溶解度,直到MgO含量达4.2%时,无CaMoO4析出,表明MoO3完全溶解在了玻璃网络结构中。
图3为不同含量MgO系列样品外观光学照片。

图3 MgO含量为0~3.6%样品的表观图
由图3可以看出,样品Mg-0整体呈乳白色,这是因为样品中含有大量CaMoO4晶相导致的。当MgO含量达1.8%时,样品表现为不均匀的白色晶相与透明玻璃相独立共存的状态,这是由于MgO的引入有效地抑制了CaMoO4晶相的析出。其分布不均匀的原因是在浇筑成形的过程中,玻璃液的各个部分受热不一致,导致析晶有所差异。随着Mg引入量的进一步增加,光学着色度变低,玻璃浑浊度减少,说明CaMoO4的析出量逐渐减小。当MgO含量达到3.6%时,样品呈现出完全透明的玻璃相,这说明此时几近无盐相析出。
为了研究MgO的引入对富钼硼硅酸盐玻璃微观结构的影响,对系列样品进行了扫描电子显微镜分析。图4为不同含量MgO系列样品背散射模式下的SEM照片。对于MgO含量为0%、1.8%和3.0%的样品,观察到在均匀的玻璃相中出现了直径为160~180 nm的球形的晶相,与文献报道一致[19],对应析出的CaMoO4晶相。随着MgO含量的增加,CaMoO4晶相的尺寸变化不明显,但在玻璃相中的数量在减少。当MgO含量达到3.6%时没有观察到CaMoO4,此时呈现的是均匀的纯玻璃相。系列样品微观形貌变化趋势与MoO3溶解度的增加趋势相符。

图4 MgO含量为0~3.6% 样品的SEM图
为了提高MoO3在硼硅酸盐玻璃中的溶解度,研究人员做了大量工作,结果表明通过引入高场强离子(Nd3+, V5+, Li+) 可以有效地改变玻璃中MoO42-离子周围的环境及玻璃的解聚合状态,进而改善MoO3在硼硅酸盐玻璃中的溶解情况[17,19,21]。图5为系列样品密度(r)和摩尔体积(VM)随MgO含量的变化曲线。可以看到,随MgO含量的增加,r由2.509 g/cm3增加至2.534 g/cm3,VM则从25.52 cm3/mol减小至24.88 m3/mol,这表明玻璃的网络结构连接性变得更好,结构变得紧密[29]。这和V2O5对硼硅酸盐玻璃网络结构的影响是相反的[19]。

图5 MgO含量为0~4.2%样品的密度(r)和摩尔体积(V M)
为了更好地了解其演变过程,根据所得样品密度和摩尔体积值,计算了氧摩尔体积(Vo)和氧堆积密度(OPD),结果如图6示。随着MgO含量的增加,氧的摩尔体积逐渐减小,氧堆积密度逐渐增大。研究结果表明氧堆积密度是玻璃结构致密性的表现,取决于桥联和非桥联氧原子的数量。氧摩尔体积和氧堆积密度随着 MgO含量变化的关系表明玻璃结构变得更加紧密。以上结果表明MgO对硼硅酸盐玻璃中Mo的溶解度的提高机制和V2O5及 Li2O的作用机制并不相同,这是因为Mg2+相 较于Ca2+半径更小、场强更强、极化能力更高,对非桥氧(NBO)的吸引力高[30-31]。同时,由于这种特性,引入Mg2+可以在玻璃网络中填隙,虽然会导致硅氧四面体的链接断裂解聚区增加,但不会使玻璃网络结构扩大[32]。同时,在硼 硅酸 盐 玻璃 中Mo6+以 Mo形式从硼硅酸盐玻璃结构中分离,富集在碱性金属/碱土金属阳离子的区域,通过改变Mo周围碱性金属/碱土金属阳离子的类型和改变平均电荷密度可以对富Mo区域环境的结构进行改变[20]。该体系中,由于Mg2+的 填隙,解聚区中Mo四面体周围的环境发生改变。Mg2+在 其中会占据部分Ca2+的位点,替代Ca2+对 Mo进行电荷补偿。由于MgMoO4晶体难以从玻璃结构中析出,从而增加了MoO3在玻璃中的溶解度。此外,Noaman等[33]提出MgO的引入会形成MgO4四面体参与玻璃网络,会吸引更多的阳离子,使玻璃网络变得更加紧密,这可能也是MoO3溶解度增加的又一原因。

图6 MgO含量为0~4.2%样品的氧摩尔体积(Vo)和氧堆积密度(OPD)
为了评价MgO对富钼硼硅酸盐玻璃化学稳定性的影响,采用PCT测试了系列样品的元素浸出率。表2是不同MgO掺入量的样品的浸出液中Ca、Na、Mo、Mg四种元素的归一化浸出率计算结果。
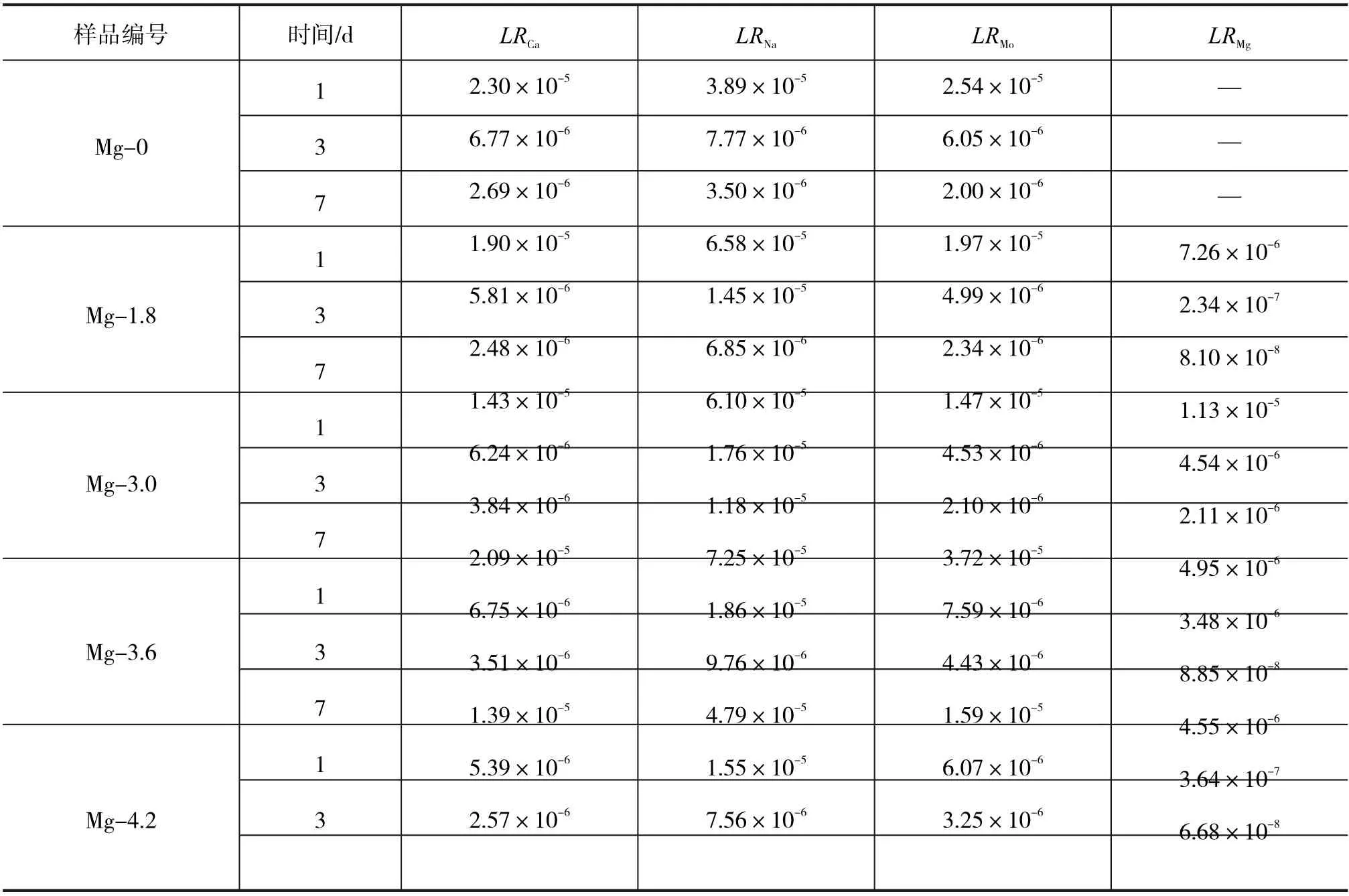
表2 样品玻璃的元素归一化浸出数据 g·m -2· d-1
通过整体数据分析发现,所有硼硅酸盐玻璃的LRCa、LRNa、LRMo和LRMg都会随着 浸 出 时间的增加而呈现逐渐下降的趋势。这要归因于在浸出实验过程中玻璃的表面氧化物与水溶液发生反应形成的一层硅酸凝胶膜,其可以有效的抑制内部元素的浸出。所有样品在7 d后的归一化浸出率均处在相当低的数量级,差异较小。此外,对于样品Mg-4.2在7 d后 的 归 一 化 浸 出 率LRCa、LRNa、LRMo和LRMg的 值 对 应 于 2.57×10-6、 7.56×10-6、3.25×10-6、 6.68×10-8g·m-2·d-1,均 低 于 标 准硼硅酸盐玻璃废物固化体的浸出率[34]。结果说明MgO的加入可以提高玻璃结构的致密性,减少了水对其的侵蚀,提高了玻璃的化学稳定性。
3 结论
采用熔融-淬火法制备了掺MgO的富Mo硼硅酸盐玻璃固化体并用XRD、SEM、Raman光谱对其结构、微结构及化学稳定性进行了表征。结果表明:MgO可以有效抑制CaMoO4晶相的析出,提高MoO3在硼硅酸盐玻璃中的溶解度。通过对玻璃密度(r)和摩尔体积(VM)等相关计算,发现玻璃的网络结构随着Mg2+掺入量的增加变得越发致密。所有样品玻璃中所有元素在7天后的归一化浸 出 率 都 处 在10-5~ 10-8g·m-2·d-1数 量 级 范 围内,表明掺入MgO的富Mo硼硅酸盐玻璃具有良好的化学稳定性。

