红酸汤发酵过程中微生物区系及挥发性物质组成变化分析
何扬波,李国林,,李咏富,罗兴邦,罗其琪,石 彬,段召燕,刘 宁
(1.贵州省现代农业发展研究所,贵州贵阳 550006;2.贵州金农辐照科技有限公司,贵州贵阳 550006;3.贵州金沙冠香坊调味食品有限公司,贵州毕节 551800;4.东北农业大学,黑龙江哈尔滨 150030)
红酸汤是贵州生态特色食品之一,以番茄、辣椒为主要原料,经清洗、粉碎、发酵、调配、磨浆等工艺加工而成。在其实际生产中,辣椒和番茄往往单独发酵,既可保证原料的多元化利用,又能据实调整产品的酸辣比例,确保口感适中,清爽怡人。文化底蕴深厚、原料来源广泛、制作工艺简单、烹饪方式多样是红酸汤的产品特色,与鱼肉、牛肉、鸭肉等均能搭配出适口佳肴。因此,相较于其他酸食,红酸汤具有更加广阔的市场前景和消费受众。
红酸汤加工工艺以自然发酵为主,其发酵过程与蔬菜发酵类似,由肠膜明串珠菌()启动的异型发酵为开端,而后以短乳杆菌()及植物乳杆菌()的同型发酵为主导,完成产品发酵的全部工作。然而,由于原料品种和生长环境的差异,附着在原料表面的微生物区系也不尽相同,导致同类发酵食品的微生物区系存在区别,进而影响发酵食品的产品质量。传统发酵食品的微生物区系较为复杂,为进一步探索红酸汤中微生物区系组成,张璇采用经典微生物分析方法发现红酸汤半成品(发酵辣椒酱和发酵番茄酱)中的优势细菌为乳杆菌属(),优势酵母菌为酵母属()、汉逊氏酵母属()和酒香酵母属(),并鉴定出12 种乳酸菌和3 种酵母菌;王琪琪等则依托Illumina MiSeq 技术得出了辣椒红酸汤和番茄红酸汤的优势细菌为乳杆菌属()和片球菌属(),优势真菌为、酵母属()、双足囊菌属()、毕赤酵母属()的结论;LIN 等也采用Illumina MiSeq 对西红柿酸汤和辣椒酸汤的真菌区系进行了分析,得出了毕赤酵母()为西红柿酸汤和辣椒酸汤优势真菌的结论。但是,红酸汤自然发酵是一个动态变化的过程,仅对发酵成熟的样品进行研究不能全面反映其微生物区系的更替趋势。目前,万宁威等已利用宏基因技术对以大米为主要原料制作的白酸汤在发酵过程微生物的群落组成进行了研究,并发现白酸汤发酵过程中的维氏乳杆菌()、法式醋酸杆菌()是优势细菌,毛榛毕赤酵母()是优势真菌,为白酸汤发酵过程的精准调控提供了技术支撑。作为更大体量的红酸汤,运用高通量技术研究其发酵过程中的微生物区系变化趋势对助力贵州酸汤产业发展而言则显得更加迫切。
微生物代谢产生的酸、醇、酮、酯等化合物是发酵食品的主要风味物质。研究表明,红酸汤的呈酸物质主要以乳酸为主,含有少量的乙酸、柠檬酸和酒石酸,且有机酸的含量是衡量其发酵程度和品质好坏的重要指标。在可挥发性成分方面,醇、酸、酯、酮、醛、烷烃等是红酸汤原料及产品中主要的化合物。另外,红酸汤不良风味现象也得到了一定关注,何扬波等采用气相离子迁移谱技术对相关样品进行研究,发现瓮臭样品中丁酸、戊酸、2-甲基丙酸、己醛和苯甲醛等物质含量更高,可能是造成产品不良风味的主要原因。上述研究虽然对红酸汤的风味组成进行了系列探索,但仍未从发酵过程角度对其组成变化进行研究,以至于红酸汤加工工艺优化尚有较多工作可做。基于此,本研究采用Illumina MiSeq测序、总酸滴定和气相色谱联用质谱技术对红酸汤发酵过程中的微生物区系、酸度及挥发性物质进行研究,以期为贵州红酸汤加工发展提供更多技术支持。
1 材料与方法
1.1 材料与仪器
发酵西红柿、红辣椒 实验室自制;E.Z.N.A™Mag-Bind Soil DNA Kit 美国Omega Bio-Tek 公司;Qubit3.0 DNA 检测试剂盒 美国Life Technologies公司;AxyPrepDNA 凝胶回收试剂盒 爱思进生物技术(杭州)有限公司;2×Hieff® Robust PCR Master Mix,Hieff NGS™ DNA Selection Beads 上海翊圣生物科技有限公司;氢氧化钠标准溶液 上海阿拉丁生化科技股份有限公司;氯化钠 成都金山化学试剂有限公司。SC-Z2 型仿手工剁菜机 清镇市顺成机械厂;12 L 恒温发酵罐 宜仟家酿酒设备有限公司;GL-88B 型漩涡混合器 海门市其林贝尔仪器制造有限公司;TND03-H-H 型混匀型干式恒温器 深圳拓能达科技有限公司;DYY-6C 型电泳仪电源、DYCZ-21 型电泳槽 北京市六一仪器厂;FR-1000 型凝胶成像系统 上海复日科技有限公司;Q32866 型Qubit®3.0 荧光计 赛默飞世尔科技(中国)有限公司;ETC 811 型PCR 仪 北京东胜创新生物科技有限公司;MiSeq 测序平台 美国Illumina 公司;PHSJ-4F 型酸度计 上海雷磁仪器厂;JJ323BC 型电子天平常熟市双杰测试仪器厂;Agilent 6890N 型气相色谱联用5975B 型质谱仪,DB-5 MS 色谱柱(30 m×0.25 mm×0.25 μm)美国安捷伦公司;HHS 型电热恒温水浴锅 上海博迅实业有限公司医疗设备厂;固相微萃取支架(手动)及萃取头(50/30 μm,DVB/CAR/PDMS)美国Supelco 公司。
1.2 实验方法
1.2.1 红辣椒、西红柿发酵工艺 挑选无明显划伤或瘢痕的西红柿、红辣椒,摘除柄蒂,清洗干净后经剁菜机剁碎,分别向西红柿、红辣椒中加入4.0%和8.0%食盐,搅拌均匀后于25~30 ℃环境中厌氧发酵。发酵后第1、7、14、21、28、42、57、72 和87 d采集发酵红辣椒(FP)、西红柿(FT)样品用于微生物区系、酸度及风味组分分析测试,每个时间点采集3 个平行样品,分别命名为FP nd1、FP nd2、FP nd3 或FT nd1、FT nd2、FT nd3,n 为采样天数,总发酵时间为87 d。
1.2.2 微生物的16S/ITS 测序 红酸汤DNA 提取、PCR 扩增参考HE 等研究方法并作适当变化。简述如下:取100 g 发酵样品在4000 r/min 条件下离心5 min 后滤去上清液取沉淀,采用OMEGA 试剂盒E.Z.N.A™ Mag-Bind Soil DNA Kit,参照其说明书步骤对红酸汤样品中微生物的DNA 进行提取。提取到的DNA 样本送生工生物工程(上海)股份有限公司进行测序和分析。其中,PCR 扩增分两轮完成,第一轮扩增:利用Qubit3.0 dsDNA 检测试剂盒对基因组DNA 精确定量后,以确定PCR 反应应加入的DNA 量。PCR 所用引物已经融合了测序平台的部分接头序列,目标扩增区域为16S rRNA 基因V3~V4 和ITS1-ITS2 区。其中,16S rRNA 基因V3~V4区扩增引物为341F(CCTACGGGNGGCWGCAG)和805R(GACTACHVGGGTATCTAATCC);ITS 区引物为ITS1F(CTTGGTCATTTAGAGGAAGTAA)和ITS2R(GCTGCGTTCTTCATCGATGC)。经过两轮扩增后得到的PCR 产物即为测序文库,通过2%的琼脂糖凝胶电泳进行检测,确认扩增产物长度符合预期。然后采用Agencourt AMPure XP 磁珠对目标条带进行回收。用Qubit3.0 dsDNA 检测试剂盒进行检测定量,最后按照等摩尔比例混合各个文库。文库采用Illumina MiSeq®平台进行测序,测序模式为双末端各300 bp。
1.2.3 总酸及pH 分析 原料及发酵过程中酸汤样品的总酸采用国家标准规定中的酸碱指示剂滴定法进行测定,pH 采用酸度计进行检测。
1.2.4 挥发性成分测定 原料及发酵过程中酸汤样品的挥发性成分分析参考XIE 等方法并做细微调整。具体步骤如下:称取2.0 g 待测样品于顶空瓶中,压盖,置于80 ℃水浴中平衡20 min。向顶空瓶中插入固相微萃取针,80 ℃水浴中20 min,上机解析5 min 后进行分析。
色谱条件:顶空不分流进样,载气为氦气,流速为1 mL/min。程序升温按如下参数进行:60 ℃保持3 min,以3.5 ℃/min 升温至100 ℃保持5 min,再以8 ℃/min 升温至200 ℃保持5 min,最后再以15 ℃/min 升温至280 ℃保持15 min。
质谱条件:电离方式为EI,电子能量为70 eV,扫描方式为全扫,质量范围为40~650 amu,接口温度为250 ℃,离子源温为230 ℃,四级杆温度为200 ℃。
定量定性分析:气相色谱联用质谱数据借助NIST 05 数据库进行分析比对,各取匹配度高于70%的前3 种组分,结合文献分析进行鉴定;各组分定量采用面积百分比法求取相对含量。
1.3 数据处理
Illumina MiSeq®平台进行测序结果采用SMRT Link(版本号10.0)、PRINSEQ(版本号0.20.4)、R 软件(版本号3.6.0)、R 软件安装包dada2(版本号1.14.0)、R 软件安装包Vegan(版本号2.5-6)、RDP classitifier(版本号2.12)、Mothur(1.43.0)等软件或数据库进行数据预处理及多样性分析。
2 结果与分析
2.1 微生物区系分析
为进一步理清红酸汤发酵过程中的微生物区系变化,采用Illumina MiSeq 三代测序技术,通过-多样性,-多样性及相对丰度等内容对辣椒红酸汤和西红柿酸汤的微生物区系动态变化情况进行系统评价。
2.1.1 辣椒酸汤微生物区系分析 发酵14~72 d 期间,辣椒酸汤的Shannon 指数均高于西红柿酸汤,表明在这段时间内发酵红辣椒的微生物群落多样性更高,详见表1。-多样性分析则以PCoA 主坐标分析图为主,样品间距离越近,则表示物种组成结构越相似。比较可知:红辣椒在发酵1 d 及7 d 的细菌物种组成高度重合,除42 d 外,从14 d 开始,每个时间点所获样品的细菌物种组成均差异显著;辣椒酸汤的真菌物种组成则呈现3 个较为明显的阶段特征,分别为1~14 d,21~57 d,72~87 d,详见图1。辣椒酸汤原料中的优势细菌主要为,相对丰度为78.92%,含有少量的泛菌(,5.15%),假单胞杆菌(,0.42%),肠膜明串珠菌(,0.29%)和果胶杆菌(,0.30%)。随着发酵启动,纳木雷氏乳杆菌()出现,逐渐演变为发酵体系中的优势细菌并参与其21~87 d 的全过程发酵,相对丰度最高时达到27.67%,详见图2a。辣椒酸汤原料中含有真菌共计17 种,在发酵中期,璞膜毕赤酵母()、德巴利酵母()和孢汉逊氏酵母()为发酵体系中的优势真菌,相对丰对和为95.88%(42 d)。发酵后期,璞膜毕赤酵母()和孢汉逊氏酵母()含量急剧减少,汉逊德巴利酵母()成为优势真菌,相对丰度达76.05%(87 d),详见图2b。

图1 辣椒红酸汤中微生物区系主坐标分析图Fig.1 PCoA of microflora in pepper sour soup

图2 辣椒酸汤发酵过程中微生物区系丰度变化图Fig.2 Variation of microflora abundance of pepper sour soup during fermentation

表1 发酵红辣椒及西红柿样品中微生物群落丰富度及α-多样性分析Table 1 Microbial community richness and α-diversity analysis in fermented red pepper and tomato samples
2.1.2 西红柿酸汤微生物区系分析 发酵过程中,西红柿酸汤微生物区系变化的规律性较强。具体而言,细菌、真菌的种类组成在7 d 内基本没有变化,从14 d开始,样品中的微生物组成随发酵时间推移而表现出连续性的变化趋势,详见图3。相对丰度是对样品中微生物-多样性及-多样性分析的直观补充。与辣椒酸汤类似,西红柿酸汤原料中优势细菌依然为(55.77%),同时含有泛菌(,15.74%),成团泛菌(,1.30%)和稻皮假单胞菌(,0.88%)。结果显示,戊糖乳杆菌()是番茄酸汤发酵的主要功能微生物。发酵早期(7 d),戊糖乳杆菌的相对丰度为0.36%。随着发酵周期延长,其相对丰度不断增加,达到了41.75%(21 d)。另外,在发酵中期及后期,短乳杆菌()、植物乳杆菌()、耐酸乳杆菌()、棒状乳杆菌()、面包乳杆菌()及也参与了番茄酸汤的乳酸发酵。除了细菌外,真菌也是番茄酸汤发酵过程的重要参与者。在番茄中,共检测到汉逊德巴利酵母()、璞膜毕赤酵母()、、等真菌共计22 种。虽然汉逊德巴利酵母和璞膜毕赤酵母均为辣椒酸汤和番茄酸汤中的优势真菌,但它们在两种酸汤发酵过程中的变化趋势截然不同,从21 d 开始,番茄酸汤中的璞膜毕赤酵母相对丰度不断增加并成为其绝对优势真菌,相对丰度最高可达80.88%(72 d),具体详见图4。

图3 西红柿酸汤中微生物区系主坐标分析图Fig.3 PCoA of microflora in tomatoes sour soup

图4 西红柿酸汤发酵过程中微生物区系丰度变化图Fig.4 Variation of microflora abundance of tomatoes sour soup during fermentation
2.2 发酵酸度分析
从微生物区系动态分析结果及部分文献可知,乳酸菌是红酸汤发酵过程的优势功能微生物,其代谢产物乳酸是红酸汤的主要呈味物质之一。以pH及总酸作为考核指标,可对酸汤发酵酸度的变化趋势进行综合研判。
2.2.1 辣椒酸汤酸度变化 随着发酵期的变化,辣椒酸汤的pH 和总酸含量呈现相反的变化趋势。其中,pH 在第21 d 时下降至最低值3.57,保持一周后呈现缓慢回升趋势,直至第87 d 变成了3.80。总酸(以乳酸计)则在28~42 d 期间达到最高峰42.87 g/kg 并保持稳定直至72 d 后出现一定程度的减少,具体见图5。

图5 发酵过程中辣椒酸汤pH 及总酸的变化Fig.5 The trend of pH and total acid in pepper sour soup during fermentation
2.2.2 西红柿酸汤发酵酸度变化 在西红柿酸汤里,pH 和总酸含量在第21 d 时分别达到最低值3.25 和最高值47.52 g/kg,相较于辣椒酸汤,西红柿酸汤拥有更高的酸度。但是,与辣椒酸汤的酸度变化趋势不同,西红柿酸汤在发酵后28~57 d 期间,总酸含量表现出明显减少的趋势,在57 d 后趋于稳定,处于33.43~33.52 g/kg 水平,具体详见图6。
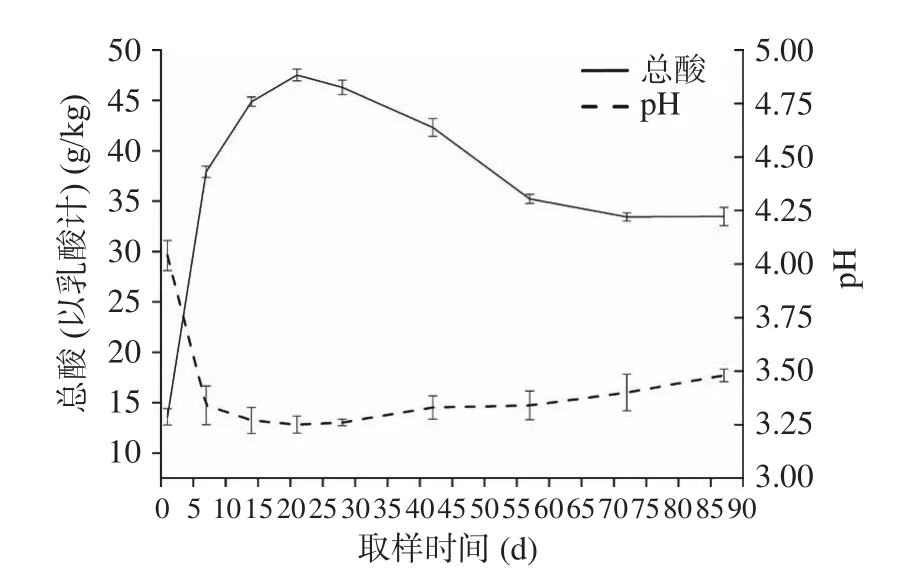
图6 西红柿酸汤发酵过程中pH 及总酸变化趋势图Fig.6 The trend of pH and total acid in tomato sour soup during fermentation
2.3 酸汤发酵过程中的挥发性物质变化
结合微生物区系的组成变化,分别采集发酵初期(1 d)、中期(28 d)和后期(87 d)样品并分析其挥发性物质的组成和相对含量,以便于了解酸汤发酵过程中的风味变化。
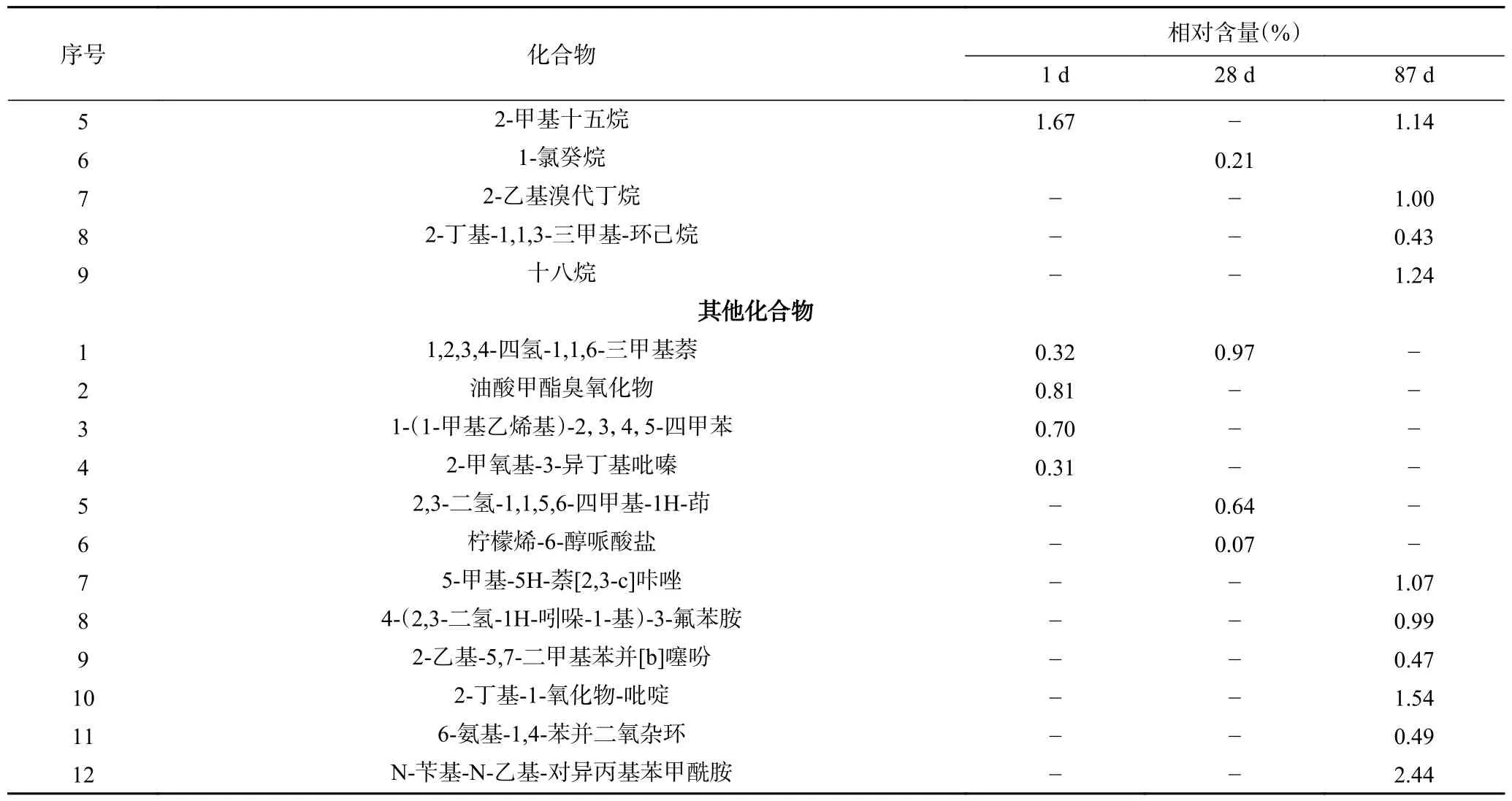
2.3.1 辣椒酸汤挥发性物质的变化 辣椒酸汤的挥发性物质主要包括醇类、酮类、醛类、酯类、酸类、烯萜类、醚类、烷烃类及其他成分共计156 种,但不同发酵阶段其具体种类差异较大,仅有乙醇、芳樟醇、-松油醇、大马士酮和a,4-二甲基-3-环己烯-1-乙醛等化合物在发酵初期、中期和后期样品中被连续检测到,其他成分则因发酵期差异而各有不同。从挥发性物质的组成来看,早期辣椒酸汤中酯类、萜烯类、酮类化合物含量较高,分别占总挥发物总量的24.99%、20.21%和17.60%。其中,十六酸乙酯(8.43%)、g-雪松烯(11.89%)、大马士酮(11.60%)分别是3 类物质中含量最高的化合物。发酵后期,辣椒酸汤中醇类物质含量由初期的12.32%增加到34.75%,主要醇类物质为芳樟醇(10.43%)、-松油醇(7.68%)、苯乙醇(6.44%)和乙醇(4.03%),除乙醇是稳步增加外,其他醇类物质在发酵中期及末期均发生了较大变化;酮类、醛类、萜烯类化合物相对含量分别下降至5.68%、4.78%和1.49%,2-乙基环丁酮(2.04%)、a,4-二甲基-3-环己烯-1-乙醛(2.99%)和2-蒈烯(0.88%)为辣椒酸汤发酵末期含量最高的酮、醛及萜烯类的代表物质。另外,在发酵末期检出的酯类和酸类化合物较发酵初期种类少,但整体含量有所提升,分别由24.99%、3.44%增加至34.41%和5.43%,具体详见表2。

表2 不同发酵期辣椒酸汤挥发性化合物种类及相对含量Table 2 The types and contents of flavor substances in pepper sour soup at different fermentation stages

续表 2

续表 2
续表 2
2.3.2 西红柿酸汤挥发性物质的变化趋势 西红柿酸汤中检出挥发性物质共计92 种(表3),与辣椒酸汤不同,整个发酵期未检出醚类和酯类化合物,但在发酵中期和后期出现了2,6-二叔丁基对甲酚、2,4-二叔丁基苯酚、愈创木酚等多种酚类化合物。醛类和酮类化合物是西红柿酸汤早期的主要成分,分别占挥发物总量的41.30%和20.28%,含量最高的醛、酮化合物分别为青叶醛(29.75%)和6-甲基庚烯酮(10.21%)。随着发酵周期变化,醇类、酚类、酸类和烷烃类化合物相对含量分别增加至54.24%、11.88%、6.64%和3.36%。与辣椒酸汤不同,西红柿酸汤中的主要醇类化合物为苯乙醇(31.93%)、乙醇(8.83%)和异戊醇(5.28%),酚类化合物为4-乙基苯酚(8.71%)。酮类、醛类化合物的种类及相对含量呈现出剧烈减少趋势,发酵后期分别为1.28%、3.72%,但酮类化合物仍以6-甲基庚烯酮为主,醛类物质则以2,4-二甲基苯甲醛为代表。酸类化合物则随发酵时间变化呈现出多元化趋势,辛酸、trans-3-己烯酸、月桂酸等均在87 d 样品中被检测到。其他化合物中,2-异丁基噻唑含量最高(2.04%),直到发酵中期其含量均较为稳定。
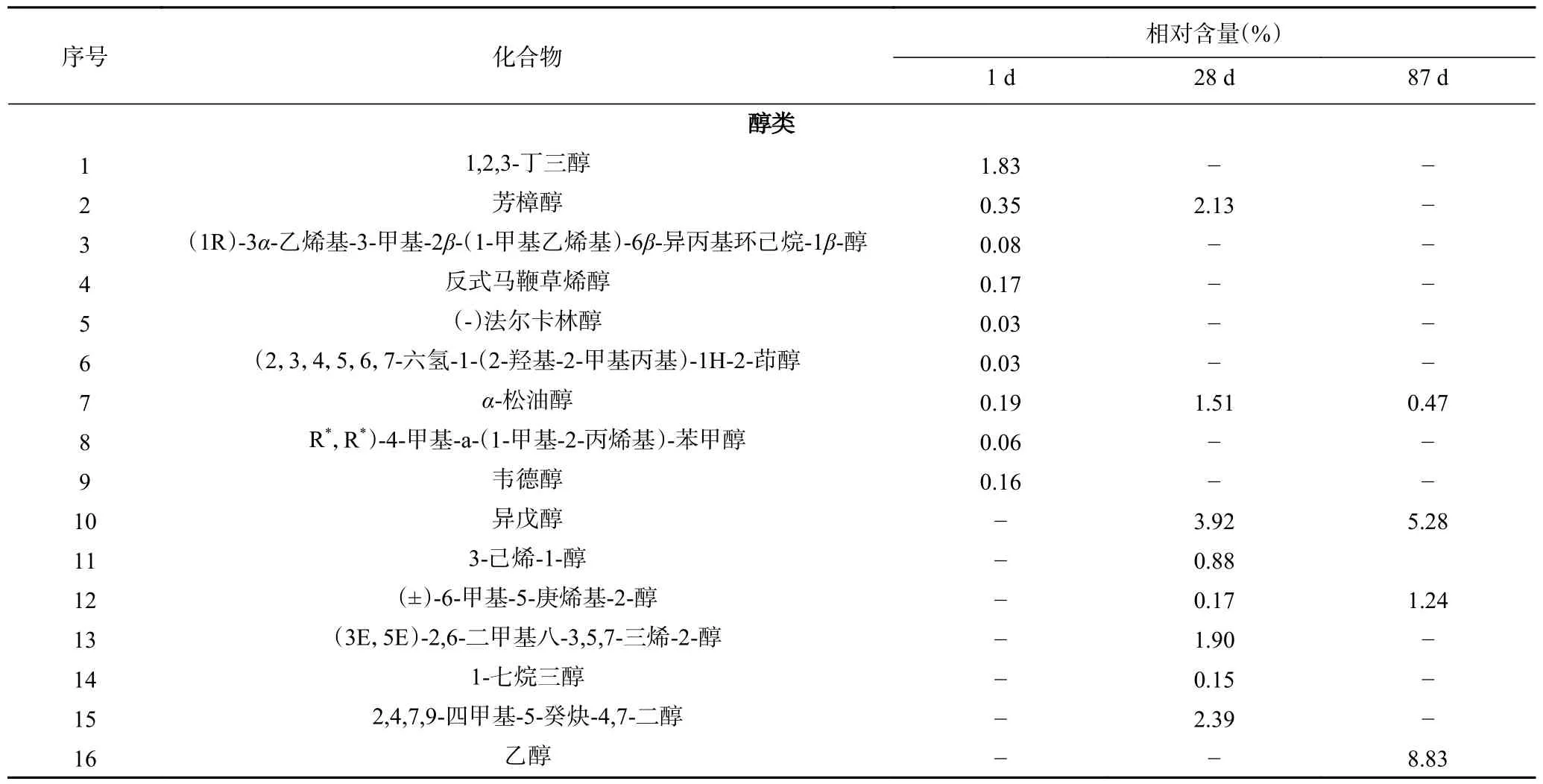
表3 不同发酵期西红柿酸汤挥发性化合物种类及相对含量Table 3 The types and contents of flavor substances in tomato sour soup at different fermentation stages

续表 3

续表 3
3 讨论与结论
从原料开始,本研究对酸汤加工过程进行了周期为87 d 的发酵实验,分析了红酸汤半成品(辣椒酸汤、西红柿酸汤)的微生物区系、酸度及挥发性物质组成变化。酸汤原料中优势微生物为,该细菌是Lamprinou 等从希腊及西班牙洞穴中于2011 年发现的新种,在微生物分类学上属蓝细菌门(Cyanobacteria),极大概率是由辣椒植株由产地土壤中富集而来。作为极端条件下的先锋物种,在破碎红辣椒及西红柿的丰富营养条件下,丰度在早期的发酵盐水中得到了一定程度增长,而后随着发酵环境中酸度增加、微生物区系多元增殖而得到抑制,但依然以15.98%~38.65%的相对丰度存在,这需要在后续研究中对其微生物安全性加以关注。辣椒酸汤和西红柿酸汤分别以纳木雷氏乳杆菌()和戊糖乳杆菌()、短乳杆菌()为优势乳酸菌,与王琪琪等报道的耐酸乳酸菌()和有所不同,这可能与样品加工环境、温度及原料表面附带的微生物和发酵体系中的内生菌有关。汉逊德巴利酵母()和膜璞毕赤酵母()为原料发酵后期的优势真菌,且在辣椒和西红柿中相对丰度正好相反,这与王琪琪及Lin 等的研究结果在种类及相对丰度上均有一定差异,进一步证明了环境条件、原料状况对红酸汤发酵的直接影响。因此,虽然Carl 等提出了蔬菜发酵是由肠膜明串珠菌启动,经片球菌、短乳杆菌、植物乳杆菌的分阶段混合发酵的结果,但针对不同的原料、环境和加工工艺,加强红酸汤功能微生物的动态研究依然具有重要意义。
红酸汤中,以乳酸、乙酸、柠檬酸、酒石酸为代表的有机酸既具有抗氧化活性,又是产品发酵的成熟指标之一。本研究中,辣椒和西红柿酸汤的总酸和pH 在第21 d 时达到峰值,明显晚于与韦明明和郑莎莎等报道的酸汤pH 及总酸峰值出现时间,这主要是因为本研究酸汤制作工艺完全采用自然发酵,未加入老汤“引子”和外接发酵剂的缘故。pH 和总酸变化趋势呈现差异的原因主要在于pH 是指氢离子的实际浓度而总酸表示可滴定型酸的存在状态,两者会因为产品中乳酸和柠檬酸等有机酸的强弱及含量情况而导致测试结果存在偏差。在发酵前14 d,酸汤样品的pH 和总酸变化极快,但微生物结果显示此阶段内乳酸菌的数量及种类较少,故而红酸汤发酵初期微生物活动及其产酸机制有待深入研究。
市售红酸汤为辣椒酸汤和西红柿酸汤发酵成熟后按比例调配得到的酸辣调味料。因此,掌握辣椒和西红柿酸汤在发酵过程中的挥发性物质变化对研究红酸汤的风味组成具有重要意义。辣椒酸汤中,醇类、酮类、醛类、酯类化合物为主要风味贡献物,这与其他研究人员的结果较为一致。稍有区别的是风味物质的具体种类与对照文献相比存在较大区别,另外在发酵初期的辣椒酸汤中检出了较多萜烯类化合物,以雪松烯为主,这可能与使用的辣椒品种差异有关。发酵中、后期,醇类与酯类化合物含量变化趋势相反,这可能是厌氧发酵产生的乳酸与醇作用生成酯的结果。实验结果表明,醛、酮、酯是西红柿酸汤中的主要风味物质且青叶醛和己醛相对含量达到了29.75%和3.50%,这与其他人报道青叶醛、己醛等9 类物质是西红柿中关键风味物质的学术观点相互应证。发酵后期,西红柿酸汤中出现大量的醇类和酚类物质,这可能与真菌中毕赤酵母和德巴利酵母的活动有关,具体相关性需采取更多措施予以探究。
综上所述,红酸汤发酵过程以乳酸菌和酵母菌为优势微生物。其中,纳木雷氏乳杆菌()和戊糖乳杆菌()分别为辣椒酸汤和西红柿酸汤的优势乳酸菌,相对丰度最高时达到27.67%(57 d)和41.75%(21 d);汉逊德巴利酵母()和膜璞毕赤酵母()为两种酸汤的优势酵母菌,其变化趋势随发酵期变化各不相同。在发酵后期,辣椒酸汤以汉逊德巴利酵母为主,相对丰度为76.05%(87 d);西红柿酸汤则以膜璞毕赤酵母为优势,相对丰度可达80.88%(72 d)。本文对辣椒和西红柿酸汤的总酸及pH 变化情况进行了跟踪分析,两种酸汤的总酸和pH 均于21~28 d 期间达到或接近极值(总酸:辣椒酸汤42.87 g/kg,西红柿酸汤47.52 g/kg;pH:辣椒酸汤3.57,西红柿酸汤3.25),与乳酸菌优势菌群形成的时间保持一致。在挥发性物质组成方面,辣椒和西红柿酸汤中分别检测到醇、酮、醛、酯等各类化合物157 和92 种。酯类、萜烯类、酮类化合物是早期辣椒酸汤中含量较高几类化合物,分别占总挥发物总量的24.99%、20.21%和17.60%;西红柿酸汤在发酵初期的主要挥发性物质为醛类(41.30%)、酮类(20.28%)化合物。随着发酵期的变化,辣椒酸汤的主要风味物质为醇类、酯类化合物,以芳樟醇(10.43%)、-松油醇(7.68%)和十六酸乙酯(12.12%)及乙酸乙酯(4.63%)等为代表;西红柿酸汤中则以醇类和酚类为优势,其中,苯乙醇(31.93%)、4-乙基苯酚(8.71%)为西红柿酸汤风味贡献了重要作用。通过对辣椒、西红柿酸汤发酵过程中的微生物区系、酸度及挥发性成分进行上述研究,可以为酸汤直投式发酵剂的研制提供优势菌株参考,为进一步优化红酸汤加工工艺奠定理论基础。

