巴郎山大叶醉鱼草叶片非结构性碳水化合物和氮分配的海拔响应
乌佳美,冯秋红,史作民,4,*,刘 顺,曹向文,许格希
1 中国林业科学研究院森林生态环境与自然保护研究所, 国家林业和草原局森林生态环境重点实验室, 北京 100091 2 四川米亚罗森林生态系统定位观测研究站,理县 623100 3 四川省林业科学研究院, 成都 610081 4 南京林业大学南方现代林业协同创新中心, 南京 210037
海拔是限制植物生活型和地理分布的重要因素[1]。随海拔升高,一些环境因子(如温度、CO2和O2分压、大气压强、光照强度等)发生明显变化[2—3]。海拔差异所引起的生长环境的变化驱动着植物生理和形态适应的多样化[4],海拔梯度为验证植物对环境变化的响应和适应提供了基础。
叶片非结构性碳水化合物(NSC),包括可溶性糖和淀粉,是植物光合作用的产物,参与植物的生长和代谢[5—6],当光合作用产生的碳供应超过植物生长和维持的需求时,大量的NSC将储备积累在植物组织中,以支持未来的生长[7—8]。高海拔环境中较低的温度致使植物既需要足够的碳水化合物来维持生长,同时也需要充足的可溶性碳水化合物来提高其在低温环境下的生存能力[9],NSC、可溶性糖和淀粉含量的水平可以反映出植物中碳的吸收、利用与损失之间的平衡,以及植物对环境变化的响应[5, 10]。氮(N)是植物光合作用中的重要元素,大量的叶片氮(高达75%)存在于叶绿体中,其中大部分用于光合系统[11—12]。氮可直接影响叶片以及其他组织中的NSC的浓度[13],以往的研究显示,叶片氮含量与NSC的固定能力呈正相关关系[14—16],同时NSC/N比值可以作为植物碳氮平衡的衡量指标[17]。分配于光合系统氮比例的增加可以支持植物具有较高的光合速率[18],而分配于其他组分氮比例涉及到细胞内以不同形式存在的氮,或作为其他含氮物质原料,或参与到其他生理过程以提高植物对环境的适应性[19—20],各个组分间氮分配比例的调节紧密联系着植物的生长、发育、防御和竞争[18]。在不同的研究对象与生长条件下,植物叶片NSC及可溶性糖和淀粉、氮含量与氮分配对海拔的响应并不一致[21—27],这种差异的潜在驱动因素,仍不是特别清楚[7],对于NSC与氮和氮分配相互关系方面的研究仍然缺乏。
大叶醉鱼草(Buddlejadavidii)在川西亚高山林区分布广泛,海拔跨度较大,适应能力强,是研究植物对海拔响应与适应的理想物种。通过本研究,试图回答以下科学问题:1) 随海拔升高,大叶醉鱼草叶片NSC及可溶性糖和淀粉,和氮含量及氮分配的响应如何?2) 大叶醉鱼草叶片NSC与氮和氮分配之间有什么样的关系?3) 大叶醉鱼草叶片NSC及可溶性糖和淀粉,和氮含量及氮分配情况在植物适应与响应不同海拔环境的过程中有什么样的作用?
1 研究区域与研究方法
1.1 研究区域概况
巴郎山位于横断山脉东部,青藏高原东南缘的邛崃山东坡,地处卧龙自然保护区范围(30°45′—31°25′N,102°52′—103°24′E),是四川盆地向川西高原的过渡地带,海拔跨度较大,最高5040 m。属亚热带内陆山地气候,冬寒夏凉、干湿季节明显,植物种类丰富。在海拔2700 m地带,年平均气温8.4 ℃,≥ 0 ℃的活动积温为4000 ℃,年平均降水量861.8 mm,其中生长季5—9月的降水量占全年降水量的68.1%,年平均相对湿度在80%左右。山地棕壤为其主要土壤类型[28—29],土壤有机质含量在2%—8%,土壤呈微酸性反应,pH值6.0—6.5。阳离子交换量每100 g ± 20—40 cmol(+),交换性阳离子以钙、镁和钠为主[30]。
1.2 研究方法
1.2.1样地选取与样品采集
2016年7—8月,沿巴郎山选择5个不同海拔(2200 m、2500 m、3100 m、3400 m和3700 m)的研究地点,每个地点选取7株不被遮挡的生长良好的大叶醉鱼草植株,每个植株选择2—3片新的完全伸展健康的向阳叶片,用于光合参数的测定。每株取30片鲜叶片,进行扫描(Perfection v700 Photo, Epson, Nagano-ken, Japan),用于估算叶片面积,随后在105 ℃烘箱中杀青带回,放入(70±2) ℃的烘箱中烘干至恒量,称量叶片干重,并进行比叶重(LMA,g/m2)的计算。随后粉碎并过0.25 mm筛,用于测定叶片NSC含量和氮含量;另取1份鲜叶片用锡纸包裹,存于液氮中带回,用于叶片细胞壁氮含量和叶绿素含量(Cchl)的测定。
1.2.2光合参数的测定
在晴天的09:00—15:00使用Licor- 6400便携式光合作用测定系统(LI-Cor, Lincoln, NE, USA),适配6400- 40荧光叶室对植物叶片进行光响应曲线、CO2响应曲线和叶绿素荧光参数的测定。测定时使用高枝剪取下树枝后立即插入装满清水的桶中,随后在水里进行二次剪切,剪掉树枝底端以防因气体栓塞而影响植物相关叶片光合参数。
对叶片进行光响应曲线及CO2响应曲线的测定。测定时将叶室温度设定为25 ℃,湿度控制在60%—80%。气体交换测定时首先将参比室CO2浓度设定为大气CO2浓度,按照由高到低依次为1800、1500、1200、1000、800、600、400、200、150、100、80、50、20、0 μmol m-2s-1的光合光量子通量密度(PPFD)梯度测定叶片光响应曲线,利用获得的光响应曲线确定光饱和点。在饱和PPFD下,将叶室CO2浓度设定为400 μmol/mol,待系统稳定后进行CO2响应曲线测定,将参比室CO2浓度按照400、200、150、100、80、50、400、600、800、1000、1200、1500、1800和2000 μmol/mol进行设定。在饱和PPFD、大气CO2浓度下,叶片经充分光活化后,进行叶绿素荧光参数测定,设定饱和脉冲光光强> 8000 μmol m-2s-1(0.8s)。
1.2.3叶肉导度、最大羧化速率和最大电子传递速率的估算
叶肉导度(gm,molCO2m-2s-1)的估算使用Harley等[31]提出,并由Loreto等[32]改进的J变量法。对叶片最大羧化速率(Vcmax,μmol m-2s-1)和最大电子传递速率(Jmax,μmol m-2s-1)的估算使用Sharkey等[33]提供的Microsoft Excel拟合程序。
1.2.4叶片NSC含量的测定
叶片NSC含量为可溶性糖和淀粉含量之和,其中可溶性糖主要对单糖(这里指葡萄糖和果糖)和多糖两个部分进行了分析,所有含量的单位均为百分比干重。
参照《现代使用仪器分析方法》[34],进行可溶性糖的提取。将约0.5 g干粉样品与50 mL蒸馏水一起加入锥形瓶中。在蒸汽锅中煮沸2 h后,将溶液样品冷却,然后定容过滤,滤液待上机。将滤液注入装有Sugar-Pak I柱的Waters 2695高效液相色谱仪(Waters-Millipore,Milford,MA,USA)中,进行葡萄糖、果糖、多糖等可溶性糖的测定。
参照《食品物理化学分析方法》[35],进行淀粉的提取。将约0.1 g干粉样品加到装有10 mL蒸馏水的塞管中,并加入1 mL 2∶1的HCL,然后在100℃下水浴8 h。冷却后,用40%NaOH将pH调至中性,然后定容过滤,滤液待上机。淀粉含量的测定方法与可溶性糖的测定方法相同。
1.2.5叶片氮含量及氮分配比例的测定与计算
用凯氏定氮法测定叶片氮含量(g/kg),采用化学分离法测定细胞壁氮含量(g/kg)[36],采用分光光度计法测定叶绿素含量[37]。叶片氮分配的计算参见Niinemets和Tenhunen[38]:
PP=PR+PB+PL
PP+PCW+Pother=1
式中:PR(g/g)为核酮糖- 1,5-二磷酸羧化酶/加氧酶(Rubisco)氮分配比例,PB(g/g)为生物力能学组分氮分配比例,PL(g/g)为捕光组分氮分配比例。Narea是单位面积氮含量(g/m2)。Vcr为Rubisco比活,Jmc为单位细胞色素f(Cytochrome f)的最大光合电子传递速率,在25℃时Vcr为20.78(μmolCO2(g Rubisco)-1s-1),Jmc为155.64(μmol electron (μmol cytochrome f)-1s-1)。Cchl为叶绿素浓度(mmol/m2),CB为捕光组分中叶绿素与氮的比值(mmol Chl (g N)-1),取值可以利用拟合出的CB与LMA的线性公式来进行计算,其相关系数较高(R2=0.97),可以在多种植物类型中广泛应用[19]。PP(g/g)为光合系统氮分配比例;PCW(g/g)为细胞壁氮分配比例,是细胞壁氮含量和单位干质量叶片氮含量之商;Pother(g/g)为其他组分氮分配比例。
1.3 数据处理
采用SPSS 22软件对数据进行统计分析。采用单因素方差分析(one-way ANOVA)检验不同海拔间NSC、可溶性糖和淀粉含量、氮和氮分配比例的差异,并用Tukey方法进行多重比较,在P<0.05时差异显著;采用Spearman相关分析NSC及可溶性糖和淀粉含量,和氮分配比例之间的关系。利用Origin 8软件作图。
2 结果与分析
2.1 大叶醉鱼草叶片NSC、淀粉和可溶性糖含量随海拔的变化
随海拔升高,大叶醉鱼草叶片单糖、可溶性糖、淀粉和NSC含量呈增加趋势,而多糖含量、可溶性糖/淀粉在海拔间无显著差异(图1)。单糖在海拔3400 m和3700 m含量较高,而在海拔2200 m和2500 m较低,前者平均是后者的4.5倍。可溶性糖在海拔3700 m含量最高,在海拔2200 m最低,海拔3700 m的可溶性糖含量是2200 m的2.4倍。淀粉在海拔3700 m含量最高,而在海拔2500 m最低,海拔3700 m的淀粉含量是2500 m的1.6倍。NSC含量在海拔3700 m最高,而在海拔2200 m和2500 m最低,前者平均是后者的1.9倍。海拔每升高1000 m大叶醉鱼草叶片单糖、可溶性糖、淀粉和NSC含量分别增加6.2、10.9、5.0和15.9 g/100g。
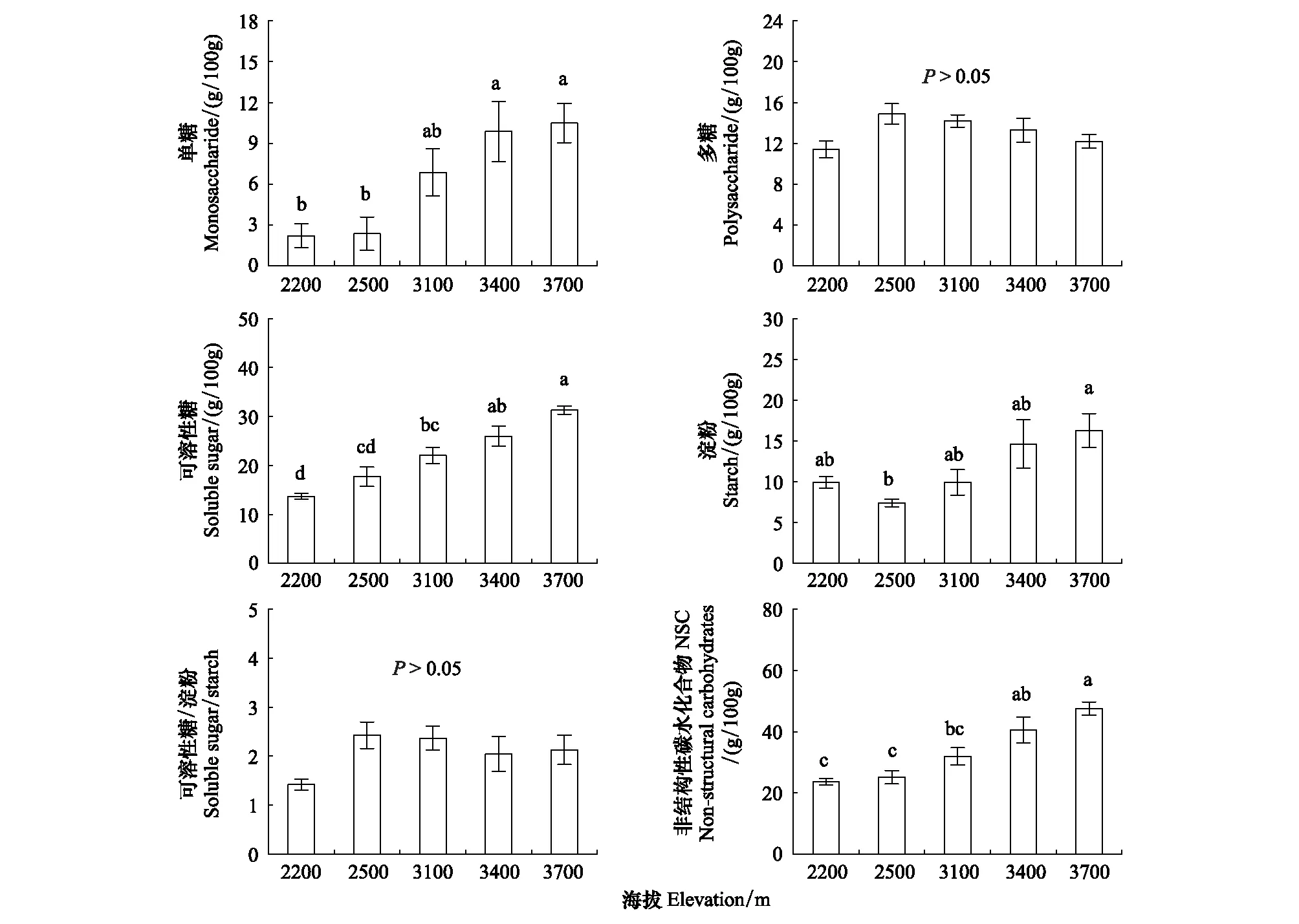
图1 不同海拔大叶醉鱼草叶片单糖、多糖、可溶性糖、淀粉和NSC含量及可溶性糖/淀粉比值Fig.1 The contents of monosaccharide, polysaccharide, soluble sugar, starch and NSC, and soluble sugar/starch ratio of Buddleja davidii leaves at different elevations不同小写字母代表不同海拔间差异显著(P<0.05);图中数据为平均值±标准误差(n=5—7)
2.2 大叶醉鱼草叶片氮分配比例随海拔的变化
不同海拔间PP、PR、PB和PL没有显著差异(图2)。随海拔升高,叶片PCW呈降低的趋势,海拔2200 m的PCW最高,而海拔3400 m和3700 m的PCW较低,前者平均为后者的2倍。叶片分配于除光合系统与细胞壁以外的其他组分的氮比例(Pother)随海拔的升高则呈增加的趋势,海拔3700 m的Pother最高,海拔2200、2500、3100 m较低,前者平均为后者的2.6倍。此外,沿海拔梯度大叶醉鱼草叶片PR和PCW没有表现出显著的相关关系(图3)。
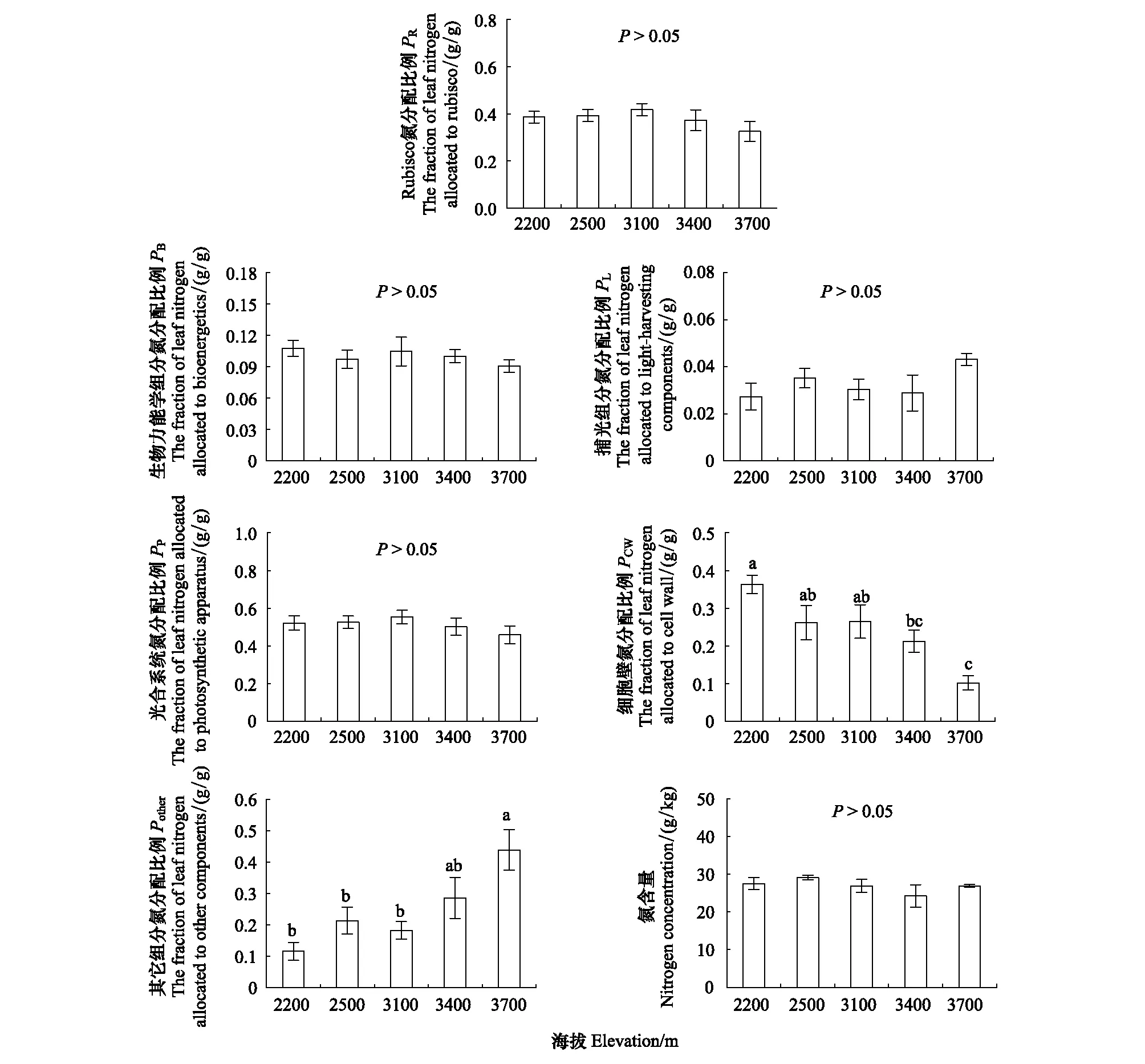
图2 不同海拔大叶醉鱼草叶片氮和氮分配比例Fig.2 Nitrogen concentration and fraction of nitrogen allocations of Buddleja davidii leaves at different elevations不同小写字母代表不同海拔间差异显著(P<0.05);图中数据为平均值±标准误差(n=5—7)
2.3 大叶醉鱼草叶片NSC/N比值随海拔的变化
如图4所示,随海拔升高,大叶醉鱼草叶片NSC/N比值呈增加的趋势,海拔3400 m和3700 m显著高于海拔2200 m和2500 m。
2.4 大叶醉鱼草叶片NSC、可溶性糖和淀粉含量与氮分配比例的相关性
如表1所示,大叶醉鱼草叶片可溶性糖含量与淀粉含量、NSC和Pother显著正相关,与PCW显著负相关。淀粉含量与NSC含量显著正相关,与PCW显著负相关。NSC含量与Pother显著正相关,与PCW显著负相关。PP和PCW与Pother显著负相关。
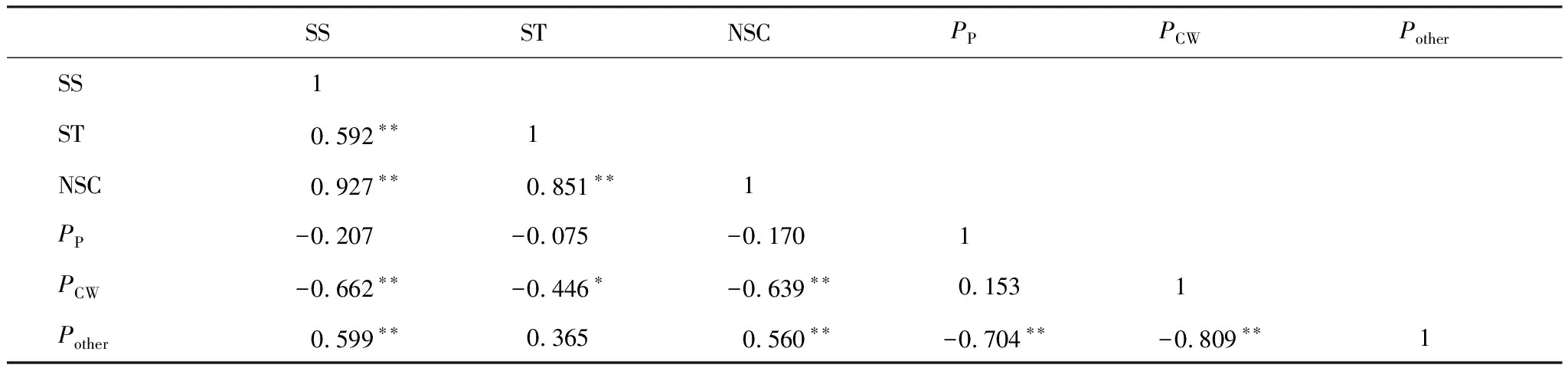
表1 不同海拔大叶醉鱼草叶片NSC、可溶性糖、淀粉和氮分配比例的相关系数
3 讨论
3.1 大叶醉鱼草叶片NSC、可溶性糖和淀粉含量的海拔响应
大叶醉鱼草叶片NSC含量随海拔升高而增加(图1),这与Wang等[7]对川滇高山栎(Quercusaquifolioides)、Wang等[39]对岳桦(Betulaermanii)研究得到了一致的结果,但也有研究得到了不同的变化趋势[21, 40],这可能是受树种、研究区域生境(如温度、水分)、竞争等因素的影响[5, 13, 21]。对NSC进一步的分析发现NSC含量沿海拔的变化趋势与可溶性糖和淀粉含量的变化趋势一致,可溶性糖/淀粉比值随海拔没有显著的变化趋势(图1),且NSC含量、可溶性糖和淀粉含量三者间相互显著正相关(表1),说明高海拔大叶醉鱼草叶片NSC含量的增加是可溶性糖和淀粉含量共同积累的结果,这与以往的一些研究结果一致[41],但研究对象或研究地点的差异使NSC含量累积有不同的决定因素[24, 27]。以往研究认为,叶片碳储备库(淀粉含量)的增加是对生长速率降低的被动响应[18],也是植物响应高海拔较恶劣的环境条件的一种保险措施[42]。相较于非渗透调节活性物质的淀粉[43],可溶性糖的增加提高了细胞液渗透压,为植物提供渗透保护以防止冻伤、结冰并抵御低温[27, 44]。本研究中大叶醉鱼草叶片可溶性糖随海拔显著升高的变化趋势与单糖的变化趋势一致(图1),说明可溶性糖的变化主要是由单糖含量引起的。单糖通常用作细胞呼吸和其他分子合成的渗透调节物质和底物,主要参与维持代谢活性和渗透势,而多糖渗透活性较低,是常见的淀粉成分,允许植物大量累积[6]。
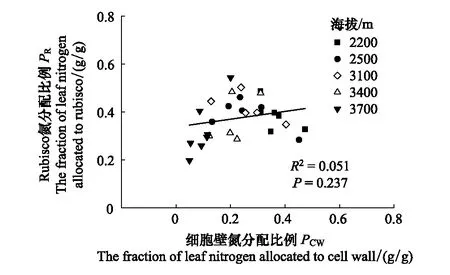
图3 不同海拔大叶醉鱼草叶片Rubisco氮分配比例(PR)和细胞壁氮分配比例(PCW)的关系Fig.3 The fraction of leaf nitrogen allocated to Rubisco (PR) in relation to the fraction of nitrogen allocated to cell wall (PCW) in leaves of Buddleja davidii at different elevations
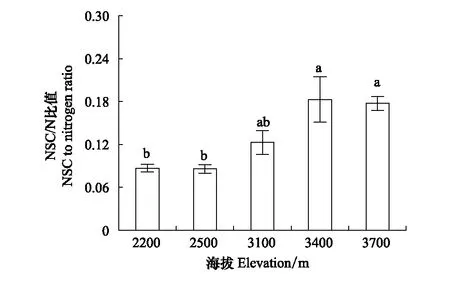
图4 不同海拔大叶醉鱼草叶片NSC/N比值 Fig.4 NSC to nitrogen ratio of Buddleja davidii leaves at different elevations不同小写字母代表不同海拔间差异显著(P<0.05);图中数据为平均值±标准误差(n=5—7)
叶片NSC含量取决于两个方面,一是碳供应(光合作用),二是碳消耗(呼吸和生长)[14]。有研究认为高海拔较低的温度可能对光合作用有较大的限制[45],但也有研究证实低温对植物光合作用的影响往往滞后于对体内其他生化过程的抑制[43],生长比光合作用对寒冷更敏感[44, 46]。一些研究认为高海拔地区的植物碳供应是充足的[25, 47],因此在这种前提下,高海拔较高的叶片NSC含量与其他同化需求(如呼吸、生长等)的降低有关[8]。有很多研究证实,低温下的植物生长会大大降低[46, 48],随海拔升高的低温诱导限制了植物光合同化产物转化为结构性物质[43],致组织形成受限,从而导致充足的碳没能被生长利用[49],进而引起叶片NSC的累积。
3.2 大叶醉鱼草叶片氮分配比例的海拔响应
大叶醉鱼草叶片氮含量没有随海拔变化发生显著的差异(图2),这与以往的一些研究结果一致[7]。但不同植物物种与研究区域的差异,会使叶片氮含量随海拔变化呈现出不一致的变化趋势[50]。大叶醉鱼草叶片分配于各组分的氮比例随海拔升高表现出了不一致的变化趋势(图2)。叶片PP、PR、PB和PL在海拔间差异不显著,这与以往的研究结果不完全一致[23, 26],因此,植物分配于光合系统中各组分的氮与海拔并没有一致的变化趋势,引起这些差异的原因可能是植物物种、生境以及叶经济性状的不同[51]。随海拔升高而分别降低和升高的PCW和Pother与以往对糙皮桦(B.utilis)叶片沿海拔梯度氮分配的研究结果一致[28],说明随海拔升高,大叶醉鱼草叶片并没有通过调高PP来增强资源获取能力,而是通过调整PCW和Pother来适应变化的生境。
以往的研究认为PR和PCW间的关系代表了叶片分配于细胞壁的氮的变化是否影响分配于光合作用的氮,即是否存在生长和形态建成之间竞争性的取舍[52—53]。一些研究显示PR和PCW存在权衡关系[54—55],但同样也有研究认为PR和PCW间没有发生权衡[53, 56]。对于PR和PCW间是否发生权衡与植物物种、生长阶段及生长环境有很大关系。本研究中,沿海拔梯度大叶醉鱼草PR和PCW没有表现出显著的负相关关系(图3),说明随海拔的变化PR和PCW之间可能并没有发生权衡,这也进一步证明大叶醉鱼草叶片氮分配对海拔梯度的响应主要在于对PCW和Pother的调整。
3.3 大叶醉鱼草叶片非结构性碳水化合物与氮和氮分配比例的相关性
叶片NSC/N比值在很大程度上反映了NSC的产出和利用效率与氮的投入之间的关系[57],随着海拔的升高,大叶醉鱼草叶片NSC/N比值显著增加(图4),这与Wang等[7]对川滇高山栎的研究得到了一致的趋势,有研究认为NSC/N比值的增加可能意味着每单位氮的投入产出了更多的NSC,即氮的利用效率较高[58]。通过对比大叶醉鱼草叶片NSC含量和氮含量随海拔的变化趋势,发现随海拔升高NSC/N比值的增加主要归因于随海拔增加的NSC含量而非海拔间差异不显著的氮含量,说明氮不是NSC累积的限制因子,即在不同海拔间氮对于大叶醉鱼草来说是充足的。虽然叶片光合能力和NSC合成受到氮的重要影响[18],但在叶片氮充足的条件下,大叶醉鱼草叶片NSC含量与PP没有显著的相关性(表1),即叶片用于光合作用的氮也不是NSC含量在高海拔较高的累积量的直接原因。
叶片非结构性碳水化合物含量反映了可用于抵御外部不利环境的植物碳水化合物的数量[6],尤其叶片中可溶性糖的积累对植物来说是一种耐冰冻的机制[44]。而Pother同时也关系到植物生殖、防御、结构以及激素的生产、储存和再利用等生理过程,Pother的增加可增强植物适应外界环境的能力[19]。这也解释了本研究中大叶醉鱼草叶片Pother与NSC含量和可溶性糖含量的显著正相关关系(表1)。结合Pother、NSC含量和可溶性糖含量随海拔升高所呈现出的一致的升高趋势(图1,图2),说明大叶醉鱼草通过支持叶片其他生理过程的活性提高了抵御高海拔较恶劣环境的能力。
4 结论
高海拔低温降低了大叶醉鱼草的同化需求,限制了叶片光合同化产物转化为生长所需的结构性物质,使叶片累积了较高的为植株提供保险措施的淀粉含量和提供渗透保护与参与代谢过程的可溶性糖含量。随海拔升高,大叶醉鱼草叶片氮和其中分配于光合系统的氮维持不变,为其在不同海拔提供了稳定的资源获取能力,高海拔增加的分配于其他组分的氮,增强了叶片其他生理过程的活性。随海拔升高而增加的叶片非结构性碳水化合物含量和分配于其他组分氮比例,与二者相互间紧密的相关性,共同为提高的大叶醉鱼草抵御和适应高海拔较恶劣生境的能力提供了支持和保证。

