不同品种薄壳山核桃林地土壤微生物多样性及群落组成
鲍佳书,汤玉洁,刘俊萍,彭方仁
(南京林业大学 a.林学院;b.南方现代林业协同创新中心,江苏 南京 210037)
土壤微生物作为土壤生态系统中最具活力的部分,主要承担着分解者的作用,在土壤形成、物质转化和能量流动等过程中发挥重要作用[1],同时可以在改善土壤肥力的基础上为宿主植物创造良好的生长环境,因此土壤微生物与植物之间的相互作用对生态环境的稳定形成具有重要意义[2]。研究表明宿主植物是影响土壤微生物的主要因素之一[3],甚至除了植物类型外,同一植物的不同品种在土壤微生物的群落特征上也会有所不同,表现为数量及多样性等方面,在油菜Brassica napus、桑树Morus alba等研究中均有相关报道[4-5]。张楠[5]发现不同品种桑树土壤优势菌群类别相似,但土壤微生物群落结构具有明显差异。农泽梅等[6]认为不同品种甘蔗Saccharum officinarum的根际土壤细菌群落结构存在一定差异,可能影响甘蔗氮的吸收效率。蔡秋华等[7]研究得出不同抗性品种烤烟根际微生物群落结构和多样性存在差异。因此品种间的差异是土壤微生物与植物互作效应中的重要影响因子。
传统土壤微生物研究主要依赖于分离培养,不能客观描述出微生物群落特征等信息,对微生物组成的认识是片面的、有选择性的[8]。近年来,随着分子生物学研究方法的兴起,利用高通量测序分析微生物结构组成和多样性逐渐成为土壤微生物领域的主要手段[9-10]。目前对木本植物如杨树Populus[11]、樟子松Pinus sylvestrisvar.mongolicaLitv[12]、芒果Mangifera indica[13]、桉树Eucalyptus robusta[14]、刺 槐Robinia pseudoacacia[15]、大 叶 女贞Ligustrum compactum[16]等均有报道。汪其同等[11]利用454焦磷酸测序发现杨树根际和非根际土壤细菌群落多样性和组成具有显著差异。靳晓拓等[13]采用Illumina MiSeq高通量测序发现在减量配施有机肥的情况下,可以提高芒果园土壤细菌群落的丰富度和多样性,改变土壤细菌群落结构。王帅帅等[17]通过Illumina MiSeq高通量测序技术发现混施有机肥和无机复合肥使得桑树根际土壤细菌及根系内生细菌多样性明显高于单施复合肥处理组,且有机肥和无机肥混施改变了桑树根际土壤和根系内生细菌的群落组成。
薄壳山核桃Carya illinoinensis又名长山核桃,俗称碧根果,为胡桃科山核桃属植物,是世界上重要的经济林树种,集果用、材用、观赏价值为一体,具有极高的综合价值[18-19]。目前对薄壳山核桃微生物方面的研究多集中于用传统培养手段研究病原菌[20]、块菌[21]等,缺乏对其林下土壤微生物多样性及群落特征等基础信息的研究。细菌和真菌在根际与非根际的栖息环境不同可能会导致根际和非根际微生物的多样性和群落组成不同[22-23]。薄壳山核桃林地根际和非根际土壤微生物是否会因薄壳山核桃品种而异尚不明确。
因此,本研究选择‘Pawnee’‘Jinhua’‘Mahan’3个薄壳山核桃主栽品种人工林的根际土壤和非根际土壤作为研究对象,利用高通量测序技术对土壤细菌和真菌群落进行多样性和结构组成分析,为后期筛选有益微生物提供理论基础。
1 材料与方法
1.1 试验地概况与试验材料
本试验地选择在江苏省句容市后白镇张庙村的南京林业大学薄壳山核桃试验基地进行,地处丘陵地带,属于北亚热带中部季风气候,年均气温15.6℃,土壤为黄棕土,中性偏酸。该地年均日照时数2 157 h,年均降水量1 018.6 mm,年均无霜期229 d[24]。供试材料为试验基地7年生的3个主栽品种:‘Pawnee’‘Jinhua’‘Mahan’,平均树高7.03 m,胸径8.41 cm,冠幅4.06 m,种植期间管护措施如浇水、施肥等均保持一致。
1.2 试验设计与样品采集
试验采取单因素完全随机化设计,以根际土壤和非根际土壤为试验样本,各设置6个重复。为减少误差,采样遵循多点取样原则,每株树下选取东、西、南、北4个点,每3株树采取的土样混合为1个重复,采用Riley等[25]的抖落法收集根际土样,在远离根际5~10 cm范围内采集非根际土样。3个品种共随机选取54株生长一致的健康样树,获得18份根际土样及18份非根际土样。
2020年9月在上述试验林地内采集土壤样品:在距树干基部0.5 m半径范围,0~60 cm深度内,收集土壤中的细根(直径小于2 mm),首先抖落掉大块土样,再用小刷子采集粘附在细根周围0~5 mm的土壤作为根际土样,同时在远离根际5~10 cm的范围内采集不含根系的非根际土壤,3株树的根际及非根际土壤样品分别混合装进无菌袋作为1个重复。采集的土样放入装有干冰的泡沫箱并带回实验室,除去土样中的杂物后过2 mm筛,放入-80℃超低温冰箱保存备用。
1.3 高通量测序
采用美国FastDNA® Spin Kit for Soil试剂盒提取DNA,按照试剂盒说明书的操作步骤进行土壤微生物DNA的提取,分别使用1%琼脂糖凝胶电泳和NanoDrop2000分光光度计检测DNA质量(5 V/cm,20 min)、纯度及浓度。
DNA提取后以细菌通用引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')对16 S基因的V3~V4区域进行扩增,真菌通用引物ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2R(5'-GCTGCGTTCTTCATCGATGC-3')对ITS基因的ITS1区域进行扩增。16 S和ITS扩增分别使用TransStart Fastpfu DNA聚合酶、TaKaRa rTaq DNA聚合酶和20 µL反应体系。PCR扩增程序为:95℃预变性3 min,细菌及真菌循环数分别为27、35个,循环体系包括95℃变性30 s,55℃退火30 s,72℃延伸45 s;72℃延伸10 min后10℃停止保存。每个样本重复3次。
扩增结束后将PCR产物回收并经过纯化、检测、定量等步骤,使用Illumina Miseq技术测序平台(PE300)进行文库构建、测序,由上海美吉生物医药科技有限公司完成。
1.4 数据统计与分析
通过fastp(version 0.20.0)和FLASH(version 1.2.7)软件对测序的原始数据进行质控、过滤及拼接,最终得出有效的测序数据。
利用UPARSE软件(version 7.1)对大于97%相似度的序列进行OTU聚类及去除嵌合体的操作,通过RDP classifier(version 2.2)并设置置信度阈值0.7,分别比对Silva细菌数据库(Release 138)及Unite真菌数据库(Release 7.2),进行物种注释分析,得到不同分类水平下物种注释的细菌及真菌OTU数据,将样本最小数据量为标准进行均一化处理,后续分析均在抽平后的数据基础上进行。
用Mothur软件计算不同随机抽样下的Alpha多样性指数,包括Shannon、Simpson、Chao和Coverage指数,并绘制稀释曲线图,通过SPSS软件进行Alpha多样性指数的单因素方差分析,应用Turky检验进行多重比较。
用R语言软件及ANOSIM检验(vegan包)做NMDS分析并绘制门水平的群落组成丰度柱状图及科水平的群落热图,所有表格均用Microsoft Excel软件进行统计制作。
2 结果与分析
2.1 不同品种薄壳山核桃林地土壤微生物测序数据统计
3个品种土壤样本进行质控、过滤及拼接后的基本测序数据结果如表1~2所示。本次测序共得到细菌有效序列1 468 730条,平均长度分别约为1 545、2 496 bp,测序质量值Q30范围在92.24%~92.57%之间,Q20范围在97.45%~97.60%之间;真菌有效序列2 054 419条,测序质量值Q30范围在97.66%~98.62%之间,Q20范围在99.07%~99.30%之间,其中细菌根际样本和非根际样本分别经过最小样本序列数标准均一化处理后,分别共得到450 216、379 044条有效序列;真菌根际样本和非根际样本分别经过最小样本序列数标准均一化处理后,分别共得到720 252、651 996条有效序列。
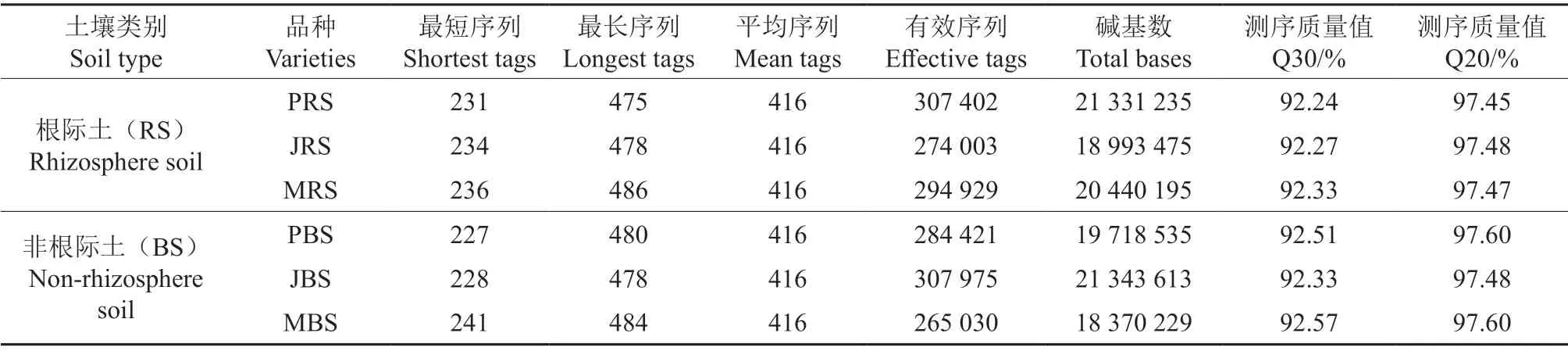
表1 细菌基本测序数据结果统计Table 1 Statistics of basic sequencing data of bacteria
对3个品种土壤样本进行稀释曲线分析,结果如图1所示。由图1可以看出,细菌(图1a—b)和真菌(图1c—d)的各样本稀释曲线在测序量到达一定深度后进入缓慢上升期,逐渐趋向于平坦,这表明均一化处理不会使数据有大量损失,测序深度足够覆盖到大多数微生物类群,增加测序量只会产生少量的新物种。另外,3个品种的土壤微生物覆盖度大小在0.94以上,高至0.99,说明了研究中测序量和测序深度的合理性。

表2 真菌基本测序数据结果统计Table 2 Statistics of basic sequencing data of fungi
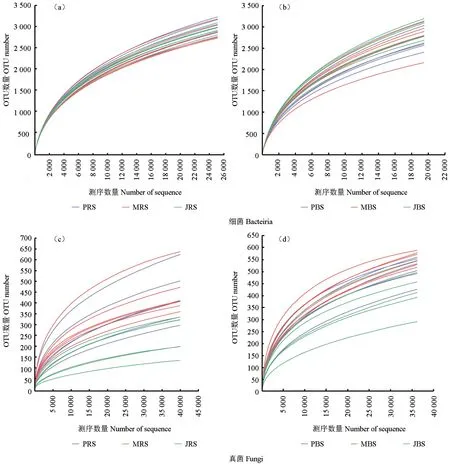
图1 根际土壤RS(a, c)和非根际土壤BS(b, d)细菌真菌稀释曲线Fig.1 Dilution curves of fungi and bacteria in the rhizosphere soil RS (a,c) and non-rhizosphere soil BS(b,d)
2.2 不同品种薄壳山核桃林地土壤微生物Alpha多样性指数分析
从多个多样性指数来看,3个品种的根际细菌多样性指数无显著差异,而在非根际土样中,‘Jinhua’的Shannon指数显著高于‘Pawnee’(表3)。由表4可知,在根际和非根际土壤真菌中,‘Jinhua’的α多样性显著低于‘Mahan’和‘Pawnee’。总体来说,薄壳山核桃‘Jinhua’品种的土壤细菌多样性高于其他两个品种,但土壤真菌多样性低于其他两个品种,尤其体现在根际土壤中。
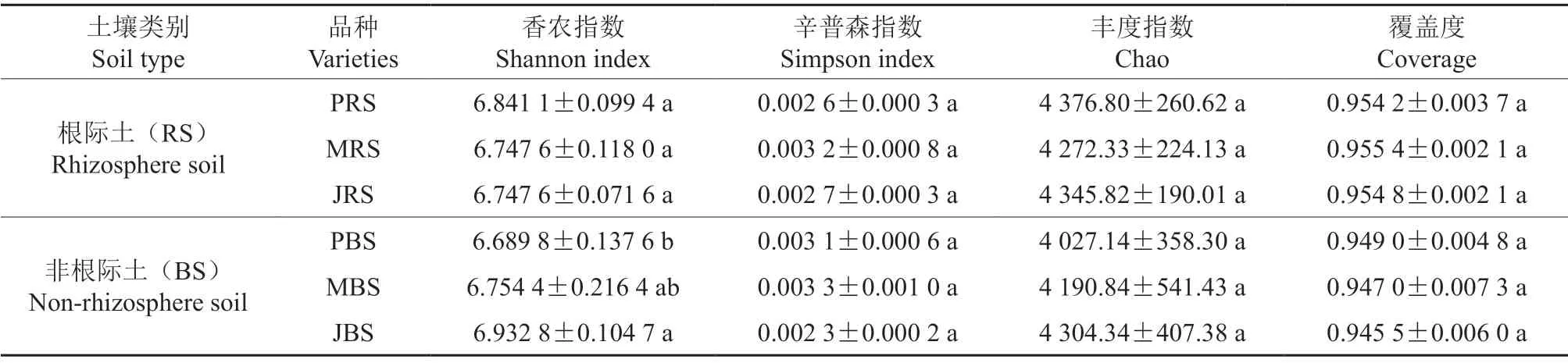
表3 细菌多样性指数分析†Table 3 Analysis of the bacterial diversity index

表4 真菌多样性指数分析†Table 4 Analysis of the fungi diversity index
2.3 不同品种薄壳山核桃林地土壤微生物群落结构分析
3个品种根际细菌群落结构存在显著差异(Stress=0.162,P=0.024),其中‘Pawnee’和‘Mahan’在OTU水平下的群落结构相似,而‘Jinhua’与其他两个品种有明显差异。在非根际土壤中,3个品种细菌的群落结构差异不显著(Stress=0.131,P=0.176)(图2a—b)。同样地,根际真菌存在品种间的显著差异(Stress=0.089,P=0.002),其中‘Pawnee’和‘Mahan’样本点相对聚集,而NMDS1轴将‘Jinhua’的样本点同‘Pawnee’和‘Mahan’较明显地分散开,表明‘Pawnee’和‘Mahan’的根际真菌在OUT水平上组成相似,却与‘Jinhua’有明显差异。而在非根际土壤中,不同品种真菌群落结构差异不显著(Stress=0.109,P=0.158)(图2c—d)。综上,在根际土壤中‘Jinhua’品种的薄壳山核桃土壤真菌及细菌的群落结构与其他两个品种间存在显著差异,而3个品种的薄壳山核桃非根际土壤微生物的群落结构相对相似。

图2 不同品种薄壳山核桃林地根际土壤(a, c)和非根际土壤(b, d)细菌真菌NMDS分析Fig.2 NMDS analysis of the rhizosphere soil (a, c) and non-rhizosphere soil (b, d) bacteria and fungi in different varieties of pecan plantations
2.4 不同品种薄壳山核桃林地土壤微生物群落组成分析
如图3所示,在细菌Venn图中(图3a—b),根际样本中细菌OTU数量表现为‘Pawnee’>‘Mahan’>‘Jinhua’,其中‘Pawnee’和‘Mahan’共有的OTU数量最高,为718个,占比4.05%,而非根际土样中细菌OTU数量则表现为‘Mahan’>‘Jinhua’>‘Pawnee’,以‘Mahan’和‘Jinhua’共有OTU数量较高,为708个,占比3.98%。在真菌Venn图中(图3c—d),无论是根际土样还是非根际土样,3个品种的薄壳山核桃林地土壤真菌OTU数量均为‘Mahan’>‘Pawnee’>‘Jinhua’,其中以‘Pawnee’和‘Mahan’共有OTU数量最高,分别为297(占比9.86%)、284(占比7.31%)个。因此不同品种薄壳山核桃根际细菌及真菌在OUT水平上的表现与‘Pawnee’和‘Mahan’的群落组成更为相似。
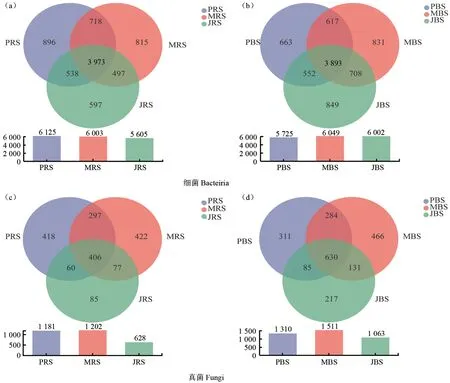
图3 不同品种薄壳山核桃林地根际土壤(a, c)和非根际土壤(b, d)细菌真菌Venn图Fig.3 Venn diagrams of the rhizosphere soil (a, c) and non-rhizosphere soil (b, d) bacteria and fungi in different varieties of pecan plantations
3个品种薄壳山核桃林地根际样本共检测出39个门类细菌及14个门类真菌,非根际样本共检测出40个门类细菌及13个门类真菌。其中3个薄壳山核桃品种根际和非根际的土壤细菌优势门类主要由放线菌门Actinobacteriota、变形菌门Proteobacteria、酸杆菌门Acidobacteriota、绿弯菌门Chloroflexi组成,合计占比在80%以上,其中放线菌门Actinobacteria丰度最高,占比28%以上(图4a—b)。3个品种薄壳山核桃根际和非根际的土壤真菌优势门类主要是子囊菌门Ascomycota、担子菌门Basidiomycota及被孢霉菌门Mortierellomycota,合计占比99%以上,其中担子菌门在‘Mahan’根际土壤和非根际土壤中丰度占比分别为45.60%和49.26%,均明显高于‘Pawnee’和‘Jinhua’(图4c—d)。综上,表明3个品种薄壳山核桃土壤细菌和真菌在门水平群落物种上组成相似,但在相对丰度上略有不同。
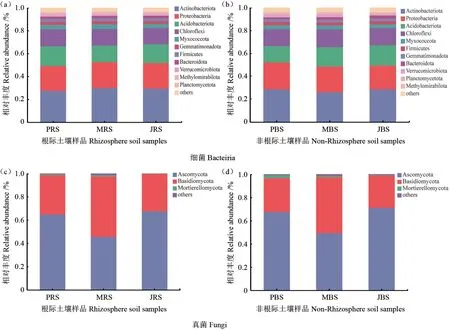
图4 不同品种薄壳山核桃林地根际土壤(a, c)和非根际土壤(b, d)细菌真菌门水平分布Fig.4 The phylum distribution of bacteria and fungi in the rhizosphere (a, c) and non-rhizosphere (b, d) soils of different varieties of pecan lands
3个品种薄壳山核桃林地根际土壤和非根际土壤在科水平上的细菌及真菌群落热图和物种组成差异分析如图5~6所示。3个品种根际样本共检测出231个科类真菌及527个科类细菌,非根际样本共检测出254个科类真菌及523个科类细菌。norank_o__Gaiellales、黄色杆菌科在3个品种薄壳山核桃林地根际土壤和非根际土壤中丰度都比较高,是薄壳山核桃林地土壤优势细菌类群(图5a—b)。物种组成分析结果表明,在根际土壤中norank_o__Gaiellales、黄色杆菌科在3个品种薄壳山核桃林地丰度无明显差异,在非根际土壤中的丰度‘Pawnee’明显高于‘Jinhua’和‘Mahan’,而小单孢菌科Micromonosporaceae的相对丰度表现为‘Jinhua’明显高于‘Pawnee’和‘Mahan’(图6b)。革菌科、盘菌科在3个品种薄壳山核桃林地根际土壤和非根际土壤中丰度都比较高,是薄壳山核桃林地土壤优势真菌类群(图5c—d)。物种组成分析结果表明,在根际土壤中盘菌科的相对丰度表现为‘Jinhua’明显高于‘Pawnee’和‘Mahan’,火丝菌科Pyronemataceae的相对丰度表现为‘Pawnee’明显高于‘Jinhua’和‘Mahan’,层腹菌科Hymenogastraceae、丛赤壳科Nectriaceae、毛壳科Chaetomiaceae、曲霉科Aspergillaceae的相对丰度表现为‘Mahan’明显高于‘Pawnee’和‘Jinhua’(图6c)。在非根际土壤中,丝盖伞科Inocybaceae和毛壳科Chaetomiaceae的相对丰度表现为‘Pawnee’明显高于‘Mahan’和‘Jinhua’(图6d)。
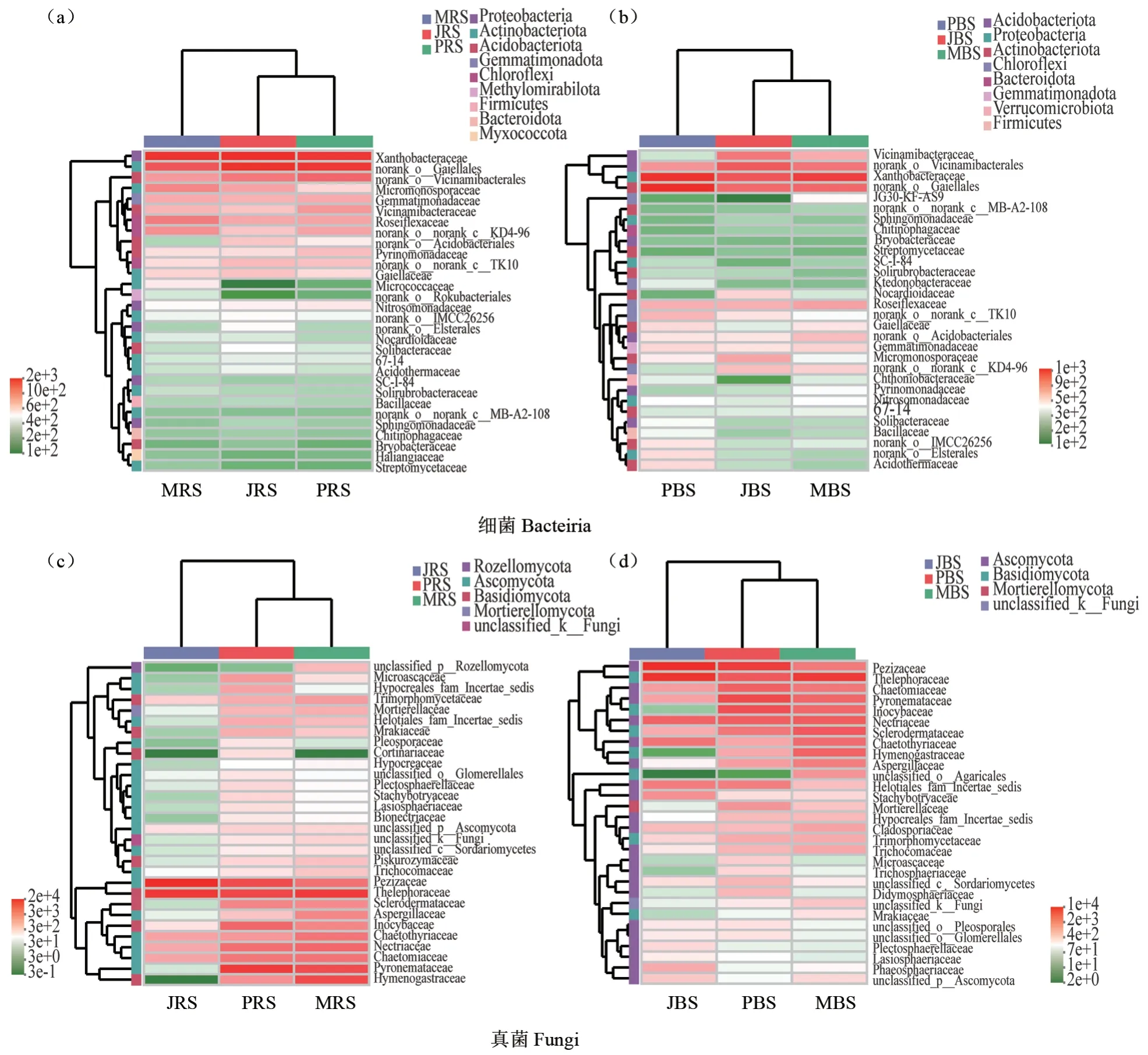
图5 不同品种薄壳山核桃根际土壤(a, c)和非根际土壤(b, d)细菌真菌科水平聚类热图Fig.5 The heatmap of bacteria and fungi in the rhizosphere soil(a, c) and non-rhizosphere soil(b, d) at the family level among different pecan varieties
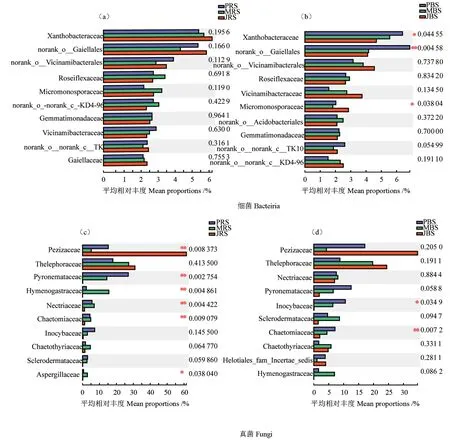
图6 不同品种薄壳山核桃林地根际土壤(a, c)和非根际土壤(b, d)细菌真菌科水平物种组成差异分析Fig.6 Analysis of species composition of bacteria and fungi in the rhizosphere soil (a, c) and non-rhizosphere soil (b, d) of different pecan varieties
3 讨 论
土壤微生物作为土壤中的分解者,通过对营养元素运输、养分的供应及调节,影响植物体的物质循环和能量运输,同时其多样性能反映出自身群落的稳定性、土壤健康和土壤肥力等,在植物生长发育过程中具有重要意义。有研究表明,在相似的生长环境条件下,植物品种的不同,也会使其土壤微生物多样性和群落结构存在差异[26]。本研究中不同品种薄壳山核桃林地土壤细菌多样性情况以‘Jinhua’高于‘Pawnee’和‘Mahan’,真菌多样性情况则以‘Jinhua’低于‘Pawnee’和‘Mahan’,推测这可能与不同品种的生长性状差异、根际分泌物组成及微生物活动习性有关。‘Jinhua’土壤细菌多样性较高的情况可能是其土壤细菌组成受根系分泌物影响,招募了更多的物种[27]。真菌的活动与土壤凋落物分解密切相关[28],有研究表明‘Mahan’和‘Pawnee’都属于品质优良薄壳山核桃品种,具有较强的生存适应能力,而‘Jinhua’较前者在生长适应性上较差,因此‘Mahan’和‘Pawnee’较高的生长势及叶片凋落物数量[29-30]使得其土壤真菌活动更强[31],所以多样性高于‘Jinhua’。不同品种植物的根系分泌物会影响土壤微生物群落结构,主要因为根系分泌释放的有机物种类和含量不同使土壤微生物的活性与生态位发生改变[32]。另外,本研究表明不同品种的薄壳山核桃根际土壤细菌和真菌群落结构存在显著差异,其中以‘Mahan’和‘Pawnee’群落结构组成更为相似,推测是因为‘Mahan’和‘Pawnee’均为国外引进品种,其亲缘关系较近[33],可能两者存在根系分泌物组成上的相似,使得招募的根际土壤微生物较为接近,从而有异于国内品种‘Jinhua’。
土壤细菌在分布和数量占有明显优势,是土壤微生物中最具生命力的部分,对调节陆地碳动态、养分循环和植物生产力等过程具有重要意义[34-35]。在本研究中,3个品种薄壳山核桃根际土壤和非根际土壤细菌主要由放线菌门、变形菌门、酸杆菌门及绿弯菌门组成,以放线菌门和变形菌门为主要优势菌门。研究表明放线菌门和变形菌门都是植物土壤中常见的优势细菌群[36],其中放线菌门在土壤中多数为腐生菌,其有益菌群有许多重要的功能,包括分解土壤中的各种有机物和腐殖质,并且能产生多种抗生素[37-38]。变形菌门中的多数菌具有固氮作用,有效促进土壤的氮循环[39]。在科水平上,薄壳山核桃根际土壤和非根际土壤优势细菌为norank_o__Gaiellales和黄色杆菌科,其在非根际土壤中的相对丰度表现为‘Pawnee’明显高于‘Jinhua’和‘Mahan’,有研究表明norank_o__Gaiellales在抑制性土壤中含量较高,推测其可能对薄壳山核桃土壤病原菌具有抑制作用,而黄色杆菌科具有固氮作用[40],对促进薄壳山核桃的生长具有重要意义。另外,盘菌科[41]和黄色杆菌科[42]均是能够在酸性土壤中繁殖生长的物种,因此两类物种在薄壳山核桃土壤中较高的丰度反映了特定的土壤环境会吸引具有偏好特性的微生物聚集。
土壤真菌是土壤微生物的重要组成部分,在养分循环等方面亦发挥重要作用[43]。在本研究中,3个品种薄壳山核桃林地根际土壤和非根际土壤真菌主要由子囊菌门、担子菌门及被孢霉菌门组成,以子囊菌门和担子菌门为主要优势菌门。其中担子菌门的相对丰度在‘Mahan’根际土壤和非根际土壤中明显高于‘Pawnee’和‘Jinhua’。研究表明子囊菌门和担子菌门参与分解枯枝落叶,对植物营养循环有重要作用[44-45]。本研究中薄壳山核桃土壤优势真菌为盘菌科和革菌科,而有研究表明盘菌科和革菌科均可参与形成薄壳山核桃的外生菌根[46]。外生菌根菌能够改善土壤结构,有利于土壤微生物结构的稳定,能促进植物生长,因此这些真菌在土壤中的聚集有利于薄壳山核桃与微生物建立互利共生的生态关系,形成健康土壤-微生物-植物互作体系[47]。
本研究仅探讨了不同品种薄壳山核桃盛果期林地土壤微生物的多样性和群落组成,考虑到林木生长期、林龄和土壤类型等因素可能对薄壳山核桃人工林土壤微生物群落结构有一定的影响,后续将开展相关研究。此外,可以在本研究的基础上通过人工培养手段筛选薄壳山核桃促生菌,为研发薄壳山核桃生物菌肥提供理论基础和依据。
4 结 论
薄壳山核桃‘Jinhua’品种的根际土壤和非根际土壤真菌群落多样性显著低于‘Pawnee’和‘Mahan’;相较于真菌群落,细菌群落的多样性在品种间差异不显著,且‘Jinhua’的细菌真菌群落结构与其他两个品种明显不同。薄壳山核桃根际土壤和非根际土壤真菌主要由子囊菌门、担子菌门及被孢霉菌门等组成,其中担子菌门的相对丰度在‘Mahan’根际土壤和非根际土壤中明显高于‘Pawnee’和‘Jinhua’;细菌主要由放线菌门、变形菌门、酸杆菌门、绿弯菌门等组成。科水平上,根际土壤和非根际土壤优势细菌norank_o_Gaiellales和黄色杆菌科的相对丰度在‘Pawnee’的非根际土壤中明显高于‘Jinhua’和‘Mahan’,土壤优势真菌盘菌科的相对丰度在‘Jinhua’根际土壤中明显高于‘Pawnee’和‘Mahan’。其中细菌优势菌群多数参与养分循环。一些菌群如黄色杆菌科具有固氮作用,可促进土壤氮循环,具体功能还需进一步的研究。真菌优势菌群多数可以分解枯枝落叶、纤维素、木质素等有机物,促进碳循环,部分真菌也可参与形成薄壳山核桃的外生菌根菌。

