皮肤黑色素瘤基因突变类型及基因拷贝数变异分析
张强 杜俊炜 杨文鹏 江仁兵
恶性黑色素瘤(malignant melanoma,MM)是一种具有高度侵袭性、高转移性、预后非常差的皮肤恶性肿瘤[1],其发病率在全球各个地区均呈持续增长的趋势[2]。据统计,美国每年约7 万人被确诊为黑色素瘤,每年因黑色素瘤死亡的人数约9 千人[3]。尽管中国黑色素瘤的发病率低于欧美等西方国家,但依旧不容忽视,每年新增黑色素瘤患者约2 万例[4]。根据其解剖部位可分为肢端黑色素瘤(acral melanoma,AM)和非肢端黑色素瘤(non-acral melanoma,NAM)[5]。AM 是指发生在非多毛的肢端皮肤(包括掌侧、指间、甲床),通常认为AM 与慢性紫外线损伤无关[6]。在以白种人为主的高加索人种中,AM 约占皮肤黑色素瘤病例的10%[7]。然而,在以黄种人为主的亚洲人群中,AM 约占皮肤黑色素瘤病例的50%~70%[8]。虽然国内对黑色素瘤基因组的研究已取得很大进展,但大多数研究主要围绕常见的热点突变基因BRAF、NRAS 等[9-10]。此外,国内对AM 和NAM 基因突变类型和基因拷贝数变异(copy number variation,CNV)的研究较少,且基因突变类型与临床病理特征之间的关系也尚不清楚。鉴于黑色素瘤基因突变类型及CNV 的研究对于中国人群的治疗策略至关重要,本研究的目标是分析并讨论AM 和NAM 的临床病理特点、基因突变类型及CNV的差异。统计分析AM 与NAM 患者的影响细胞周期畸变相关基因:细胞周期蛋白依赖性激酶4/6 (cyclin-dependent kinases 4/6,CDK4/6),细胞周期素D1/2(recombinant cyclin D1/2,CCND1/2),细胞周期依赖性激酶抑制基因2A(cyclin-dependent kinase inhibitor 2A,CDKN2A);受体酪氨酸激酶相关基因:表皮生长因子受体(epidermal growth factor receptor,EGFR),肝细胞生长因子受体(hepatocyte growth factor receptor,MET),表皮生长因子受体2/3(epidermal growth factor receptor 2/3,ERBB2/3),血小板源性生长因子受体α 多肽(platelet-derived growth factor receptor alpha,PDGFRA);抗细胞凋亡相关基因:杆状病毒IAP 重复序列2/3/5(baculoviral IAP repeat-containing 2/3/5,BIRC2/3/5)的CNV 情况,旨在深入了解AM 和NAM 的致癌模式和临床病理特征。
1 材料与方法
1.1 临床资料
分析2018年1月至2021年1月在新疆医科大学附属肿瘤医院骨与软组织肿瘤及黑色素瘤科收治并行二代测序(next-generation sequencing,NGS)技术进行基因检测的73 例皮肤黑色素瘤患者资料。治疗方案经医院伦理委员会批准并经患者知情同意。纳入标准:经病理明确诊断为原发性皮肤黑色素瘤;采用NGS 进行基因检测者;临床病理资料及随访资料完整可靠。排除标准:继发转移的皮肤黑色素瘤患者;未进行NGS 基因检测者;随访资料不完整者;合并其他恶性肿瘤或严重疾病者。
1.2 方法
回顾性收集73 例皮肤恶性黑色素瘤患者的性别、年龄、肿瘤部位、肿瘤厚度、肿瘤有无溃疡、肿瘤分期、前哨淋巴结状态等临床病理资料。为了全面地描述黑色素瘤的基因突变情况,采用了NGS 技术,涵盖了黑色素瘤相关的46 个基因,包含12 个基因的热点突变及34 个基因的拷贝数变异。根据黑色素瘤的解剖部位分为肢端组(AMs)和非肢端组(NAMs),对比两组患者的临床病理特征、基因突变类型及CNV 的差异。73 例患者均由同一名高年资医师行手术切除,术后经本院病理科明确诊断为原发性皮肤黑色素瘤。
1.3 统计学分析
采用SPSS 22.0 软件进行统计学分析。计数资料以率(%)表示,采用χ2检验及Fisher's 确切概率法进行统计学分析。以P<0.05 为差异具有统计学意义。
2 结果
2.1 两组患者的基本信息
NAMs 中男性17 例,女性18 例;AMs 中男性18 例,女性20 例。NAMs年龄29~81 岁,平均年龄(55.03±13.68)岁;AMs年龄26~82 岁,平均年龄(51.89±15.37)岁。NAMs 肿瘤厚度0.40~5.20 mm,平均厚度(2.66±1.59)mm,中位厚度2.30 mm;AMs 肿瘤厚度0.30~5.30 mm,平均厚度(2.70±1.63)mm,中位厚度2.45mm。NAMs 肿瘤表面伴有溃疡21 例,肿瘤表面不伴有溃疡14 例;AMs 肿瘤表面伴有溃疡17 例,肿瘤表面不伴有溃疡21 例。NAMs 肿瘤原发解剖部位分别为躯干9 例、头/颈部4 例、四肢22 例。NAMs 前哨淋巴结阳性有7 例,阴性28 例;AMs 前哨淋巴结阳性有9 例,阴性有29 例。NAMs 肿瘤分期:Ⅰ期有8 例,Ⅱ期有15 例,Ⅲ期有10 例,Ⅳ期2 例;AMs 肿瘤分期:Ⅰ期有9 例,Ⅱ期有14 例,Ⅲ期有12 例,Ⅳ期3 例。两组患者的性别、年龄、溃疡、肿瘤厚度、前哨淋巴结状态、AJCC 肿瘤分期均无统计学意义(P>0.05,表1)。
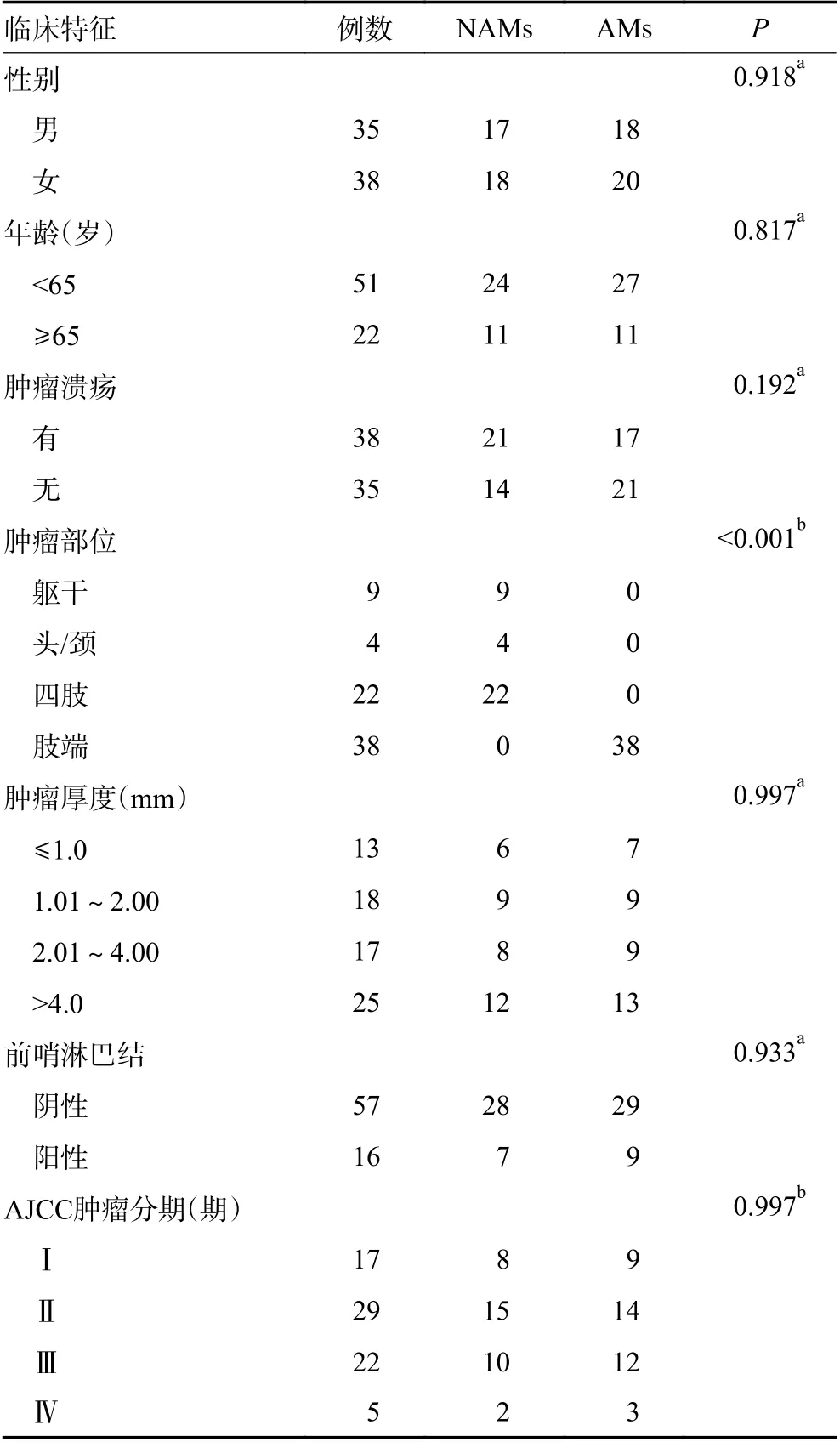
表1 两组患者的基本临床病理特征
2.2 AMs 和NAMs 的基因突变情况
本研究中最常见的基因组亚型为野生型(wild type,WT) (44.9%),其次是BRAF 突变(20.5%)、NRAS/KRAS 突变(17.8%)、KIT 突变(13.7%),其余罕见的突变类型约占3.1%。在BRAF 突变病例中,86.7%(13/15)为V600E 突变,2 例为非V600E 突变。BRAF 突变肿瘤部位最常见于四肢,约53.3%(8/15);其次是肢端,约26.7%(4/15)。在以65 岁为界限进行分组时发现,两组患者之间BRAF 突变有显著性差异(P=0.029)。此外,在以肿瘤是否伴有溃疡进行分组时,伴有溃疡与无溃疡两组患者之间BRAF 突变具有显著性差异(P=0.027)(表2)。NRAS 和KRAS 基因突变约53.8%(7/13)位于第3 外显子、约30.8%(4/13)位于第2 外显子、约15.4%(2/13)位于外显子4。10例KIT 突变中,7 例位于第11 外显子(包括V560D、D572G 和L576P 突变),3 例位于第13/14/17 外显子(包括K642E、D820Y、N822K 突变)。45 例BRAF/KRAS/NRAS 野生型中发现9 例存在KIT 基因突变;28 例存在BRAF/KRAS/NRAS 突变中仅1 例合并KIT 基因突变;KIT 基因在BRAF/KRAS/NRAS 野生型中的突变频率显著高于突变型(P=0.043)。在NAMs 中最常见的突变类型为BRAF 突变,BRAF 突变率约为31.4%(11/35)、KIT 突变率约为11.4%(4/35)、KRAS/NRAS 突变率约为11.4%(4/35)。AMs 中最常见的突变类型为KRAS/NRAS 突变,KRAS/NRAS突变率约为23.7%(9/38)、KIT 突变率约为15.8%(6/38)、BRAF 突变率约为10.5%(4/38)。AMs 和NAMs 两组患者之间BRAF 突变差异具有统计学差异(P=0.027)。AMs 和NAMs 两组患者之间KRAS/NRAS 突变差异并无统计学意义(P=0.172)。AMs和NAMs 两组患者之间KIT 突变差异并无统计学意义(P=0.738)。
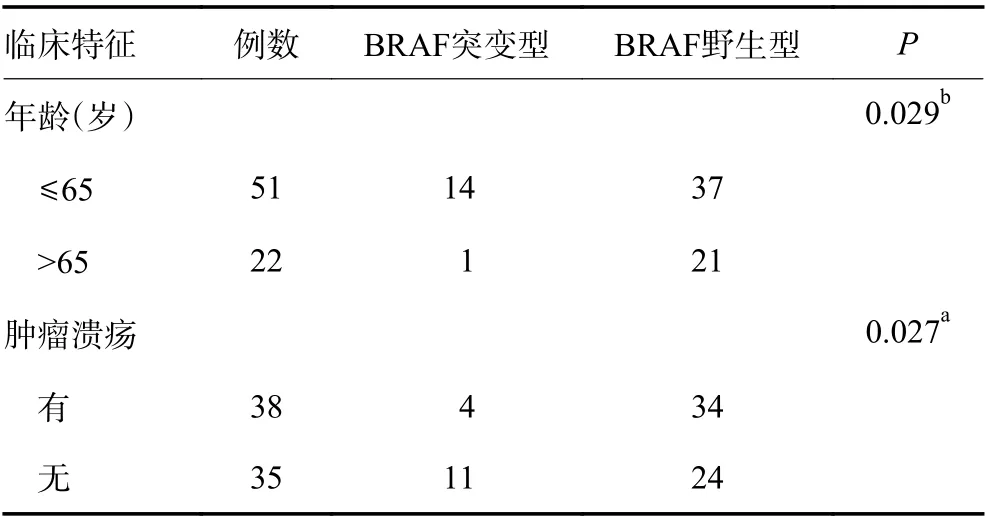
表2 BRAF 突变与年龄及肿瘤溃疡之间的相关性
2.3 AMs 和NAMs 的基因拷贝数变异情况
AMs 中基因拷贝数增多的高频基因分别是CCND1,约39.5%(15/38);其次是CDK4,约28.9%(11/38);BIRC5,约26.3%(10/38)。AMs 中基因拷贝数缺失的高频基因分别是CDKN2A,约18.4%(7/38);其次是PTEN,约13.2%(5/38)。NAMs 中基因拷贝数增多的高频基因为CCND1,约14.3%(5/35)、其次是CDK4,约8.6%(3/35);BIRC5 约8.6%(3/35)。NAMs 中基因拷贝数缺失的高频基因为PTEN,约11.4%(4/35);其次是CDKN2A,约5.7%(2/35)。将CNV 按基因组区域近一步分为3 个亚组,包括:影响细胞周期畸变相关基因(CDK4/6、CCND1/2 和CDKN2A);影响受体酪氨酸激酶相关基因(EGFR、MET、ERBB2、ERBB3、PDGFRA);抗细胞凋亡相关基因(BIRC2/3/5)。本研究结果显示,AMs 中影响细胞周期畸变相关基因(CDK4/6 、CCND1/2 和CDKN2A)、影响受体酪氨酸激酶相关基因(EGFR、MET、ERBB2、ERBB3、PDGFRA)和抗细胞凋亡相关基因(BIRC2/3/5)的CNV 均高于NAMs,差异具有统计学意义(P=0.019,0.002,0.027) (表3)。
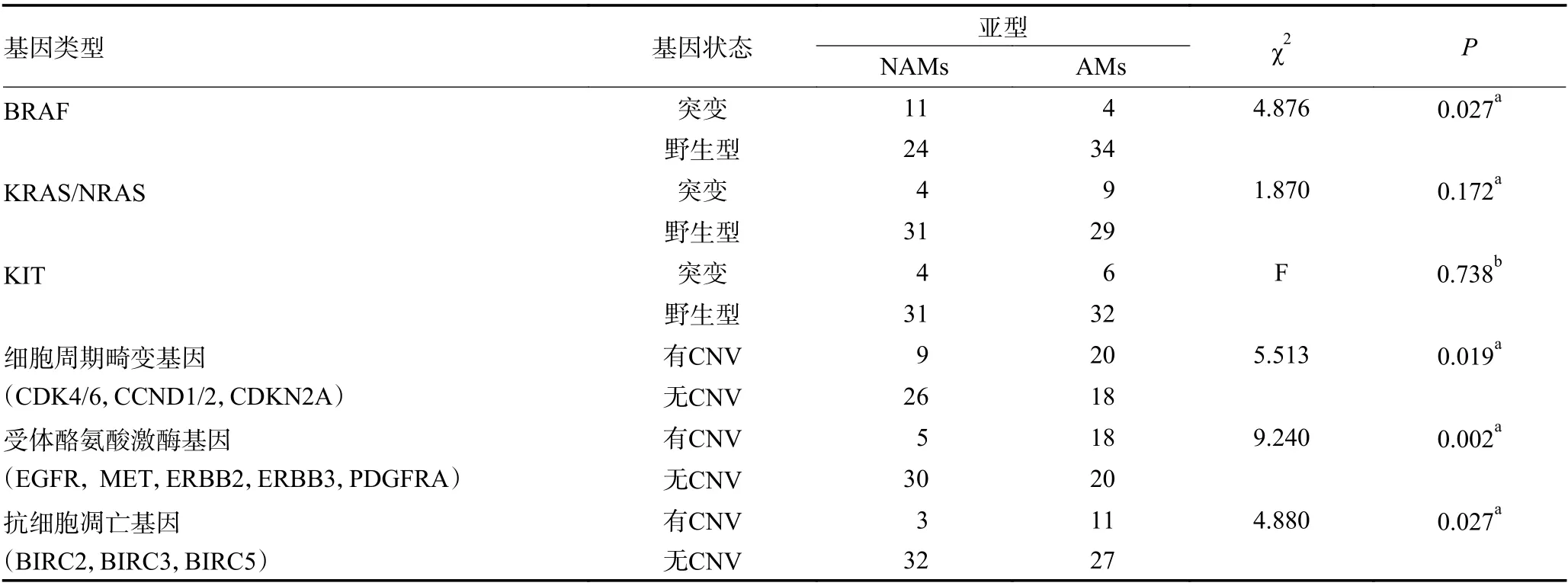
表3 AM 与NAM 患者基因突变及CNV 情况
2.4 AMs 患者的组内比较
根据解剖部位将AM 进一步细分为掌侧黑色素瘤、指间黑色素瘤、甲下黑色素瘤。38 例肢端黑色素瘤患者中13 例为手足掌侧黑色素瘤,11 例为甲下黑色素瘤,14 例为指间黑色素瘤。进一步比较了掌侧黑色素瘤、指间黑色素瘤和甲下黑色素瘤的基因突变类型。其中BRAF 基因突变仅出现在掌侧黑色素瘤,且突变均为V600E。指间黑色素瘤中KRAS/NRAS 突变约占1/3,而甲下均未发现BRAF/KRAS/NRAS 突变。掌侧和指间黑色素瘤的BRAF/KRAS/NRAS 突变显著高于甲下黑色素瘤(P=0.038)。此外,在2 例甲下、1 例指间和3 例掌侧黑色素瘤中发现了KIT 突变。38.5%(5/13)掌侧、72.7%(8/11)甲床和78.6%(11/14)的指间黑色素瘤中发现了CNV 事件,但并无统计学差异(P>0.05)。
3 讨论
随着国内学者对黑色素瘤研究的深入,对MM 的基因检测现已成为必不可少的常规操作[11]。目前已有研究报道,黑色素瘤驱动基因突变在不同黑色素瘤亚型之间具有显著性差异[12]。本研究73 例患者中最常见的基因亚型为野生型(WT) (44.9%),其次是BRAF突变(20.5%)、NRAS/KRAS 突变(17.8%)、KIT 突变(13.7%),其余罕见的突变类型约占3.1%。虽然在TCGA 黑色素瘤队列中,BRAF 亚型为最常见的基因组亚型[13],但在本研究中,最常见的是WT 亚型。
在本研究中BRAF 突变是NAMs 中最常见的突变类型,在35 例NAMs 中有11 例检测到BRAF 基因突变,突变率约为31.4%,其中9 例为V600E 突变,2 例为非V600E 突变。在AMs 中,NRAS/KRAS 突变是最常见的突变类型,在38 例AMs 中有9 例检测到NRAS/KRAS 突变,突变率约为23.7%。这也许能解释大量的肢端黑色素瘤患者并不能从BRAF 抑制剂中获益[14]。此外,在以65 岁为界限进行年龄分组时,发现65 岁以上的患者仅1 例检测到BRAF 基因突变,65 岁以下患者有14 例检测到BRAF 基因突变,其差异具有统计学意义(P=0.029)。这与之前的研究结果一致,BRAF 基因突变可能更易发生在年轻患者中[15-16]。在以肿瘤是否伴有溃疡进行分组时发现,不伴有溃疡的35 例患者中有11 例检测到BRAF 突变,伴有溃疡的38 例患者中仅4 例检测到BRAF 突变,两者的差异具有统计学意义(P=0.027),这也许意味着不伴有溃疡的黑色素瘤比伴有溃疡的黑色素瘤更易出现BRAF 突变。本研究发现NRAS/KRAS 是AMs中最常见的突变类型,在38 例AMs 中9 例检测到NRAS/KRAS 突变,突变率约为23.7%,但在AM 和NAM 之间NRAS/KRAS 突变的差异并无统计学意义(P=0.172)。
本研究73 例患者中检测到10 例具有KIT 基因突变,突变率约为13.7%,与之前的研究报道(13%)基本一致[17]。KIT 基因在BRAF/KRAS/NRAS 野生型和突变型之间突变频率的差异具有统计学意义(P=0.043)。与此前关于亚洲黑色素瘤研究的报道相比,本研究AM 中BRAF 突变频率低于先前的报道[18];KRAS/NRAS 突变率与先前的研究相似[19]。除了潜在的地区种族因素外,这些差异可能是由于本研究中的AMs 大多为雀斑型黑色素瘤,结节状和浅表扩散型在AM 队列中很少见。
CNV 是由基因组发生重排而导致的,一般指长度为1 kb 以上的基因组大片段的拷贝数增加或者减少,主要表现为亚显微水平的缺失和重复,CNV 是基因组结构变异(structural variation,SV)的重要组成部分。本研究中AMs 的CNV 发生频率显著高于NAMs,这可能是在临床治疗中AMs 预后较差的原因之一。细胞周期畸变是黑色素瘤发生和发展过程中的常见事件[20],本研究表明,影响细胞周期畸变的CNV 事件在AMs 中更常见。在35 例NAMs 中检测到9 例细胞周期畸变相关基因(CDK4/6、CCND1/2、CDKN2A)的CNV 事件,38 例AMs 中检测到20 例细胞周期畸变相关基因(CDK4/6、CCND1/2、CDKN2A)的CNV事件,差异具有统计学意义(P>0.05)。此外,有文献指出细胞周期畸变与恶性黑色素瘤患者的不良预后显著相关。因此,这或许能为应用细胞周期抑制剂靶向治疗AM 患者提供证据。
受体酪氨酸激酶(receptor protein tyrosine kinase,RTK)途径被确定为黑色素瘤发展的驱动因素之一[21]。本研究数据表明,在38 例AMs 中,有18 例患者的CNV 事件与RTK 相关(EGFR、MET、ERBB2、ERBB3、PDGFRA);而在NAMs 中仅检测到5 例,差异具有统计学意义(P=0.002)。本研究的结果证实了AMs 中RTK 改变的异质性,这也许能为治疗AMs 提供一个合理的假设,即具有识别特殊组合的酪氨酸激酶抑制剂,或许能为AMs 患者提供一个新的治疗方案[21]。
抗凋亡分子可以保护黑色素瘤细胞免于凋亡,从而增强其侵袭性。BIRC2/3/5 基因编码细胞凋亡抑制蛋白1/2[22]。在本结果中,BIRC5 的基因拷贝数增加在AMs 和NAMs 中均被检测到,但BIRC2/3 的拷贝数增加仅在AMs 中检测到。在35 例NAMs 中仅检测到3 例具有BIRC5 的拷贝数增加;而在AMs 中检测到11 例具有BIRC2/3/5 的拷贝数增加,AMs 与NAMs 的BIRC2/3/5 拷贝数变异频率具有统计学差异(P=0.027)。因此,检测BIRC2/3/5 基因表达可作为原发AM 新的预后指标。
掌侧、指间和甲床黑色素瘤之间的基因组差异也有报道[23]。在本研究中,38 例AM 患者中13 例位于掌侧,11 例位于甲下,14 例位于指间。进一步比较掌侧、指间和甲床的基因突变频率。BRAF 基因突变仅出现在掌侧,且均为V600E 突变。指间中KRAS/NRAS 突变约占1/3,而甲下均未发现BRAF/KRAS/NRAS 突变。在之前的报道中,掌侧黑色素瘤约11%存在CNV[23],但在本文研究中,掌侧部位的黑色素瘤约有38.5%(5/13)检测到至少存在一种CNV 事件,有报道在AMs 中CNV 发生的频率高达75%[24]。同时,在本研究结果中,掌侧、甲下、指间黑色素瘤的CNV 事件并无显著差异。
综上所述,本研究存在一定局限性,首先,未分析来自匹配正常组织的任何基因组,考虑到这是一项回顾性研究,未收集成对的正常组织进行NGS 测定。因此,不能区分其突变是否来自生殖系或体细胞组织。此外,分析中只包括致病性或可能致病性突变,不包括意义未知的突变,亟需更大样本进一步验证。

