SOX2蛋白及趋化相关基因CCR1、CCR2、MCP-1影响骨髓瘤细胞生物学特性的分子机制
刘晓 李颖 李英华
(哈励逊国际和平医院血液科,河北 衡水 053000)
骨髓瘤是一种B淋巴细胞的恶性肿瘤,主要是在骨髓中的恶性增殖,临床主要表现为骨疼、缺铁性贫血、肾衰竭等〔1〕。骨髓瘤细胞(MC)的生长与增殖受骨髓微环境的影响较大,骨髓中细胞与细胞、细胞外基质与细胞、蛋白与可溶性调节因子如趋化因子、细胞因子和生长因子等均与骨髓内微环境有密切关系。性别决定区Y框蛋白(SOX)2是MC的一种转录因子,参与维持胚胎干细胞多功能性和包括MC形态发生的多种发育过程,决定着细胞分化的方向与速度〔2〕。评估手术切除Ⅰ期肺鳞状细胞癌(ACA)中SOX2表达的预后价值,证明SOX2可能与肺ACA预后不良有关〔3〕。单核细胞趋化蛋白(MCP)-1是趋化因子的一员,其同时使用CC类趋化因子受体(CCR)1和CCR2作为功能受体〔4~7〕。本研究探讨SOX2蛋白及趋化相关基因CCR1、CCR2、MCP-1影响MC生物学特性的分子机制。
1 资料和方法
1.1一般资料 筛选2019年2月至2020年3月送检的40例骨髓瘤标本。其中男22例,女18例,平均年龄为(62.61±5.62)岁。入组标准:①年龄:60~75岁;②经骨髓形态学确诊为多发性骨髓瘤;③临床资料完整;④患者的家属知情并且同意。排除伴先天性免疫性疾病者;获得内部评审委员会的批准。随机分为两组,对照(A)组,男8例,女12例,平均年龄(63.38±6.19)岁;试验(B)组男14例,女6例, 平均年龄(61.27±4.54)岁。两组一般资料比较无统计学差异(P>0.05),具有可比性。
1.2细胞培养 取两组患者骨髓5 ml,常规制备单个核细胞,将细胞置于含10%胎牛血清100 U/ml青霉素、100 U/ml链霉素和20 U/ml谷胺酞胺的RFMI1640培养液内,于37℃、5% CO2饱和湿度条件下培养。取对数生长期细胞用于试验。细胞培养基主要成分包括10%胎牛血清、50 μg/ml链霉素和2 mmol/L谷胺酞胺,并补充1%的青霉素,放置于37℃含有5% CO2的条件下培养。每组实验重复20次,A组:只添加培养液;B组:MC以慢病毒SOX2荧光素酶表达载体(rLV-hsox2-Z s-Green-Puro)转染。慢病毒转染实验步骤:①慢病毒转染前24 h,将细胞 以1×105/孔铺到24孔板中。使细胞在慢病毒转染时的数量为2×105/孔左右;②用含有6 μg/ml聚凝胺的2 ml新鲜培养基替换原培养基,加入适量病毒悬液,37℃孵育;③4 h后加入2 ml新鲜培养基,继续培养24 h,用新鲜培养基替换含有病毒的培养基。
1.3细胞存活试验 将MC在密度为103个/孔的96孔板中培养,在37℃下培养,然后进行MTT试验。转染5 d后,无菌MTT (20 ml,5 mg/ml)被添加到每个的96孔板,37℃孵化4 h。取150 ml的二甲基亚砜(DMSO)加入96孔板中,那么光密使用NanoDrop 2000分光光度计测量490 nm处的光密度(OD)值。在菌落形成试验中,将转染的细胞放置在6孔板上,密度为每孔200个细胞,培养2 w,每3 d更换一次培养基。菌落在4%多聚甲醛固定15 min后,用1%结晶紫显影20 min染色。
1.4细胞的增殖检测 制备细胞悬液,接种到96孔板中,37℃培养箱中培养,加入10 μl CCK8,培养2 h,测定450 nm吸光度。
1.5细胞的凋亡检测 将细胞浓度调整为1×106/孔/ml,用离心机于3 000 r/min离心10 min,弃去上清液。加人200 μl的结合冲液重悬细胞,用5 μl的膜联蛋白(Annexin)V-异硫氰酸荧光素(FIFC)避光室温25℃标记15 min,用5 μl的碘化丙啶(PI)溶液避光标记5 min,最后加人300 μl的结合缓冲液,流式细胞仪进行流式检测,并根据结果计算细胞凋亡率。
1.6RNA提取、逆转录和实时PCR定量 使用TRIzol试剂按照说明书从细胞中分离出总RNA,用Hairpin-itTMPCR定量试剂盒按照厂家说明书进行cDNA合成及后续实时定量PCR,内源对照为小核GAPDH。基因表达评估用TransScript第一链cDNA合成SuperMix进行总RNA的逆转录,使用TransStart Top Green qPCR SuperMix,按照制造商提供的协议进行实时定量PCR。该过程使用7500序列检测系统进行,使用分析软件计算miRNA和基因的表达水平。引物序列:上游引物:5′-CTCGCTTCGGCAGCACA-3′,下游5′-AACGCTTCACGAAT TTGCGT-3′;上游引物:5′-CGCTTCGGCAGCATTACT-3′,下游5′-GTCGAGATGGGATAC CCTT-3′;上游引物:5′-CTGACGTCGAGTGGGC-3′,下游5′-AGTCG-AGATGGGATAC CCTTA-3′;上游引物:5′-ACAG-TCGAGATGGGATAC CCTTACCATTACT-3′,下游5′-CT-GCTGACGTCGAGTGGGCAA-3′。
1.7SOX2蛋白表达水平 免疫印迹分析法对总蛋白进行分离和定量分析。将预冷的磷酸盐缓冲液(PBS)淋洗3次。然后加入裂解液对细胞〔RIPA:苯甲基磺酰氟(PMSF)=100∶1〕进行裂解,低温裂解30 min后,破碎细胞主要利用超声细胞粉碎仪,3 000 r/min离心10 min,离心所得上清液即总蛋白,-80℃保存,备用。用BCA法测定蛋白的浓度,以牛血清白蛋白为标准品绘制标准曲线。将上述提取得到的总蛋白跑十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜至聚偏氟乙烯(PVDF)膜并将所得膜封闭在5%脱脂奶粉液中,室温封存40 min。然后将SOX2的一抗和兔抗人SOX2多克隆抗体分别加入其中孵育过夜。加入兔抗钙黏蛋白多克隆抗体(1∶1 000)、兔抗波形蛋白多克隆抗体(1∶5 000)、兔抗Snai1多克隆抗体(1∶1 000 )、兔抗NT5E多克隆抗体(1∶500)、鼠抗β-actin单克隆抗体(1∶2 000),4℃水平过夜,加入二抗孵育2 h,用电化学发光(ECL)法显色。
1.8统计学分析 采用SPSS20.0统计软件进行独立样本t检验、χ2检验。
2 结 果
2.1细胞总数测定 与A组相比,B组细胞总数升高,差异有统计学意义(P<0.05)。见表1。
2.2细胞存活率 与A组相比,B组细胞存活率降低,差异有统计学意义(P<0.01)。见表1。
2.3细胞凋亡检测 与A组相比,B组细胞凋亡率升高,差异有统计学意义(P<0.001),见表1。
2.4SOX2蛋白表达 与A组相比,B组SOX2蛋白表达差异有统计学意义(P<0.05),见表1、图1。

表1 两组细胞总数、存活率、凋亡率、SOX2蛋白及CCR1、CCR2、MCP-1 mRNA相对表达量比较
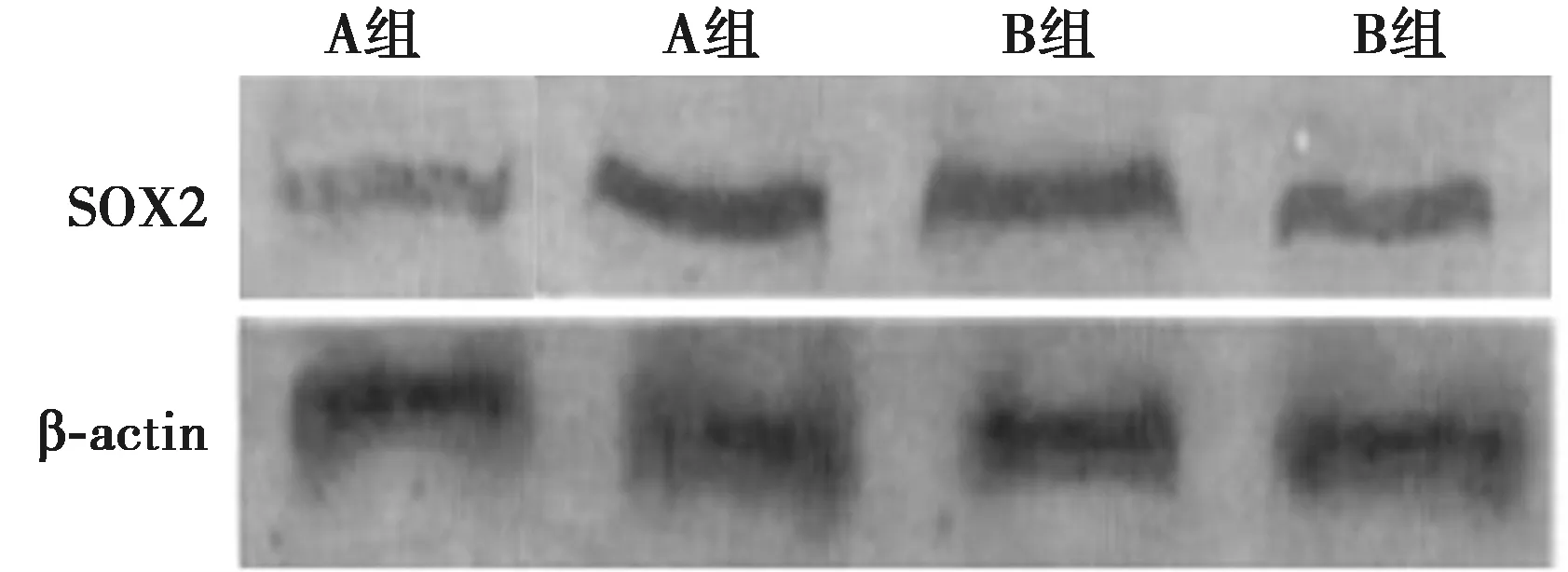
图1 两组SOX2蛋白表达水平
2.5CCR1、CCR2、MCP-1 mRNA表达 与A组相比,B组CCR1、CCR2、MCP-1 mRNA基因表达的上调,差异有统计学意义(P<0.05),见表1、图2。
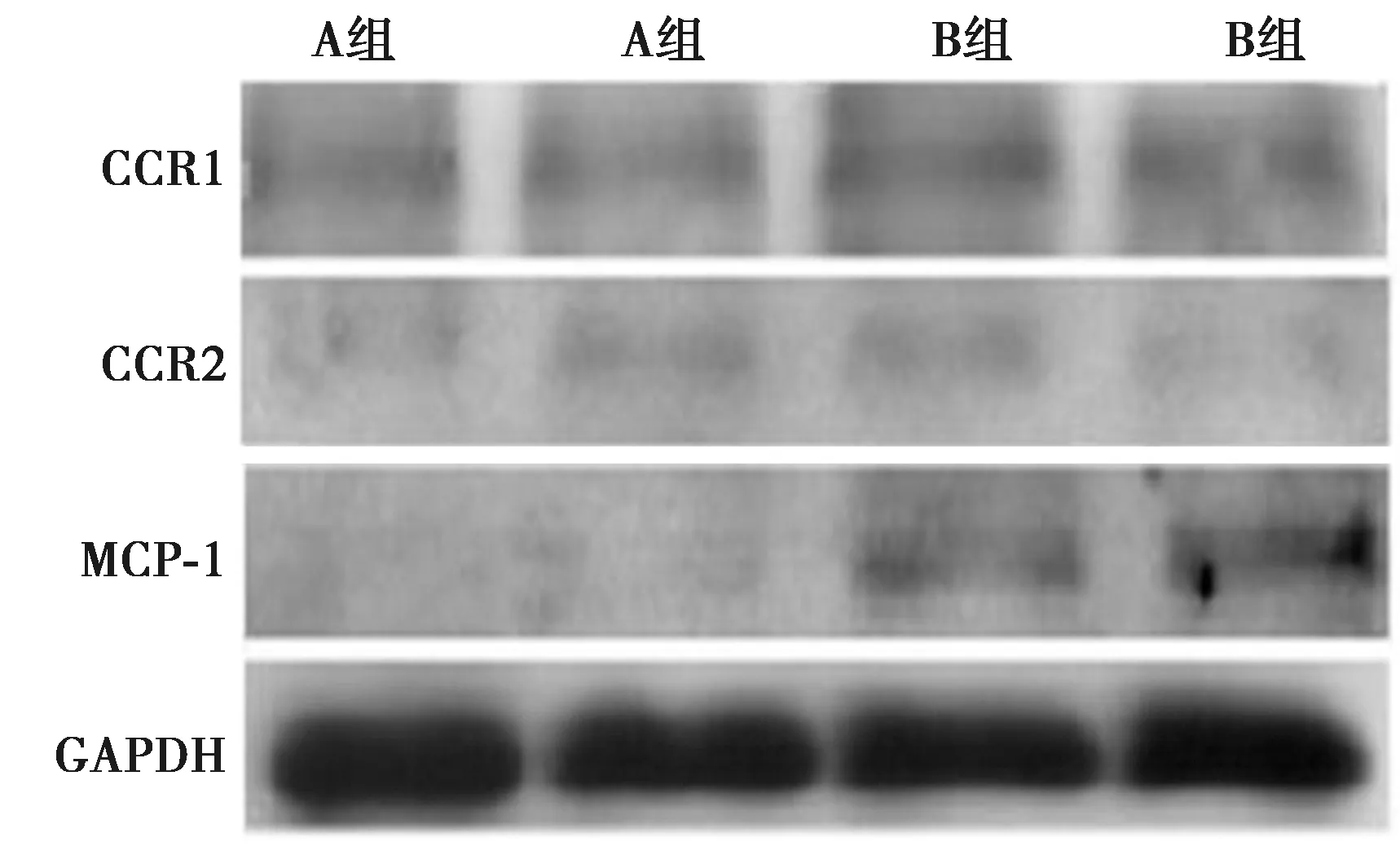
图2 两组CCR1、CCR2、MCP-1 mRNA的表达水平
3 讨 论
骨髓瘤患者通常以骨痛起病,溶骨性病变是典型的临床症状〔8〕,骨病变部位大多位于人体的中心骨架、颅骨及长骨,可引起剧烈的骨疼痛、病理性骨折及骨质疏松等〔9〕。MC在疾病进展的过程中,很少位于骨髓以外的组织和器官,其大部分时间内位于骨髓中〔10〕。MC细胞附近破骨细胞的增多及激活,成骨细胞的减少及活性抑制,都有可能导致溶骨增多或者成骨减少,从而诱发骨髓瘤病变〔11〕。MC毗邻处,溶骨性损害往往更显著,这可能与MC所处的骨髓微环境密切相关,微环境的改变常引起SOX2蛋白表达异常,但是SOX2蛋白在MC中表达尚未得到广泛研究〔12〕。
本研究结果说明SOX2蛋白在MC的产生和增殖过程中具有重要作用。研究表明〔13〕,在骨髓瘤的发生和发展中,骨髓微环境起着至关重要的作用。Eltoukhy等〔14〕研究表明癌症治疗结果预测算法包含了对“干细胞”通路的基因组分析通路,在包括肺癌在内的多种肿瘤类型的回顾性研究中显示出较高的预后准确性。MCP-1具有趋化作用,可激活多种炎性细胞,其对白细胞的作用谱与MCP-3相似,包括单核细胞、T淋巴细胞、自然杀伤(NK)细胞、嗜碱性细胞、肥大细胞和嗜酸性粒细胞,但与MCP-3不同,MCP-1对嗜酸性粒细胞无活性。Fu等〔15〕从白细胞研究中获得的证据表明MCP-2可能与这些C-C趋化因子共享受体,但MCP-2的实际功能受体尚未被确认。
由于细胞的趋化因子受体表达多样性和功能性质,主要由破骨细胞产生,在这些细胞上很难识别特定配体所使用的受体。大量的CCR1和CCR2趋化因子受体已被克隆,并在细胞上进行功能表达〔16~18〕。CCR1是MCP-3和MIP-1a/RANTES的受体,而CCR2主要由MCP-1和MCP-3共享。虽然CCR2已被报道无法直接对MCP-2产生作用,但相关结论是由于合成的MCP-2不能诱导转染HEK293细胞所含的钙作用,及MCP-2未能使MCP-1所诱导的钙通量脱敏〔19〕。而MCP-1具有在单核细胞诱导过程中的钙动员效果不佳的情况及单核细胞的趋化活动,使得MCP-1使用的信号通路不同于其他的碳趋化因子〔20〕。尽管如此,MCP-1亦可有效地使MCP-1-induced单核细胞的迁移过程减弱,并通过同源失活的过程以利用同一MCP-1受体。然而,在本次研究中,这显然不能通过本机建立细胞,而需使用转染的细胞以表达单一的趋化因子受体,亦是今后的研究方向。
综上,多发性骨髓瘤虽为浆细胞病,但MC与正常浆细胞的免疫表型不同。SOX2蛋白在细胞特定周期的高效表达可加速MC快速凋亡,且CCR1、CCR2和MCP-1基因通过在细胞中的过表达可调节MC的增殖,导致疾病及抗凋亡反应的发生。

