杠板归对猪源大肠杆菌氟苯尼考耐药基因floR表达量的影响
唐远江, 张 涛, 周思旋, 卢昱希, 杨茂生, 陶小艳, 赵 宇
(贵州省农业科学院畜牧兽医研究所,贵州贵阳 550005)
杠板归为蓼科蓼属植物杠板归(L.)全草,具有清热解毒、止咳作用,用于肺热咳嗽、水肿尿少、湿热泻痢等。杠板归的主要化合物是黄酮类、有机酸类、萜类等,但《中国药典(2020版)》规定该药材的主要检测物质为槲皮素。杠板归的煎煮剂、乙酸乙酯、正丁醇提取物对多种细菌具有较强的抑制作用,75%乙醇提取物具有广谱抑菌活性,其中对耐药性大肠杆菌的抑制作用明显。
氟苯尼考抑菌能力强、吸收快,常作为仔猪腹泻的预防保健药,但长期滥用使得耐药性日益严重,导致其药效不佳,对养殖业造成严重影响,对人类健康也有严重危害。严重的耐药现状及物理、化学方法消除细菌耐药性时对人类及动物的危害与日俱增,但中药能有效消除细菌的耐药性,同时这方面的研究能有效减少抗生素残留,利于生产绿色动物产品。
贵州杠板归药材资源丰富,前期研究表明杠板归59.92%乙醇提取物对耐药性大肠杆菌具有较强抑菌作用,因此,本研究对杠板归提取物耐药基因表达量的影响进行探讨,不仅可了解该基因畜牧养殖业中的耐药现状,还可为杠板归在中兽药的开发利用方面提供数据参考。
1 材料与方法
1.1 试验菌株
大肠杆菌耐氟苯尼考菌株DF2、BY22、GL26、HS40、GP46分别从大方、白云、关岭、惠水、高坡等猪场分离,大肠杆菌耐头孢类、大环内酯类和四环素类菌株,均由笔者所在实验室保存。
1.2 试剂和药品
LB培养基,批号100224;DNA Maker;细菌总DNA、RNA提取试剂盒;槲皮素标准品,批号110957-20180;氟苯尼考,批号73231-34-2;反转录试剂盒和荧光定量PCR试剂盒,均购自生工生物工程(上海)股份有限公司。杠板归59.92%乙醇提取物,由笔者所在项目组前期试验研制。
1.3 主要仪器
Eppendorf AG荧光定量PCR仪,Veriti快速梯度PCR仪,广州仪涛科技有限公司。
1.4 试验方法
1.4.1 药品对大肠杆菌最小抑菌浓度(MIC)的测定 本试验于2020年11月至2021年6月在贵州省畜牧兽医研究所实验室完成。试验时利用LB培养基将培养24 h菌液稀释500~1 000倍,将菌液浊度调节至0.5麦氏单位,药品倍比稀释成9个梯度,接种稀释后的菌液1 mL至药液(阴性对照)、菌液(阳性对照)、肉汤(空白对照)和试验组,摇匀后在37 ℃下培养16~18 h。每个药物作双样品测定,每组试验中没有细菌生长的药物浓度为MIC。
1.4.2 氟苯尼考对亚抑菌浓度药物处理后大肠杆菌MIC值的测定 将耐药大肠杆菌培养过夜,将1%菌液接种于LB液体培养基中,试验分为对照组和试验组(培养基中加入提取物和槲皮素,使终浓度为亚抑菌浓度),放置于37 ℃下培养5 h,测定方法同“1.4.1”节。
1.4.3 引物合成 参考文献[16]的上游引物:5′-G C T C A A C G T G A G T T G G A T C A T A-3′,下游引物:5′-C A C T G C T G C T G A T G G C T C C T T T C-3′,由生工生物工程(上海)股份有限公司合成引物。
1.4.4 DNA提取及质粒构建 将培养过夜的大肠杆菌菌液提取DNA并进行PCR扩增,反应条件为:94 ℃ 5 min;94 ℃ 1 min,55 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 10 min。PCR产物由生工生物工程(上海)股份有限公司测序并合成质粒。
1.4.5 标准曲线构建 根据重组质粒的浓度和纯度计算DNA拷贝数,倍比稀释成1.0×10、100×10、1.0×10、1.0×10和1.0×10拷贝数质粒,分别不同质粒为模板进行荧光定量RCR扩增反应,每个拷贝数质粒重复扩增3次,以拷贝数为横坐标,以值为纵坐标建立标准曲线,PCR反应体系见表1,反应程序为:95 ℃ 30 s,95 ℃ 5 s,55 ℃ 34 s,95 ℃15 s,60 ℃ 1 min,95 ℃ 15 s。
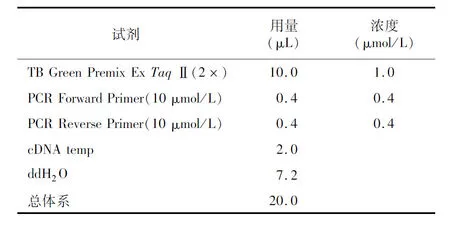
表1 QPCR反应体系
1.4.6 熔解曲线分析 在反应完成后对扩增产物进行熔解曲线分析,检验是否存在引物二聚体或非特异性扩增。
1.4.7 敏感性试验 将已知拷贝数的质粒DNA进行10倍倍比稀释,反应完成后检验检测方法的敏感性,每个稀释倍数作3个重复。
1.4.8 重复性和特异性试验 分别以大肠杆菌氟苯尼考、头孢类、大环内酯类和四环素类耐药菌株的DNA为模板进行检测,每个菌株重复检测3次,检验反应方法的特异性。
1.4.9 样品基因的表达量变化检测 将大肠杆菌分别用1/2(高)、1/4(中)、1/8(低)MIC的杠板归提取物和槲皮素处理,按照试剂盒说明步骤提取供试大肠杆菌总RNA,反转录合成CDNA。扩增试验设计为组内3次试验,考察样品基因的含量变化。
2 结果
2.1 杠板归提取物对大肠杆菌的MIC值
由表2可知,杠板归提取物和槲皮素对5株大肠杆菌均有抑制作用,但提取物对DF2、BY22不如槲皮素,对GL26、GP46的抑菌活性强于槲皮素,2种药品对HS40的抑菌活性相差不大。
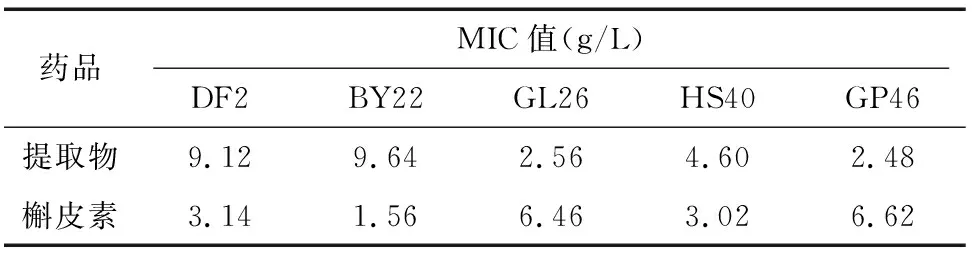
表2 杠板归提取物和槲皮素对大肠杆菌的MIC值
2.2 氟苯尼考对亚抑菌浓度药物处理后大肠杆菌MIC值的影响
由表3可知菌株经杠板归提取物和槲皮素处理后氟苯尼考对菌液MIC值的变化。与对照组相比,DF2、HS40的MIC值分别下降51.38%、52.82%,BY22分别下降47.86%、73.57%,GL26的MIC值没有变化,HS40的MIC值分别下降48.65%、52.70%,GP46分别下降76.76%、50.70%,试验结果说明氟苯尼考对提取物处和槲皮素理后大肠杆菌的MIC值有不同影响,MIC值最高下降76.76%。
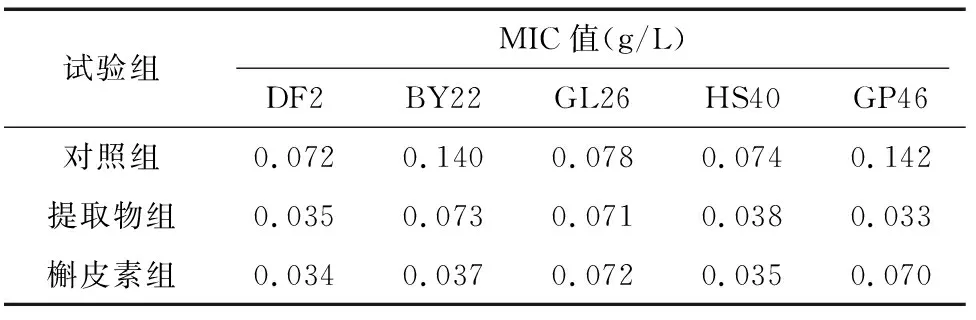
表3 氟苯尼考对大肠杆菌的MIC值变化
2.3 floR基因检测及质粒构建
由图1可知,通过基因检测得出145 bp目的片段,无非特异性扩增。产物测序后结果与GenBank中的基因序列比对,相似度为98.7%~100.0%。PCR产物测序并合成质粒,质粒浓度为50.05 ng/μL。

2.4 标准曲线
由图2可知,荧光定量的线性回归方程为=-3.02×lg拷贝数+28.77,=0.999 2。

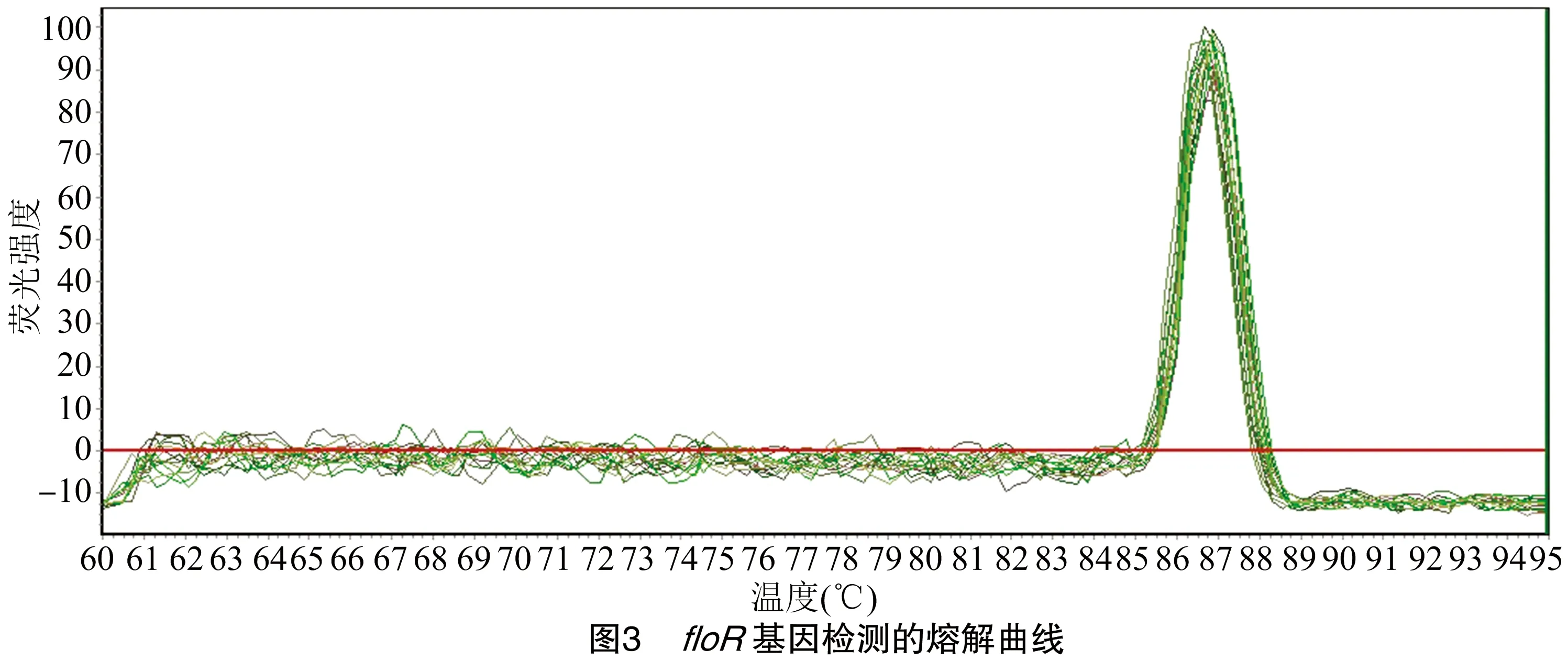
2.5 熔解曲线分析
由图3可知,熔解曲线分析结果的熔解温度为85.1~88.6 ℃,无引物二聚体和非特异性扩增。
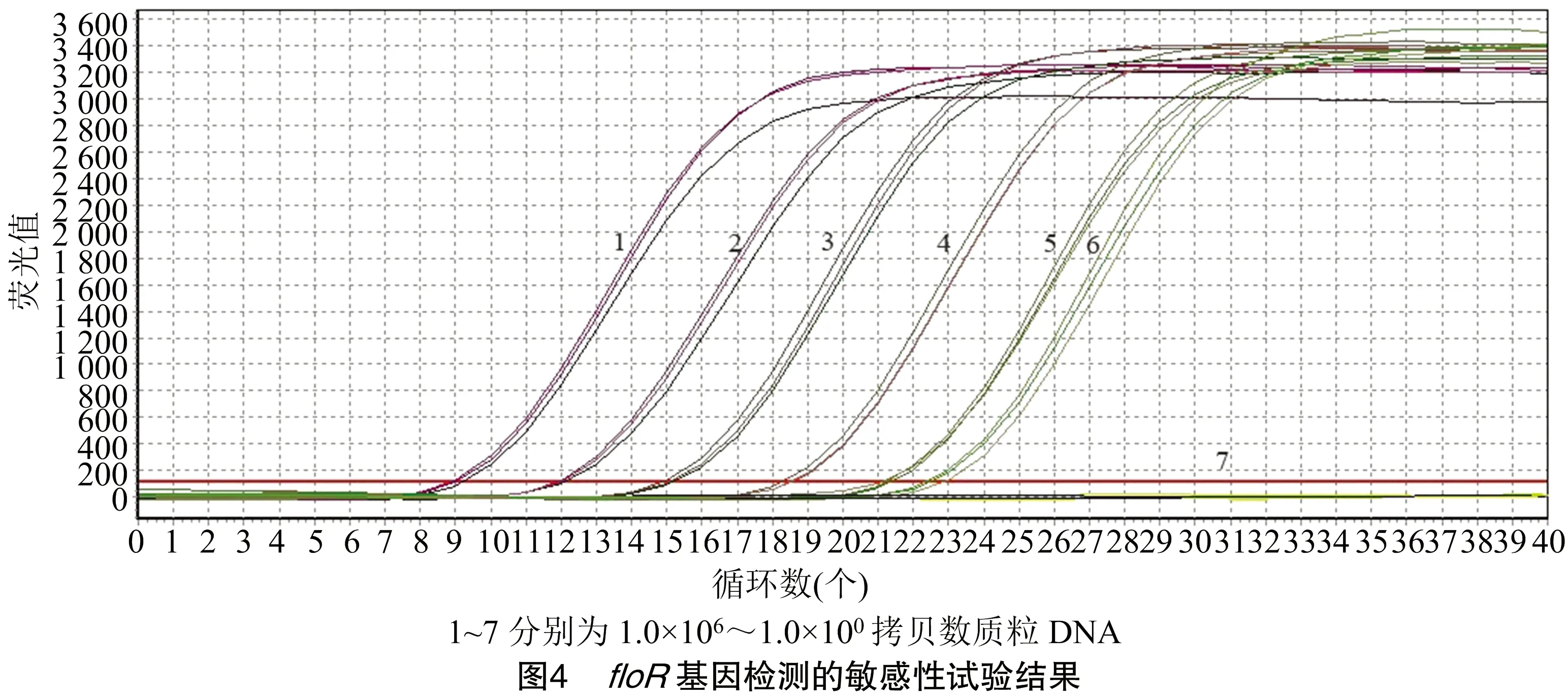
2.6 敏感性试验结果
分别对1.0×10~1.0×10拷贝数含量的7种质粒进行基因荧光定量PCR反应,由图4可知,其灵敏度为1.0×10。
2.7 重复性和特异性试验结果
根据建立的荧光定量方法检测不同的大肠杆菌耐药菌株,由图5可知,大肠杆菌耐氟苯尼考菌株为阳性,且重复性较好,大肠杆菌耐头孢类、大环内酯类和四环素类菌株均为阴性,提示该检测方法的特异性强、重复性好。

2.8 floR基因表达量变化分析
由表4可知,不同剂量药物处理大肠杆菌耐药菌株后,与对照组相比,低剂量处理组中5株菌的值无变化,中、高剂量组值下降,其中,高剂量组变化明显。选取对照组和高剂量(1/2MIC)处理组的值,采用2-ΔΔ法计算药物处理前后基因表达量变化,利用GraphPad Prism7软件作图,相对表达量数值高表示基因表达量变化小,数值低表示基因表达量变化大。由图5可知,通过提取物和槲皮素处理后,5株耐药菌株的基因表达量均下降,其中对于菌株DF2、GL26,提取物的基因表达量分别是对照组的0.869 8、0.847 9倍,低于槲皮素试验组的0.923 1、0.965 3倍,菌株BY22和GP46中提取物试验组表达量为对照组的0.900 0、0.911 6倍,高于槲皮素试验组的0.831 5、0.859 4倍,菌株HS40中2个试验组的基因表达量变化不大,分别为0.897 5、0.897 9倍,提取物对5株耐药菌的基因表达量分别下降13.02%、10.00%、15.21%、10.25%和8.84%。试验结果提示杠板归提取物和槲皮素可使猪源大肠杆菌氟苯尼考耐药基因表达量下降,其表达量变化大小因菌株而异。

表4 药物处理前后floR基因CT值

3 讨论
中药活性提取液与抗生素混合使用后,可明显改善细菌的耐药性消除作用。张秀英等将大肠杆菌耐恩诺沙星菌株接种于十大功劳木醇提取物的营养肉汤中,传代培养3~5代后,药物对试验菌株的MIC最高可降低32倍。采用1/2MIC的铁冬青提取物传代培养大肠杆菌,在第3代时氟苯尼考、阿莫西林和诺氟沙星等对试验菌株的MIC由 640 μg/mL 降至0.625 μg/mL以下,消除效果明显。本研究通过试验得出杠板归提取物和槲皮素对5株大肠杆菌均有抑制作用,氟苯尼考与提取物和槲皮素联合作用后对5株大肠杆菌的MIC值可下降1/2或1/4,由此可见,联合作用多次传代培养后,提取物和槲皮素对氟苯尼考的耐药消除作用明显。
荧光定量PCR中绝对和相对定量法差异明显,王大涛通过梅花鹿P21基因的检测比较相对和绝对荧光定量PCR表明,绝对定量结果的准确性明显优于相对定量。由于本试验采用不同方法处理不同样品从而得到目标基因的表达量有差异,因此本试验采用绝对定量方法检测目的基因的表达量,同时根据基因序列建立猪荧光定量PCR检测方法,检测灵敏度达1.0×10拷贝数,确保基因表达变化的精确性。在计算基因表达量变化时,2-ΔΔ法必须引入看家基因作为内参,检测过程繁琐且扩增效率对试验结果存在较大的影响,2-Δ联合标准曲线法计算值方便,最能测得目的基因的表达量差异,同时也能节省试剂材料。
基因在能量驱动下,细菌体内产生外排泵将药物或毒物排出体外,从而对抗生素产生耐药性,在耐药菌株与敏感菌株间传递使得耐药性广泛传播。多种中药通过消除细菌耐药质粒而降低细菌的耐药性,研究表明艾叶醇提液对耐庆大霉素大肠杆菌的耐药质粒消除率可达69.4%,从而使得庆大霉素对大肠杆菌有明显抑制作用。本试验通过荧光定量方法得出药品处理后基因表达量变化,发现杠板归提取物和槲皮素可使耐药基因表达量明显下降,其表达量变化大小因菌株而异,杠板归提取物使5株菌的基因表达量分别下降13.02%、10.00%、15.21%、10.25%和8.84%,表明大肠杆菌基因表达量与其耐药程度具有一定关系,且杠板归提取物对改变大肠杆菌基因表达量与耐药性具有一定作用,提示杠板归提取物可作为大肠杆菌耐药基因的抑制剂。杠板归提取物由于是粗组分,很难阐述清楚该中药对基因的消除机制,因此后续研究应集中在药材处理耐药细菌后的代谢途径、转录组、蛋白组学进行研究,深刻探讨中药的药用机制,同时也为杠板归开发运用及消除耐药机制研究提供参考。

