帕金森病患者血清miR-124水平与认知损害、炎症及氧化应激反应的相关性*
罗 丹,吴继祥,覃国勇,陶先明
重庆医科大学附属第一医院大足医院/重庆市大足区人民医院神经内科,重庆 402360
帕金森病(PD)是一种由中脑多巴胺能神经元选择性丢失引起的进行性多系统神经退行性病变,以认知损害为最普遍和最严重的表现[1]。然而,目前关于认知损害进展[从轻微认知障碍(PD-MCI)进展至痴呆(PDD)]的相关机制尚不明确,这给临床预防和控制该病带来了巨大的困难。微小核糖核酸(miRNA)是内源性非编码短链RNA分子,通过抑制或促进其mRNA靶标的降解起到转录后调节作用[2]。miRNA作为神经退行性疾病的循环生物标志物,正在被学者们积极地研究[3]。有报道称,一组大脑特异性miRNA,如miR-124,在神经发育、突触可塑性、调节记忆和神经退行性疾病相关的蛋白方面发挥着关键作用,其水平异常从而导致认知障碍[4]。然而目前较少有临床研究调查过miR-124在PD认知损害进展中的作用。为了探讨这一问题,本研究比较了不同认知状态下PD患者血清miR-124表达差异以及其与炎症和氧化应激反应的关系,从而为明确miR-124在诊断PD患者认知损害中的临床意义提供证据支持。
1 资料与方法
1.1一般资料 选择2018年3月至2021年9月在本院神经内科治疗的98例PD患者作为PD组,其中男59例、女39例,年龄50~80岁、平均(62.49±8.39)岁。由2名资深的运动障碍专家根据国际帕金森病和运动障碍协会工作组(MDS)现行临床诊断标准[5]进行诊断。任何有脑卒中、癫痫、脑炎、创伤性脑损伤、恶性肿瘤、心脏事件或严重精神疾病史的患者都被排除。另外纳入同期没有任何神经和精神疾病史的志愿者50例作为对照组,其中男29例、女21例,年龄51~81岁、平均(63.75±6.78)岁。两组研究对象性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。本研究经本院伦理委员会审批通过,所有研究对象家属均签署知情同意书。
1.2方法
1.2.1患者的临床评估 所有患者都经过至少停药(抗PD治疗的相关药物)12 h后进行临床评估。运动症状采用PD统一评定量表Ⅲ(UPDRS-Ⅲ)和修正Hoehn&Yahr(H&Y)分级进行评定;非运动症状采用Epworth嗜睡量表(ESS)、老年抑郁量表(GDS)、Sniffin嗅觉筛查试验(SSST-12)和快动眼睡眠行为障碍筛查问卷(DSQ)进行评定。
1.2.2神经心理学评估 所有参与者均接受了简易精神状态检查(MMSE)以进行整体认知评价,并对5个特定认知领域进行了综合性神经心理学成套测验。所有参与者在认知评估期间都处于静息状态,以尽量减少对运动症状的影响。将神经心理学测试的原始分数(包括记忆能力、语言能力、执行能力得分)转换为Z分[(研究组分数-对照组分数)/对照组分数标准差]。PDD是根据MDS现行临床诊断标准诊断的。PD-MCI是根据MDS 2012年(2级)标准[5]定义的,需要在同一认知领域或跨不同领域至少2次神经心理测试中出现损伤(低于标准平均值>1.5倍标准差)。将发生认知障碍的PD患者[包括26例PDD患者(PDD亚组)和33例PD-MCI患者(PD-MCI亚组)]纳入PD-CI组。将未发生认知障碍的患者纳入PD-NC组,共39例。
1.2.3miR-124水平检测 在进行临床和神经心理学评估的当天,收集所有研究对象血清样本。采用miRNeasy血清/血浆试剂盒(德国Qiagen公司)提取血清miRNA。用miRcute miRNA第1链cDNA合成试剂盒(德国Qiagen公司)进行反转录,然后对2 μL产物进行实时荧光定量PCR。扩增条件如下:95 ℃变性15 min,95 ℃ 15 s、55 ℃ 30 s、70 ℃ 34 s,延伸阶段采集荧光信号,共40个循环。PCR引物(美国Life Technologies公司)序列如下:miR-124,正向5′-GCT AAG GCA CGC GGT G-3′,反向5′-GTG CAG GGT CCG AGG T-3′;外参cel-miR-39,5′-GCT TCG GCA GCA CAT ATA CTA AAA T-3′。相对表达水平使用2-ΔΔCt方法计算。
1.2.4血清生化指标检测 从禁食12 h的研究对象中采集外周静脉血标本5 mL。血凝块形成后,3 000 r/min离心15 min分离血清。生化分析在本院实验室进行,测定血清氧化应激反应标志物[超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)、晚期氧化蛋白产物(AOPP)]和系统性炎症介质[三磷酸腺苷(ATP)、二磷酸腺苷(ADP),以及腺苷脱氨酶(ADA)、髓过氧化物酶(MPO)、NLR家族含热蛋白结构域蛋白(NLRP)1、NLRP3、白细胞介素(IL)-1β、IL-6、IL-18、肿瘤坏死因子(TNF)-α]。试剂盒购自上海通蔚实业有限公司。测定450 nm处吸光度,计算对应的梯度浓度,绘制标准曲线。
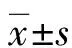
2 结 果
2.1PD组和对照组血清生化指标和miR-124水平比较 PD组血清miR-124、ADA水平低于对照组,AOPP、ATP、ADP、MPO、NLRP1、NLRP3、IL-1β、IL-6、TNF-α水平高于对照组,差异均有统计学意义(P<0.05)。见表1。
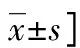
表1 PD组和对照组血清生化指标和miR-124水平比较[M(P25,P75)或
2.2血清miR-124水平与认知损害的关系 PD-CI患者血清miR-124水平低于PD-NC患者[0.45(0.34,0.62)vs.0.85(0.79,0.95),Z=-6.077,P<0.05],且PDD亚组患者血清miR-124水平亦低于PD-MCI亚组[0.46(0.41,0.66)vs.0.51(0.37,0.69),Z=-2.773,P=0.006]。Spearman相关分析结果提示,血清miR-124水平和认知损害呈负相关(r=-0.598,P<0.001)。
2.3血清miR-124水平与PD组患者临床评估量表评分等的关系 Pearson相关分析结果提示,血清miR-124水平与PD组患者UPDRS-Ⅲ评分、H&Y分级、GDS评分呈负相关(P<0.05)。见表2。
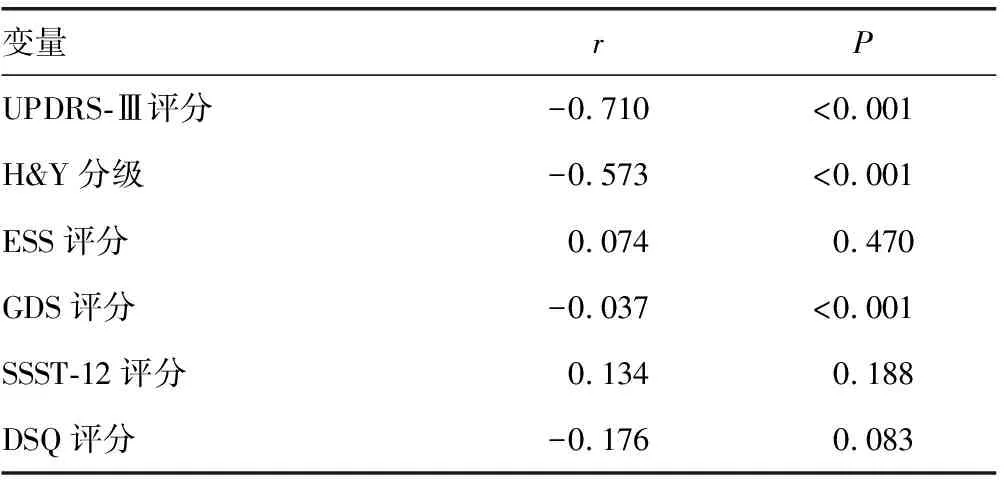
表2 血清miR-124水平与PD组患者临床评估量表评分等的关系
2.4血清miR-124水平与PD组患者系统性炎症介质及氧化应激反应标志物的关系 Pearson相关分析结果提示,血清miR-124水平与PD组患者SOD、CAT、MDA、AOPP、ATP、ADP、ADA、MPO、IL-1β、IL-6、TNF-α均具有相关性(P<0.05)。见表3。
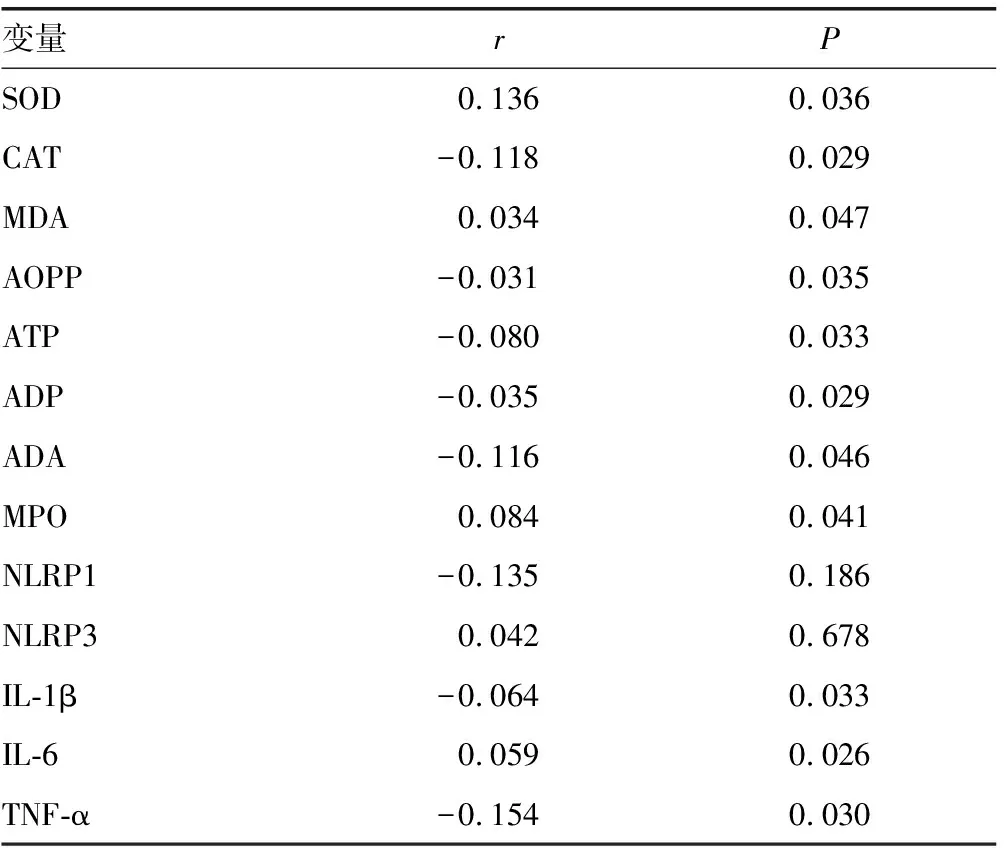
表3 血清miR-124水平与PD组患者系统性炎症介质和氧化应激反应标志物的关系
2.5多因素Logistic回归分析导致PD患者认知损害的危险因素 为了研究PD患者认知损害的危险因素,以是否发生认知损害作为因变量(PD-NC=0,PD-CI=1);同样地,为了研究认知损害进展的影响因素,进一步将是否发生PDD作为因变量(PD-MCI=0,PDD=1)。经单变量模型筛选患者的临床资料后,只有H&Y分级、GDS评分、血清miR-124是PD-CI发生和进展的影响因素(P<0.05),除此以外,UPDRS-Ⅲ评分、血清IL-6、TNF-α亦是PD-CI发生的影响因素(P<0.05);血清MDA、IL-1β是PD-CI进展的影响因素(P<0.05)。将上述变量进一步纳入多因素Logistic回归模型,证实血清miR-124和UPDRS-Ⅲ评分是PD-CI发生的独立影响因素(P<0.05);而血清miR-124和MDA是PD-CI进展的影响因素(P<0.05)。见表4、5。
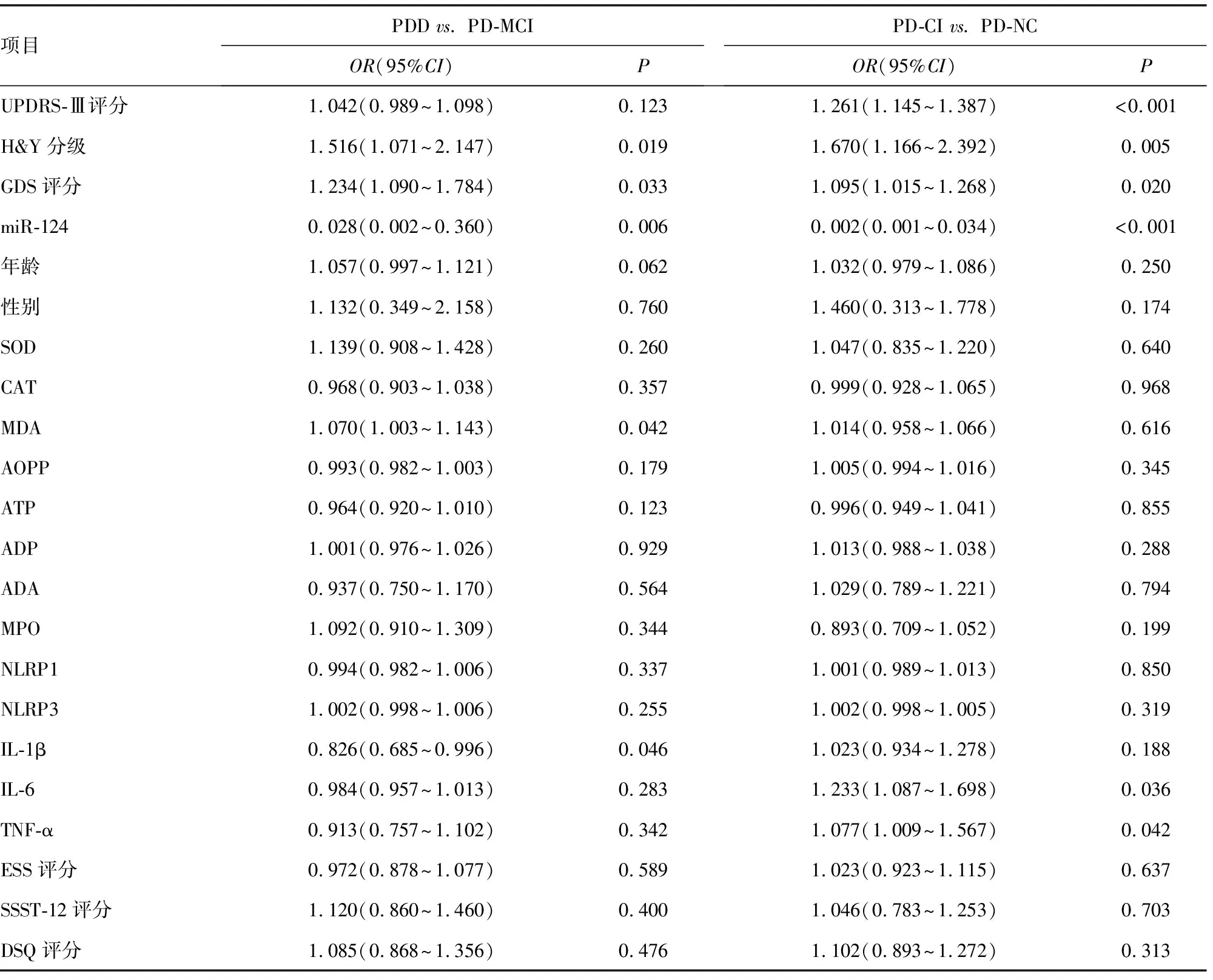
表4 单因素Logistic回归分析导致PD患者认知损害的危险因素
2.6ROC曲线分析 ROC曲线分析结果显示,miR-124在鉴别诊断PDD、PD-MCI时,曲线下面积(AUC)为0.840(95%CI:0.764~0.916),对应截断值为0.705,特异度为100.0%,灵敏度为69.4%;在鉴别诊断PD-CI、PD-NC时,AUC为0.844(95%CI:0.766~0.922),对应截断值为0.695,特异度为73.8%,灵敏度为100.0%。见图1。
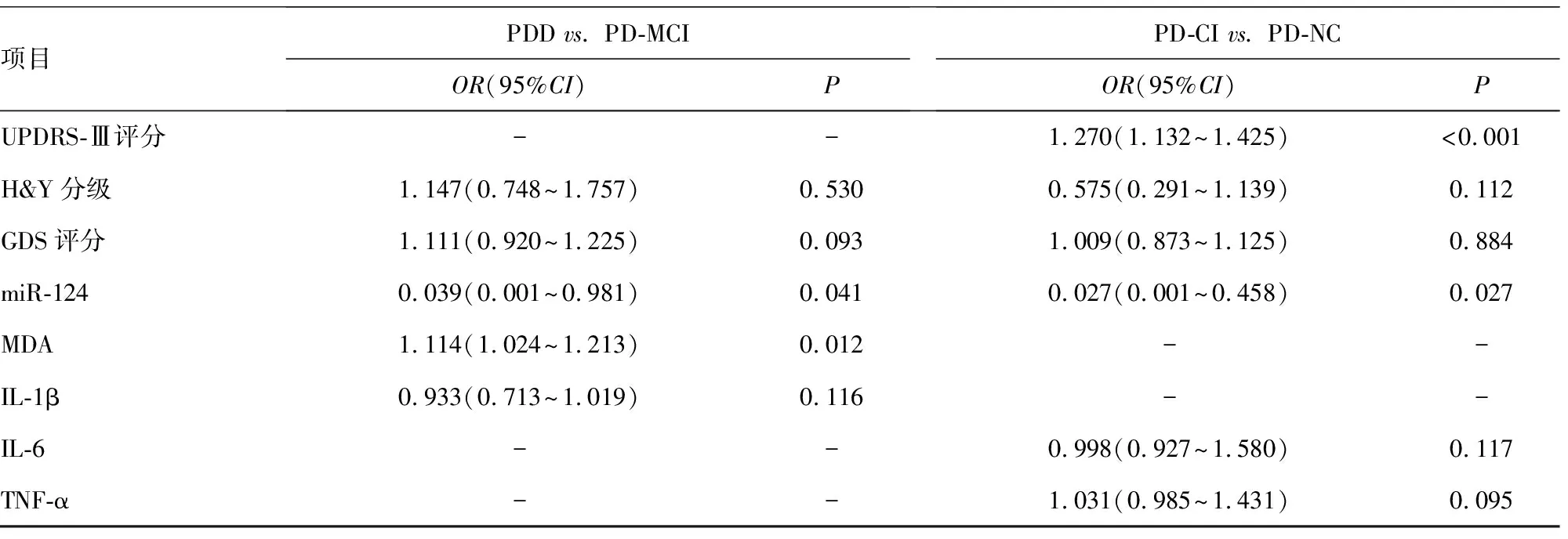
表5 多因素Logistic回归分析导致PD患者认知损害的危险因素
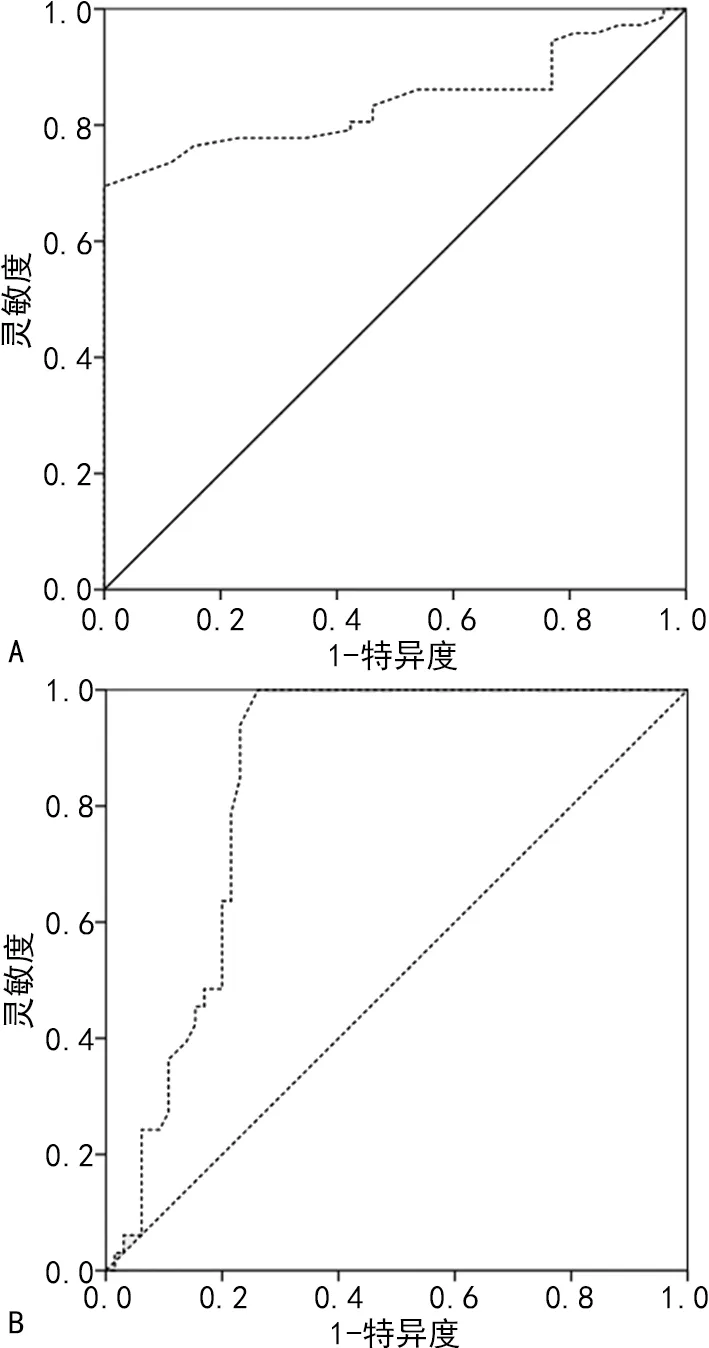
注:A为miR-124鉴别诊断PDD、PD-MCI的ROC曲线;B为miR-124鉴别诊断PD-CI、PD-NC的ROC曲线。
2.7多元线性回归分析血清miR-124水平与认知领域评分的关系 在多元线性回归模型中控制教育年限和UPDRS-Ⅲ评分后,血清miR-124水平对整体认知状态(MMSE评分)的影响有统计学意义(β=0.134,t=1.391,P<0.001)。在特定认知域中,血清miR-124水平对记忆能力Z分(β=0.483,t=1.388,P<0.001)、语言能力Z分(β=0.354,t=1.452,P<0.001)、执行能力Z分(β=0.309,t=1.326,P<0.001)的影响也有统计学意义。
3 讨 论
PD是世界范围内第二大与衰老有关的神经退行性疾病,其发病机制复杂[6]。而氧化应激反应是贯穿整个老化过程的一个关键因素,在PD发病过程中,氧化应激反应是线粒体缺乏和慢性炎症导致的结果,在这个过程中,二者都会产生大量活性氧和活性氮[7]。这些反应性物质可导致黑质中多巴胺能神经元的死亡,从而形成细胞损伤-神经炎症-过度氧化应激反应的恶性循环。miR-124是在神经和免疫系统中发挥作用的被人们研究得最深入的miRNA之一[8]。先前有动物实验发现,miR-124可以抑制PD发展过程中的神经炎症,可能是调节PD炎性反应的治疗靶点[9]。而本研究则通过临床样本证实,PD组患者血清miR-24水平显著低于对照组,与认知损伤、炎症和氧化应激反应密切相关(P<0.05),而且检测血清miR-124对于鉴别诊断PD-CI与PD-NC、PDD与PD-MCI均有较高的效能,有望成为早期诊断或预防PD-CI进展的有效生物标志物。
miR-124是一种脑特异性miRNA,在大脑和中枢神经系统发育过程中高度表达[10]。研究表明,miR-124是外周和中枢神经系统炎症过程中的关键介质,可抑制小胶质细胞/巨噬细胞的激活并减少促炎细胞因子的产生,进而在一定程度上防止多种神经退行性疾病中的神经元损伤[11]。据报道,miR-124可以通过调节MEKK3/NF-κB信号通路来抑制PD发展中的神经炎症,作为调节PD炎性反应的潜在治疗靶点[8]。miR-124在1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)诱导的神经元损伤中表达下调,上调miR-124可显著促进PD患者多巴胺能神经元的自噬相关蛋白表达,在PD发展过程中抑制神经炎症。例如,YAO等[12]报道miR-124通过靶向NF-κB和自噬作用,进而抑制PD发展过程中的炎性反应,表明miR-124可能是调节PD患者炎性反应、有前景的治疗靶点。在PD模型小鼠中,miR-124还参与由钙蛋白酶1/p25介导的CDK5表达,体外补充miR-124可增加细胞活力并减少钙蛋白酶1/CDK5通路的蛋白质表达[13]。本研究中,与对照组相比,PD组患者血清miR-124表达水平显著降低,这与赵利等[14]研究结果一致。该研究表明,下调的miR-124可通过多种促炎/氧化应激机制促进PD的进展和认知功能损害。
PD的发病机制高度复杂,但是基于患者的氧化应激反应和从各种实验模型中获得的证据,研究者们发现了一些主要的细胞和分子机制,如蛋白毒性、线粒体功能障碍等[15]。而神经炎症和氧化应激反应在这个过程中发挥着关键作用。它们可能代表了最终导致神经元死亡和退化的损害途径。然而,将一些氧化应激反应指标如SOD、CAT、MDA作为PD的标志物是有争议的,这与个体差异和指标不稳定性有关。本研究发现,miR-124可作为PD患者认知障碍的生物标志物。首先,本研究阐明了认知障碍的PD患者血清miR-124水平普遍下调,特别是PDD亚组与PD-MCI亚组或PD-NC组相比,下降更明显。此外,miR-124在鉴别诊断PDD和PD-MCI方面或PD-CI和PD-NC方面也有较高的AUC。在调整了其他混杂因素后,miR-124与整体认知参数有关(P<0.05)。与认知障碍的特殊联系,使miR-124有望成为诊断或预测PD患者早期认知损害的潜在生物标志物。
综上所述,本研究证实血清miR-124水平与PD患者认知损害、神经炎症和氧化应激反应有关,miR-124可能成为PD-CI的有效诊断标志物,并有助于进一步了解PD-CI进展的病理生理学机制。但本研究仍有局限性,首先,研究的样本量偏小,因此,需要更多的样本来确认这些结果。其次,本研究采用横断面设计,不能分析miR-124对认知功能的纵向影响,也不能作出因果推论。miR-124在PD认知障碍发病机制中的作用值得进一步研究。

