PRMT1对喉癌细胞增殖、迁移的影响及其机制
周兰柱,孙 哲,吴 俊,王文忠
(蚌埠医学院第一附属医院耳鼻咽喉头颈外科,蚌埠 233000;*通讯作者,E-mail:13955259093@163.com)
喉癌(laryngeal cancer)是一种世界上较常见的恶性肿瘤之一,其主要发病人群为中老年男性,根据研究显示,其发病率占头颈部肿瘤的7.9%~35.0%,占全身恶性肿瘤的5.7%~7.6%[1]。喉癌发病率高且预后较差。目前临床主要的治疗方案为对早期喉癌行手术治疗,中晚期喉癌主要为手术辅助放化疗。蛋白质精氨酸甲基转移酶(protein arginine methyltransferase 1, PRMT1)是甲基化精氨酸残基的主要酶组家族中的重要蛋白,已有研究表明PRMT1在多种癌症的DNA损伤修复、基因转录调控、蛋白质翻译以及各种信号传导中起到重要作用[2-5]。核糖核苷酸还原酶亚单位M2(ribonucleotide reductase M2, RRM2)为核糖核酸还原酶家族蛋白质,其主要功能为协助相关基因合成。近年来,发现其可能与肿瘤的发生发展有关[6]。本课题组在前期对干扰PRMT1表达的细胞进行下游基因变化分析中发现,RRM2很可能为PRMT1的下游基因。本实验主要通过调控PRMT1的相对表达量,观察RRM2的变化以及后续对喉癌细胞增殖、侵袭迁移的影响,以期为喉癌的诊断以及治疗提供新的临床治疗思路。
1 材料与方法
1.1 细胞和主要试剂
1.1.1 细胞与组织 喉癌细胞Hep-2购自上海细胞库,培养于含10%胎牛血清(FBS)、100 U/ml青霉素、100 μg/ml链霉素的DMEM培养基中,培养于恒温培养箱(培养箱条件:37 ℃、5% CO2)中。喉癌组织和癌旁组织取自蚌埠医学院第一附属医院耳鼻咽喉头颈外科确诊为喉癌的患者。患者均经喉镜下病理组织活检确诊,其中男7例、女1例。
本研究已通过蚌埠医学院第一附属医院伦理委员会批准,批文号为伦科批字[2021]第208号。所有患者及其家属均签署手术知情同意书。
1.1.2 药品与试剂 PRMT1小干扰试剂盒(si-PRMT1)、无关序列均购自上海吉玛基因公司;Lipofectamin2000购自美国赛默飞公司;噻唑蓝(methyl thiazolyl tetrazolium,MTT)、二甲基亚砜(dimethyl sulfoxide,DMSO)、结晶紫、二辛可宁酸(bicinchoninic acid,BCA)、Mateigel基质购自上海碧云天生物技术有限公司;兔抗蛋白质精氨酸甲基转移酶(PRMT1)抗体、兔抗核糖核苷酸还原酶亚单位M2(RRM2)抗体、波形蛋白(vimentin)抗体、E-钙黏蛋白(E-cadherin)、兔抗β肌动蛋白(β-actin)抗体、辣根过氧化物酶标记山羊抗兔购自上海艾博抗公司。
1.2 方法
1.2.1 细胞转染及分组 将生长状态较好的Hep-2细胞株种植于六孔板,待细胞数量铺满孔底70%按照说明书开始转染。实验设空白对照组(control)、阴性对照组(si-NC)及PRMT1小干涉RNA组(si-PRMT1)。
1.2.2 RT-PCR检测组织及细胞中PRMT1 mRNA、RRM2 mRNA、vimentin mRNA和E-cadherin mRNA的相对表达量 将收取的细胞和组织使用TRIzol试剂提取总RNA后,按照cDNA合成试剂盒说明书反转录合成cDNA,最后使用RT-PCR检测PRMT1 mRNA、RRM2 mRNA、vimentin mRNA和E-cadherin mRNA的表达。引物序列如下:PRMT1引物上游:5′-ACTGTAGAGTTGCCGGAACA-3′,下游:5′-TCCTTCAGCCACTTGGTTCG-3′;RRM2引物上游:5′-GCTTGGTCGACAAGGAGAAC-3′,下游:5′-CCTCTGCCTI'CTTATACATCTG-3′;vimentin引物上游:5′-GCTGCAGGCCCAGATTCA-3′,下游:5′-TTCATACTGCTGGCGCACAT-3′;E-cadherin引物上游5′-TCCTCCTGCTCCTACTGTTTC-3′,下游:5′-TTCTTCTCCACCTCCCTCTTC-3′。使用U6作为参照,上游:5′-CTCGCTTCGGCAGCACA-3′,下游:5′-AACGCTTCACGAATTTGCGT-3′。RT-PCR条件:95 ℃持续3 min,94 ℃持续15 s,60 ℃持续55 s,72 ℃持续30 s,进行35个循环,通过2-ΔΔCt方法计算mRNA相对表达量,实验重复3次。
1.2.3 噻唑兰(methyl thiazolyl tetrazolium,MTT)法检测各组细胞增殖情况 收取control组、si-NC组、si-PRMT1组细胞接种在96孔板,每孔细胞数为8×103个,每组设5个复孔。24 h后观察细胞状态,依次加入15 μl MTT溶液、150 μl DMSO溶液,检测每孔490 nm波长吸光度值(OD490),并计算细胞存活率。实验重复3次。细胞存活率=(实验组OD490-空白组OD490)/(对照组OD490-空白组OD490)。
1.2.4 Transwell检测细胞侵袭迁移能力 侵袭实验:将80 μl基质胶置于上层小室,待基质胶凝固后将control组、si-NC组、si-PRMT1组细胞使用无血清DMEM培养基重悬于上层小室,每孔细胞数约为3×104个,设3个复孔。下室加入600 μl含10%胎牛血清的DMEM培养基,细胞培养箱中24 h。4%多聚甲醛固定细胞30 min,0.1%结晶紫染色30 min后PBS溶液清洗、风干。用荧光显微镜在5个随机视野中观察并拍摄细胞。
迁移实验无需加入基质胶,其他步骤同侵袭实验。
1.2.5 Western blot法检测PRMT1、RRM2、vimentin和E-cadherin蛋白相对表达量 收取control组、si-NC组、si-PRMT1组细胞消化离心并提取蛋白,BCA试剂盒测出三组蛋白浓度。取各组等量样品进行凝胶电泳分离,使用PVDF膜进行蛋白转膜,5%脱脂奶粉封闭2 h,将一抗(PRMT1、RRM2、vimentin、E-cadherin和β-actin)1 ∶1 000稀释。清洗后加入二抗稀释液孵育2 h,使用增强型化学发光试剂盒进行显影,Image G进行灰度值分析。
1.2.6 统计学分析 使用SPSS 23.0统计学软件对数据进行分析,实验结果以均数±标准差表示。多组间两两比较采用LSD-t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 PRMT1和RRM2在喉癌和癌旁组织中的相对表达量
RT-PCR结果表明,喉癌组织中PRMT1、RRM2 mRNA相对表达量与癌旁组织相比明显增加,差异均具有统计学意义(P<0.05,见图1)。同时,Western blot结果也显示喉癌组织中PRMT1、RRM2蛋白相对表达量较癌旁组织相比明显增加,差异均具有统计学意义(P<0.05,见图1)。这表明PRMT1和RRM2在喉癌组织中高表达。
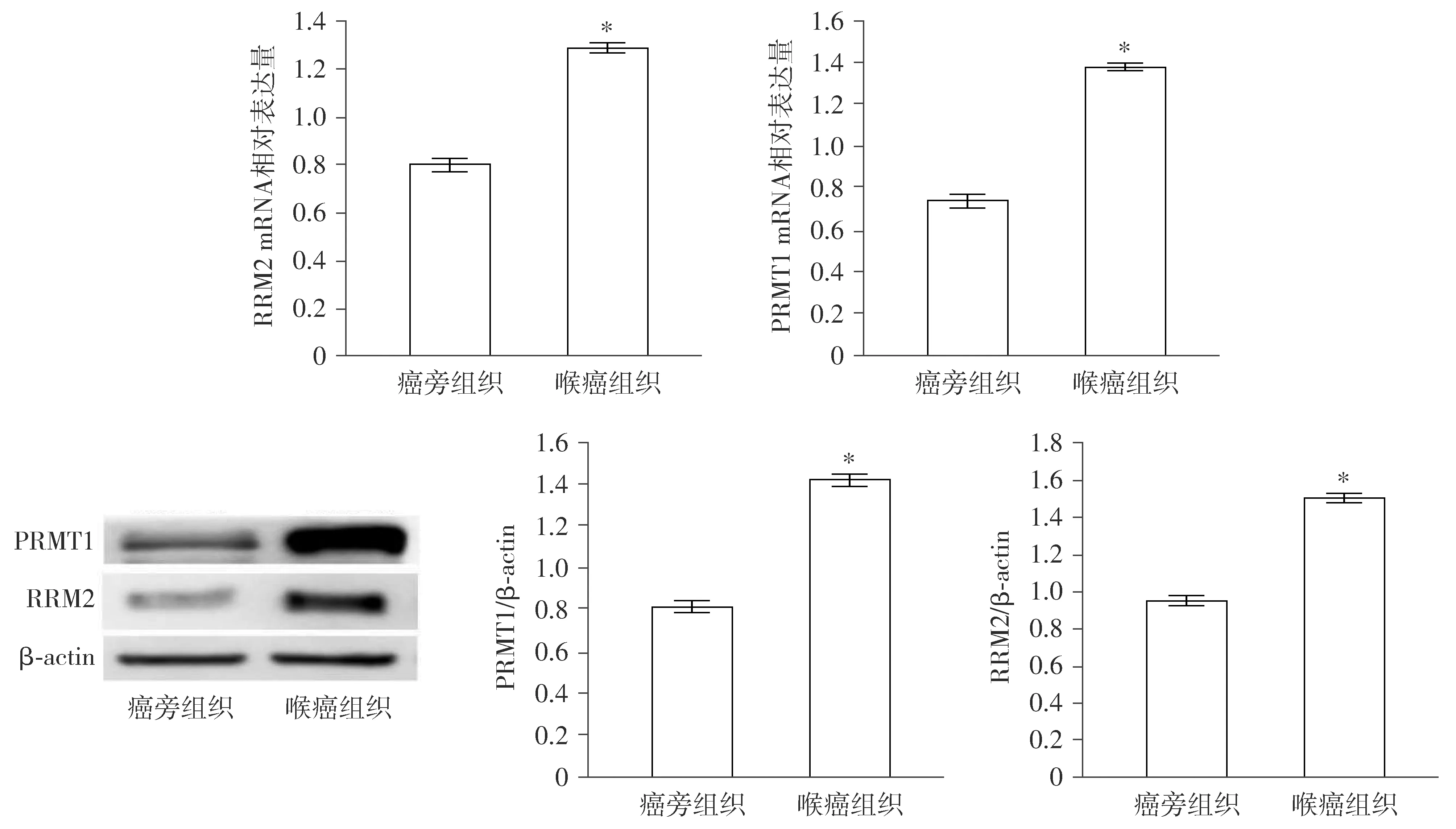
与癌旁组织比较,*P<0.05图1 PRMT1和RRM2在喉癌和癌旁组织中的表达情况Figure 1 The expression of PRMT1 and RRM2 in laryngeal carcinoma and adjacent tissues
2.2 下调Hep-2细胞中PRMT1后PRMT1和RRM2 mRNA相对表达量及细胞生存率
下调Hep-2细胞中PRMT1后,为了验证下调效果,行RT-PCR实验,检测结果表明,si-PRMT1组PRMT1 mRNA相对表达量较control组和si-NC组明显下降(P<0.05),这说明已下调PRMT1;si-PRMT1组RRM2 mRNA相对表达量较control组和si-NC组明显下降(P<0.05,见图2),初步表明下调PRMT1后,RRM2表达也相对降低。MTT结果表明,si-PRMT1组24 h细胞存活率较control组和si-NC组明显降低(P<0.05,见图3),说明PRMT1可促进肿瘤细胞增殖。

与control组比较,*P<0.05图2 下调Hep-2细胞中PRMT1后PRMT1和RRM2 mRNA相对表达量Figure 2 Relative expression levels of PRMT1 and RRM2 mRNA in Hep-2 cells after down-regulation of PRMT1

与control组比较,*P<0.05图3 下调Hep-2细胞中PRMT1后MTT法检测三组细胞存活率Figure 3 Cell viability of Hep-2 cells after down-regulating PRMT1 in three groups by MTT assay
2.3 下调Hep-2细胞中PRMT1后细胞侵袭、迁移能力减弱
下调Hep-2细胞中PRMT1后,si-PRMT1组细胞侵袭率、迁移率较control组和si-NC组明显降低,差异具有统计学意义(P<0.05,见图4),说明PRMT1可提高Hep-2细胞侵袭、迁移能力。
2.4 下调Hep-2细胞中PRMT1后vimentin、E-cadherin mRNA相对表达量降低
RT-PCR结果表明,si-PRMT1组迁移相关因子vimentin和E-cadherin mRNA明显降低,差异具有统计学意义(P<0.05,见图5)。这表明PRMT1提高细胞迁移能力可能是通过提高vimentin和E-cadherin蛋白相对表达量来实现的。

与control组比较,*P<0.05图4 下调PRMT1后Hep-2细胞侵袭和迁移能力改变Figure 4 Changes of cell invasion and migration abilities after down-regulation of PRMT1 in Hep-2 cells

与control组比较,*P<0.05图5 下调Hep-2细胞中PRMT1后RT-PCR法检测三组细胞vimentin和E-cadherin mRNA相对表达量Figure 5 Relative expression of vimentin and E-cadherin mRNA in Hep-2 cells after down-regulating PRMT1 by RT-PCR
2.5 下调Hep-2细胞后PRMT1、RRM2、vimentin和E-cadherin蛋白相对表达量降低
Western blot结果表明,si-PRMT1组细胞PRMT1、RRM2蛋白相对表达量较control组和si-NC组明显降低,差异具有统计学意义(P<0.05,见图6),表明RRM2蛋白相对表达量随着PRMT1蛋白相对表达量的降低而降低。而迁移相关蛋白vimentin和E-cadherin也明显降低(P<0.05,见图6),表明PRMT1提高细胞迁移能力可能是通过提高vimentin和E-cadherin蛋白相对表达量来实现的。

与control组比较,*P<0.05图6 下调Hep-2细胞中PRMT1后,Western blot法检测三组细胞的PRMT1、RRM2、vimentin和E-cadherin蛋白相对表达量Figure 6 Relative expressions of PRMT1, RRM2, vimentin and E-cadherin in Hep-2 cells after down-regulating PRMT1 by Western blot
3 讨论
PRMT家族是甲基化精氨酸残基化的相关酶组之一,目前已被证明是参与基本细胞生命活动如转录调控、DNA损伤反应、前体mRNA剪接、细胞信号传导[7]。大量研究证实,PRMTs在多种癌症中高表达,会导致癌症患者的不良预后[8-10]。PRMT1是哺乳动物细胞中PRMTs家族的重要成员,约占细胞PRMT总活性的85%。它通过甲基化组蛋白H4R3形成H4R3me2结构,作为转录辅助激活剂发挥作用,H4R3me2通常通过招募其他辅助因子和促进转录因子的结合从而参与主动转录[11]。PRMT1还可通过转录因子如FOXO1、RUNX1或辅因子的直接甲基化来调节转录[12,13]。已有学者表明,PRMT1表达在胰腺癌、前列腺癌、乳腺癌等中上调,并且PRMT1有助于肿瘤细胞增殖[14-16]。本研究收取喉癌组织和癌旁组织,发现PRMT1的表达在喉癌中同样上调,这与前人研究的其他肿瘤一致,这说明PRMT1在大部分肿瘤中表达是上调的。Liu等[17]研究表明,肿瘤抑制因子p53功能受乳腺癌细胞中的PRMT1调节,并且敲低PRMT1可以激活p53信号通路并诱导细胞生长停滞和衰老。PRMT1可以直接与p53结合并以酶促依赖性方式抑制p53的转录活性,导致p53通路几个关键下游靶标的表达水平降低从而发挥抑制癌症的作用。Li等[15]也表明PRMT1能够促进乳腺癌细胞增殖,并且介导的EZH2在R342位点(meR342-EZH2)的甲基化对PRMT1诱导的细胞增殖有很大影响,可以在体外和体内加速乳腺癌细胞增殖。以上研究表明,PRMT1在癌症中可能是对癌症的增殖和转移是有促进作用的。为了研究PRMT1在喉癌中的作用,我们首先提取了喉癌患者标本,结果表明PRMT1在喉癌组织中表达是上升的。同时,我们前期通过研究基因组发现,RRM2可能为PRMT1的潜在靶点,而我们发现下调PRMT1表达后,RRM2同时表达下调,这表明了PRMT1是可以调控RRM2的表达的。
RRM2可以调节核糖核苷酸还原酶活性,有研究表明,RRM2表达水平较高时,癌症转移率高、预后差。传统观点认为RRM2主要参与S期DNA合成过程,受细胞周期严格调控。非小细胞肺癌、结直肠癌和乳腺癌等肿瘤中,RRM2表达水平明显增高,并且侵袭、迁移能力提高,这说明RRM2具有促转移潜力[18-20]。在本研究中,我们发现下调PRMT1表达使得RRM2下调后,细胞增殖能力较其他两组明显降低,细胞侵袭力、迁移力也明显下降。为了探究细胞侵袭迁移能力降低的原因,我们通过Western blot检测vimentin和E-cadherin蛋白相对表达量,结果表明通过下调PRMT1而下调RRM2,可降低vimentin和E-cadherin表达来抑制侵袭迁移能力。 综上所述,喉癌中PRMT1与RRM2表达上调,喉癌Hep-2中PRMT1可促进RRM2的表达进一步促进细胞增殖、侵袭和迁移,其机制可能通过上调vimentin和E-cadherin蛋白表达量来实现。这为喉癌的临床治疗提供新思路。

