TRIB3通过激活β-catenin信号通路促进鼻咽癌细胞增殖和侵袭迁移
李 敏,蒋成义
(蚌埠医学院第一附属医院耳鼻咽喉头颈外科,蚌埠 233004;*通讯作者,E-mail:jiangchengyi1975@163.com)
鼻咽癌(nasopharyngeal carcinoma,NPC)是一种来源于鼻咽上皮细胞的鳞状细胞癌,具有高度恶性、局部浸润和远处转移的特点,大多数患者在诊断时已出现局部淋巴结转移,甚至远处转移[1]。目前,放射治疗是鼻咽癌患者的首选治疗方法,但由于转移和复发的存在,鼻咽癌患者的5年生存率仍较低[2]。因此,迫切需要寻找新的治疗靶点为鼻咽癌的诊断和治疗提供新的方向。
Tribbles假激酶3(Tribbles homolo 3,TRIB3)是Tribbles伪激酶家族的成员之一,与肿瘤、代谢性疾病等疾病关系密切。TRIB3包含一个丝氨酸/苏氨酸蛋白激酶样结构域,但缺乏ATP结合袋和催化残基,无激酶活性[3]。TRIB3作为信号转导介质和支架蛋白,在正常生理和疾病生物学中发挥着重要作用,影响细胞的增殖、分化、周期和死亡等[4]。大量研究证明,TRIB3在多种肿瘤中表达异常,如肺癌[5]、乳腺癌[6]、结直肠癌[7]、白血病[8]等,不同靶点与TRIB3相互作用或者激活不同信号通路,在不同的肿瘤或肿瘤的不同状态中发挥着不同的作用。TRIB3已被证明可以激活MAPK信号通路,促进肾细胞癌的发展和转移[9]。多项研究也证明,TRBI3过表达可明显激活ERK和JNK通路,促进肺腺癌的发生发展[10]。然而,TRIB3在调控鼻咽癌进展中的作用机制仍不清楚。
β-catenin信号通路具有多种细胞功能,但在大多数肿瘤中,处于高度失调状态。研究证实,β-catenin信号通路在人结直肠癌[11]、肝癌[12]等肿瘤的发生中被激活,并抑制下游蛋白质复合物,包括AXIN、GSK-3等,使β-catenin在胞内表达失控,从而促进肿瘤的发生发展。β-catenin介导的信号传导途径还是导致癌症干细胞进展的重要途径,并且其在神经胶质瘤中被激活[13]。因此,充分了解β-catenin信号通路的作用机制,有利于鼻咽癌治疗的发展。
通过查找基因表达谱数据动态分析(gene expression profiling interactive analysis,GEPIA)数据库发现,TRIB3在头颈部肿瘤中异常表达。我们猜测TRIB3的异常表达可能与鼻咽癌的发生、发展有关,有可能成为治疗鼻咽癌的新靶标。因此,本研究观察TRIB3对鼻咽癌增殖和侵袭迁移的影响,旨在探讨TRIB3在鼻咽癌的发生发展中作用机制,为推进其靶向治疗提供依据。
1 材料与方法
1.1 细胞株与主要试剂
人鼻咽癌细胞HNE-1和5-8F购自中南大学湘雅医学院,人鼻咽癌细胞CNE-2Z和人正常鼻咽细胞(N69)购自美国ATCC公司,sh-TRIB3、反转录试剂盒、总RNA提取试剂盒购自上海吉玛公司,RPMI-1640培养基、胰蛋白酶购自美国Hyclone公司,胎牛血清(FBS)、Materigel胶购自浙江天杭生物科技股份有限公司,Lipofectamin2000购自美国Thermo Scientific公司,一抗TRIB3购自美国Affinity公司,一抗β-catenin、GSK-3β、E-cadherin、N-cadherin、Vimentin、β-actin及兔二抗均购于美国Abbkine科技有限公司,Transwell小室及BCA蛋白测定试剂盒购自碧云天生物技术有限公司。
1.2 实验方法
1.2.1 样本收集 样本收集来自于蚌埠医学院第一附属医院,从接受手术干预的鼻咽癌患者队列中收集了8例鼻咽癌活检组织和健康癌旁组织。本研究中涉及人体样本的所有程序均按照赫尔辛基宣言进行,通过蚌埠医学院第一附属医院伦理委员会的审查,并且征得8例鼻咽癌患者个人的知情同意。
1.2.2 细胞培养与转染 人鼻咽癌细胞HNE-1、CNE-2Z和5-8F培养于RPMI-1640培养基(含10%胎牛血清、100 U/ml青霉素、100 μg/L链霉素)中,放置在37 ℃、5% CO2的培养箱中培养。转染时,将对数生长期的CNE-2Z和HNE-1细胞接种于6孔板,当细胞密度为50%~60%时,根据Lipofectamine2000说明书操作,分别将shRNA NC和shRNA TRIB3(shRNA 1,2,3)加至CNE-2Z和HNE-1细胞的6孔板中,命名为NC组和shRNA1组、shRNA2组、shRNA3组。转染6~8 h后,更换培养基。后续实验验证找出转染效率最高的shRNA组后,转染后分组为NC组和sh-TRIB3组。
1.2.3 荧光定量PCR(qRT-PCR)检测TRIB3的相对表达量 将鼻咽癌细胞用PBS清洗并用胰酶消化,再使用Trizol法分别提取总RNA。检测浓度与纯度后,将RNA逆转录为cDNA,再根据qRT-PCR试剂盒说明书,以GAPDH为内参检测TRIB3 mRNA的相对表达量,并检测转染效率。使用2-ΔΔCt方法分析TRIB3 mRNA的相对表达量。
1.2.4 CCK-8实验检测增殖能力 取转染后生长状态良好的HNE-1细胞、CNE-2Z细胞以5 000/孔的细胞密度接种于96孔板中,在0,24,48,72 h分别向各孔中加入10 μl CCK-8溶液,继续孵育2 h,在酶标仪上测定450 nm波长处各孔吸光度(OD)值,OD值越高,代表活细胞数越多,细胞增殖能力越强。
1.2.5 集落克隆实验检测增殖能力 取转染后生长状态良好的HNE-1细胞、CNE-2Z细胞以100个细胞/孔的密度接种在6孔板中,用含有10%胎牛血清的培养基于37 ℃和5%CO2下培养14 d,观察细胞形成集落的情况,并拍照记录。
1.2.6 Transwell小室实验检测侵袭迁移能力 迁移实验不铺Materigel胶,侵袭实验需要将Materigel胶与RPMI-1640培养基(不含10%胎牛血清)按1 ∶8的比例稀释,以每个小室50 μl铺于小室底部,放置于培养箱中培养1 h使其处于半凝固状态。细胞以1.5×105细胞/孔的密度在无血清培养基中接种于上室,下室加入600 μl RPMI-1640培养基(含有10%胎牛血清)。细胞被允许在24 h和48 h内迁移。细胞用4%甲醛固定20 min,再用0.1%结晶紫染色30 min,在显微镜下观察穿过滤膜的细胞数量。
1.2.7 划痕实验检测迁移能力 将两株鼻咽癌细胞接种于6孔板中,培养至80%~90%。用无菌10 μl移液管针尖制造线状创面。0 h和24 h后采集迁移照片,每组随机选取5个区域。创面愈合率(%)=[(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度]×100%。
1.2.8 免疫印迹(Western blot)实验检测相关蛋白含量 用添加蛋白酶抑制剂的RIPA缓冲液裂解细胞,再用BCA蛋白定量试剂盒测定蛋白浓度。等量的蛋白经10% SDS-PAGE分离,转移到PVDF膜上。随后,在室温下用5%脱脂牛奶封闭膜1 h,与一抗(TRIB3 1 ∶2 000,Snail 1 ∶2 000,E-cadherin 1 ∶1 000,N-cadherin 1 ∶1 000,Vimentin 1 ∶2 000,GSK-3 β1 ∶1 000,p-GSK-3β1 ∶1 000,β-catenin 1 ∶1 000,p-β-catenin 1 ∶1 000,β-actin 1 ∶2 000)在4 ℃下孵育过夜,用含0.1% Tween-20(TBST)的Tris缓冲盐水清洗,二抗(兔抗1 ∶10 000)室温孵育2 h。冲洗后,用Western blot底物(Pierce,美国)制备膜。β-actin作为内源性对照。使用ImageJ软件分析结果。

2 结果
2.1 TRIB3在鼻咽癌细胞中的表达水平
与癌旁组织相比,鼻咽癌组织中TRIB3表达高度上调(P<0.05,见图1)。与正常鼻咽上皮细胞(N69)相比,TRIB3在鼻咽癌细胞系CNE-2Z、HNE-1和5-8F中呈高表达状态(P<0.05,见图1)。因此,我们将使用CNE-2Z和HNE-1两株细胞进行后续实验。使用sh-TRIB3转染各株细胞后,sh-TRIB3组细胞中的TRIB3 mRNA的表达水平明显低于NC组(P<0.05,见图2)。其中,shRNA2的转染效率最高,后续实验均用shRNA2进行细胞转染。Western blot实验结果显示,sh-TRIB3组细胞中的TRIB3蛋白的表达水平明显低于NC组(P<0.05,见图3)。
2.2 下调TRIB3使鼻咽癌细胞增殖活性降低
CCK-8检测结果显示,与NC组相比,sh-TRIB3组鼻咽癌细胞活力的调控作用显著降低(P<0.05,见图4)。集落克隆实验结果显示,与NC组相比,sh-TRIB3组HNE-1细胞和CNE-2Z细胞的集落克隆能力显著降低(P<0.05,见图5)。实验结果显示,TRIB3敲低后显著降低了NPC的增殖能力。
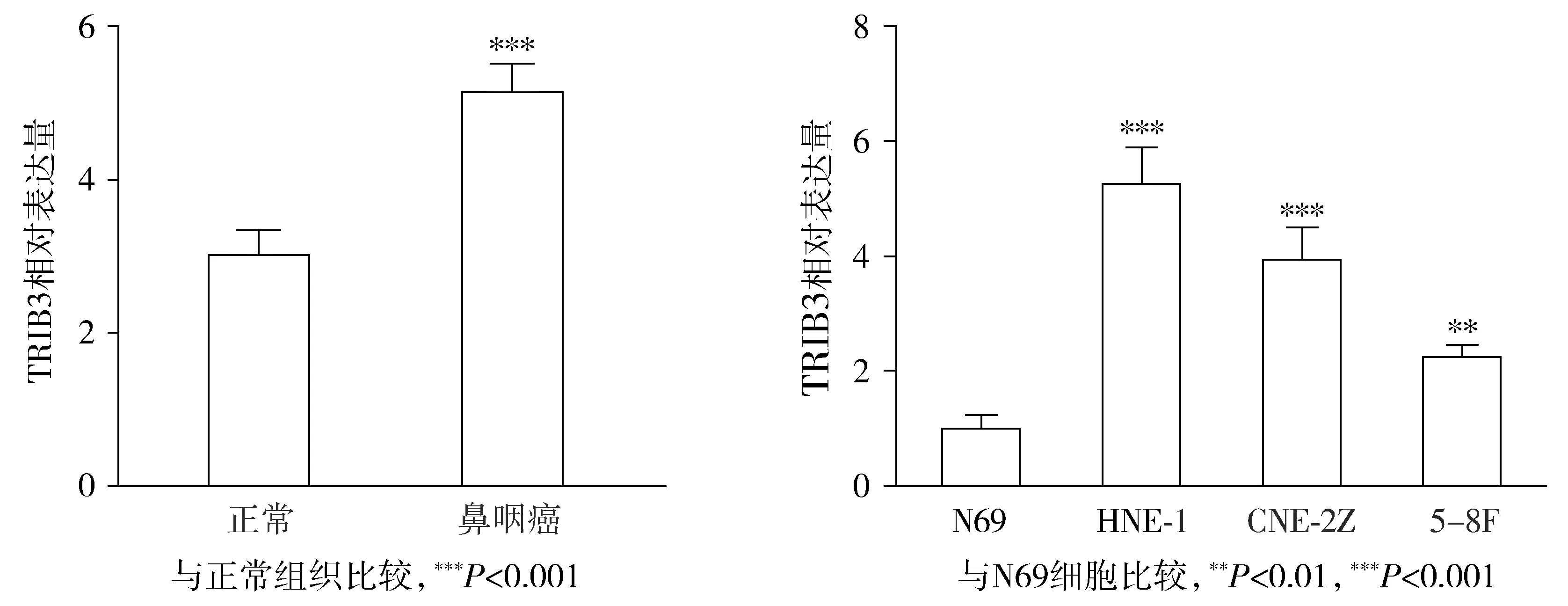
图1 TRIB3在鼻咽癌组织中的表达水平Figure 1 Expression level of TRIB3 in NPC tissues and cells

与NC组比较,*P<0.05,***P<0.001图2 转染shRNA后鼻咽癌细胞中TRIB3 mRNA的相对表达Figure 2 Relative expression of TRIB3 mRNA in nasopharyngeal carcinoma cells transfected with shRNA

A.HNE-1细胞中TRIB3蛋白表达B.CNE-2Z中TRIB3蛋白表达与NC组比较,*P<0.05图3 转染shRNA后鼻咽癌细胞中TRIB3蛋白的相对表达量Figure 3 Relative expression of TRIB3 protein in nasopharyngeal carcinoma cells transfected with siRNA

与NC组比较,*P<0.05,**P<0.01图4 CCK-8分析敲低TRIB3后鼻咽癌细胞的增殖能力Figure 4 Effect of TRIB3 knockdown on the proliferation ability of NPC by CCK-8 assay
2.3 下调TRIB3使鼻咽癌细胞迁移、侵袭能力降低
Transwell小室实验结果显示,与NC组相比,sh-TRIB3组的迁移、侵袭能力明显降低(P<0.05,见图6)。划痕实验结果显示,与NC组相比,sh-TRIB3组的迁移能力显著降低(P<0.05,见图7)。实验结果显示,敲低TRIB3可显著抑制了NPC的迁移和侵袭能力。
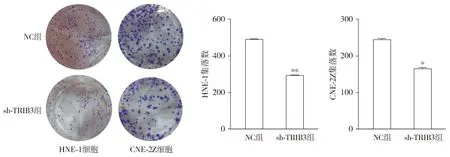
与NC组比较,*P<0.05,**P<0.01图5 集落克隆实验分析敲低TRIB3后鼻咽癌细胞的增殖能力Figure 5 Effect of TRIB3 knockdown on proliferation of NPC by colony-forming test

与NC组比较,*P<0.05,**P<0.01图6 敲低TRIB3可降低鼻咽癌细胞的迁移和侵袭能力Figure 6 Knockdown of TRIB3 reduces the migration and invasion of NPC

与NC组比较,*P<0.05,**P<0.01图7 划痕试验显示敲低TRIB3抑制了鼻咽癌的迁移能力 (×40)Figure 7 Knockdown of TRIB3 inhibits the migration ability of NPC by wound healing assay (×40)
2.4 TRIB3介导鼻咽癌细胞的上皮间质转化过程
通过Western blot实验检测EMT通路相关蛋白Snail、E-cadherin、N-cadherin和Vimentin的相对表达量。在HNE-1和CNE-2Z细胞中,与NC组相比,sh-TRIB3组E-cadherin水平升高,Snail、N-cadherin和Vimentin水平下调(均P<0.05,见图8)。实验结果表明,TRIB3介导了鼻咽癌细胞的上皮间质转化过程,并且促进了此过程的发展。
2.5 TRIB3通过激活β-catenin信号通路促进鼻咽癌细胞的发展
通过Western blot实验检测β-catenin信号通路相关蛋白GSK-3β、p-GSK-3β、β-catenin和p-β-catenin的相对表达量。在HNE-1和CNE-2Z细胞中,与NC组相比,sh-TRIB3组p-GSK-3β和β-catenin蛋白表达水平明显低于NC组;而GSK-3β和p-β-catenin蛋白表达水平明显高于NC组(P<0.05,见图9)。实验结果提示,TRIB3可激活β-catenin信号通路,从而促进鼻咽癌的发展。
3 讨论
鼻咽癌是华南及东南亚地区最常见的恶性肿瘤之一,其发病与EB病毒感染、遗传、种族、环境等因素密切相关[14]。探究鼻咽癌发病的具体作用机制可以为鼻咽癌的诊断和治疗提供新的思路。本研究发现,TRIB3在鼻咽癌细胞中呈高表达状态,并且通过激活β-catenin信号通路发挥其促癌的作用。
Tribbles家族最早在果蝇中被发现,在哺乳动物中,有3种Tribbles异构体,包括TRIB1,TRIB2和TRIB3,它们都是果蝇Tribbles蛋白的同源物[15]。TRIB3可以通过参与细胞内信号传导或者与功能蛋白相互作用来促进肿瘤的发展。近年来,大量研究已经证实TRIB3在多种肿瘤中表达上调,并且促进了肿瘤的发生与发展。在胃癌组织中,TRIB3的表达明显高于癌旁非肿瘤组织[16]。TRIB3在子宫内膜癌中的表达水平高于正常子宫内膜,其通过抑制AKT信号通路诱导子宫内膜癌细胞凋亡,抑制增殖、迁移和侵袭[17]。尽管如此,TRIB3在鼻咽癌的发生发展中甚少被报道。本研究表明,与正常鼻咽上皮细胞相比,TRIB3在鼻咽癌谱系中表达上调,并且能促进鼻咽癌的增殖和侵袭迁移。当TRIB3被抑制时,这种促癌作用就被抑制了。为了进一步探究TRIB3在鼻咽癌中的作用,本研究进行了大量体外实验。首先通过PCR实验和Western blot实验发现,与正常鼻咽上皮组织相比,TRIB3在鼻咽癌组织中高表达。其次,将鼻咽癌细胞分为NC组和sh-TRIB3组,通过细胞克隆实验、CCK-8实验、划痕实验以及Transwell实验发现,下调TRIB3后可以抑制鼻咽癌细胞的增殖和侵袭迁移能力。结果提示TRIB3在鼻咽癌的发生发展中发挥了至关重要的作用,并且可以促进鼻咽癌细胞的恶性生物学行为,但其与患者预后的相关性有待进一步研究证实。

与NC组比较,*P<0.05,**P<0.01图8 Western blot实验检测敲低TRIB3对鼻咽癌细胞中EMT相关蛋白相对表达量的影响Figure 8 Effect of TRIB3 knockdown on relative expression of EMT-related proteins in NPC by Western blot

与NC组比较,*P<0.05,**P<0.01图9 Western blot实验检测敲低TRIB3对鼻咽癌细胞中β-catenin信号通路相关蛋白相对表达量的影响Figure 9 Effect of TRIB3 knockdown on relative expression of β-catenin signaling pathway-related proteins in NPC by Western blot
β-catenin是一种多功能蛋白,是β-catenin信号通路中重要的信号转导因子,游离的β-catenin可进入细胞核并调控基因表达,β-catenin的异常表达可诱导肿瘤发生[18,19]。β-catenin信号蛋白的过表达可促进肿瘤的发生发展,而β-catenin信号通路可以加速肿瘤细胞浸润和远处转移[20]。多项研究表明β-catenin在胆管癌中过表达,激活了β-catenin信号通路,促进胆管癌细胞的EMT过程[21]。本研究通过Western blot实验发现,敲低TRIB3后,β-catenin信号通路相关蛋白p-GSK-3β和β-catenin蛋白表达降低,而GSK-3β和p-β-catenin蛋白表达增加,这表明TRIB3可以通过激活β-catenin信号通路来促进鼻咽癌的发展。
综上所述,敲低TRIB3可以抑制β-catenin信号通路的激活,从而抑制鼻咽癌细胞的增殖和侵袭迁移,为鼻咽癌的诊断和靶向治疗提供了新的方向。本研究未设置TRIB3过表达组,只设置了敲低TRIB3的实验组,具有一定不足之处,后续研究将增加过表达组进行后续实验。而且本项目仅在体外研究TRIB3通过调控β-catenin信号通路对鼻咽癌产生的影响,缺少相应的体内实验。同时,TRIB3调控β-catenin信号通路所涉及到的各种分子机制在不同鼻咽癌细胞中的具体作用途径还需进一步探究,从而为鼻咽癌提供更有效的诊断和治疗。

