双花母草素对人卵巢癌SKOV3细胞增殖、迁移和侵袭的影响
宜姣姣,叶亚丽,王爱红
(1延安大学医学院医学研究实验中心,延安 716000;2子长市人民医院检验科;3宝塔区妇幼保健计划生育服务中心检验科;*通讯作者,E-mail:ydwangaihong@163.com)
卵巢癌是影响女性健康的常见癌症。尽管诊断技术、新辅助放化疗和手术治疗取得了进步,但卵巢癌的5年生存率仍然很低[1-5],因此,开发针对卵巢癌特异性信号转导通路分子异常的新药是非常必要的。据报道中药治疗在肿瘤的治疗中具有改善患者生存质量、降低转移复发率等优势[2-7],因此,探究中药成分在卵巢癌治疗中的作用对卵巢癌的治疗具有积极作用。
双花母草素是一种从中药中提取出的萘醌类物质,具有抗炎、抗菌和抗癌等广泛的生物学特性[8-14]。Ralph等[9]研究发现双花母草素处理可引起人类黑色素瘤SK-Mel 19、SK-Mel 28及SK-Mel103三种细胞系细胞的单双DNA链断裂,从而抑制细胞周期进程、复制和DNA修复,促进人类黑色素瘤细胞凋亡。Barbosa-Jobim等[11]研究发现双花母草素抑制胃癌细胞ACP02的集落形成、迁移和侵袭能力,并且通过降低端粒酶及myc的活性发挥抗癌作用。这提示双花母草素是一种很有前途的抗癌药物。但是,双花母草素对卵巢癌的作用未见有报道,基于此,本研究拟探究双花母草素对卵巢癌SKOV3细胞增殖、迁移、侵袭及EMT的影响及其可能的调节机制。
1 材料与方法
1.1 材料
人卵巢癌SKOV3细胞购自北京北纳生物公司细胞库;FBS、RPMI-1640培养基、青链霉素均购自以色列BI公司;胰岛素及双花母草素购自美国MCE公司;Transwell小室购自美国Merck公司;GAPDH、E-cadherin、N-cadherin、β-catenin抗体购自武汉三鹰生物技术有限公司。
1.2 方法
1.2.1 细胞培养 采用RPMI-1640+10%FBS+0.01 mg/ml胰岛素+1%青链霉素培养基于37 ℃恒温培养箱中培养人卵巢癌SKOV3细胞,待细胞融合度达到85%~95%进行传代及实验。
1.2.2 CCK-8实验测定细胞活力 取处于对数生长期,生长状态良好的SKOV3细胞以5×103个/100 μl接入96孔板,37 ℃培养过夜;贴壁后将细胞分为6组,分别加入不同浓度(0,2.5,5,10,20,40 μmol/L)的双花母草素处理48 h,随后在每孔中加入10 μl CCK-8溶液,室温下孵育30 min,并于酶标仪450 nm处测定其吸光度,根据测定的吸光度值计算6组SKOV3细胞的细胞活力。
1.2.3 细胞分组及处理 根据CCK-8预实验结果,将实验分为空白对照组、低剂量组和高剂量双花母草素组。空白对照组不加任何药物;低、高剂量组分别加入5 μmol/L和10 μmol/L双花母草素处理48 h。
1.2.4 Transwell检测细胞侵袭 各组人卵巢癌SKOV3制成浓度为2×104/ml的无血清细胞悬液。分别取200 μl各组细胞悬液加入Matrigel预处理的Transwell上室,5% CO2,37 ℃培养箱培养24 h。取出Transwell小室,PBS清洗未侵袭细胞,并用10%甲醇溶液固定30 min,5%结晶紫染液静置染色20 min,PBS清洗后于显微镜下随机选择5个视野观察拍照计数。实验重复3次。
1.2.5 细胞划痕实验检测细胞迁移 将人卵巢癌细胞SKOV3单细胞悬液(约2×105个)均匀地接种到6孔板(背后用记号笔均匀划线)中培养过夜。然后用枪头垂直于背后的横线划痕。PBS清洗后加入各组无血清培养基、拍照。37 ℃、5% CO2培养箱培养24 h后再次拍照,计算迁移距离。
1.2.6 免疫印迹实验(Western blotting)检测蛋白的表达 采用Western blotting实验检测EMT相关蛋白以及β-catenin的表达,SKOV3细胞5,10 μmol/L干扰处理48 h后,空白对照组、低剂量组和高剂量组SKOV3细胞经冰冻PBS洗涤后加入蛋白裂解缓冲液提取,用Bradford法测定蛋白浓度后,变性并电泳分离。电泳后,蛋白质转移到PVDF膜并于4 ℃过夜孵育E-cadherin(1 ∶500)、N-cadherin(1 ∶500)、β-catenin(1 ∶500)一抗。洗涤后,孵育二抗1 h,并用ECL化学发光系统观察信号,计算目的蛋白相对于GAPDH的表达量。

2 实验结果
2.1 双花母草素对SKOV3细胞活性的影响
CCK-8检测双花母草素处对SKOV3细胞活性的影响,结果显示不同浓度双花母草素(0,2.5,5,10,20,40 μmol/L)处理48 h,细胞活力分别是(100±4.00)%,(85.6±3.48)%,(71.6±4.68)%,(62.5±4.60)%,(31.8±2.35)%,(18.9±1.58)%,与0 μmol/L比较,差异具有统计学意义(见图1)。这提示双花母草素可抑制SKOV3细胞的增殖,基于双花母草素浓度为10 μmol/L时,细胞的增殖能力为其半数,所以以5,10 μmol/L进行后续的实验。
2.2 双花母草素对SKOV3细胞侵袭的影响
采用Transwell进行细胞侵袭实验,结果显示,与对照组相比,低剂量组和高剂量组侵袭的细胞数量均减少,且差异具有统计学意义(P<0.01或P<0.001);与低剂量组相比,高剂量组的侵袭能力亦下降(P<0.01,见图2)。
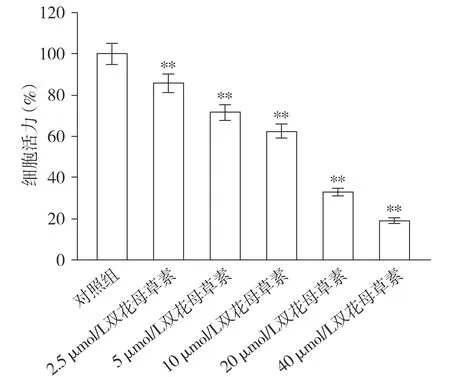
与对照组(0 μmol/L)相比,**P<0.01图1 CCK-8法检测SKOV3细胞的活力 (n=3)Figure 1 Viability of SKOV3 cells detected by CCK-8 (n=3)
2.3 双花母草素对SKOV3细胞迁移的影响
采用细胞划痕进行细胞迁移实验,结果显示,与对照组相比,低剂量组和高剂量组迁移的距离减少,且差异具有统计学意义(P<0.001),与低剂量组相比,高剂量组的迁移距离更少(P<0.01,见图3)。
2.4 双花母草素对SKOV3细胞EMT相关蛋白的影响
Western blotting检测EMT相关蛋白的表达,结果显示,与对照组相比,低剂量组和高剂量组细胞的E-cadherin蛋白表达均上升,N-cadherin蛋白表达均下降,且差异具有统计学意义(P<0.001,见图4)。与低剂量组相比,高剂量处理组E-cadherin蛋白表达亦上升,N-cadherin蛋白表达亦下降,且差异具有统计学意义(P<0.01,见图4)。

与对照组相比,**P<0.01,***P<0.001;与低剂量组相比,##P<0.01图2 Transwell检测双花母草素对SKOV3细胞侵袭的影响 (n=3)Figure 2 Effect of biflorin on the invasion of SKOV3 cells by Transwell assay (n=3)

与对照组相比,***P<0.001;与低剂量组相比,##P<0.01图3 细胞划痕实验检测双花母草素对SKOV3细胞迁移能力的影响 (n=3)Figure 3 Effect of biflorin on cell migration by cell scratch assay (n=3)

与对照组相比,***P<0.001;与低剂量组相比,##P<0.01图4 Western blotting检测双花母草素对SKOV3细胞EMT相关蛋白的影响 (n=3)Figure 4 Effect of biflorin on EMT-related proteins in SKOV3 cells by Western blotting (n=3)
2.5 双花母草素对SKOV3细胞β-catenin蛋白的影响
Western blotting检测β-catenin蛋白的表达,结果显示,与对照组相比,低剂量组和高剂量组β-catenin蛋白表达均下降,差异具有统计学意义(P<0.01或P<0.001,见图5)。与低剂量组相比,高剂量组β-catenin蛋白表达下降,差异具有统计学意义(P<0.01,见图5)。

与对照组相比,**P<0.01,***P<0.001;与低剂量组相比,##P<0.01图5 Western blotting检测双花母草素对SKOV3细胞β-catenin蛋白的影响 (n=3)Figure 5 Effect of biflorin on β-catenin protein in SKOV3 cells by Western blotting (n=3)
3 讨论
近年来,中药在肿瘤的治疗中发挥了重要的作用,许多重要成分表现出良好的抑癌作用和较小的副作用。双花母草素是一种可从草蔻等多种中药中提取的萘醌类物质,具有抗炎、抗肿瘤的活性。Montenegro等[15]研究发现双花母草素以剂量依赖的方式通过AKT通路抑制黑色素瘤细胞MDA-MB-435的侵袭。Vasconcellos等[16]研究发现双花母草素对小鼠红细胞和海胆卵发育均无明显抑制作用,但对B16、MCF-7和HCT-8等几种肿瘤细胞生长均有明显抑制作用,且表现出强烈的抗氧化活性。因此,我们探究了双花母草素对卵巢癌的生物学作用,CCK-8结果显示双花母草素浓度依赖性地抑制卵巢癌细胞的增殖,Transwell及细胞划痕实验结果显示双花母草素浓度依赖性地抑制卵巢癌细胞的侵袭与迁移。
上皮-间质转化(EMT)在肿瘤的发生发展中发挥重要作用,EMT促进癌症转移和复发[17-19],上皮细胞标志物的下调或缺失往往伴随着间质细胞标志物的上调。E-cadherin通常抑制侵袭,而N-cadherin在体外促进侵袭和转移。目前的研究未对双花母草素调节肿瘤侵袭迁移的机制进行研究,因此本研究探究了双花母草素对EMT标记物E-cadherin及N-cadherin的影响,Western blotting结果显示,双花母草素的干预增加了E-cadherin的表达,降低了N-cadherin的表达,这提示双花母草素可通过调节EMT过程抑制卵巢癌的侵袭与迁移。
Wnt/β-catenin通路在卵巢癌的进程中发挥重要调节作用,同时Wnt/β-catenin信号通路已被证明可参与EMT过程[20,21]。我们采用Western blotting检测Wnt/β-catenin信号通路的核心分子β-catenin的表达,进一步确定双花母草素抑制EMT和转移是否与Wnt/β-catenin信号通路相关。结果显示双花母草素可抑制β-Catenin的表达,因此,双花母草素可能通过Wnt/β-catenin通路介导的EMT触发卵巢癌细胞迁移、侵袭及增殖。双花母草素调节卵巢癌的具体方式还有待我们将进一步深入探讨。

