熊果酸通过调控PTGS2 对小鼠肝缺血/再灌注损伤的保护作用
侯文,卢建森,左怀文,刘宏胜(天津市第一中心医院国家卫生健康委员会危重病急救医学重点实验室,天津 300192)
肝缺血/再灌注损伤 (hepatic ischemia /reperfusion injury,HIRI)是指肝脏在短暂失去血液供应之后血液再灌注时肝细胞出现的不同程度的凋亡和坏死,使肝功能受损加重的过程,多见于肝移植、肝切除、失血性休克或创伤等过程[1]。HIRI 是手术后发生肝衰竭和死亡的关键因素[2],因此,HIRI是近年来医学科研学者一直在探索研究的热点课题之一。所以,探寻HIRI 的病理机制与防治方法对提高肝脏外科手术的成功率具有重要的意义。
HIRI 是临床上一种常见的病理生理现象,其发病机制尚未完全清楚,且无很好的防治手段[3]。近年来应对HIRI 的干预方法主要有缺血预处理、药物干预及单克隆抗体、信号通路抑制剂、细胞因子拮抗剂、基因敲除、RNA 干扰等[4]。目前关于HIRI 发生的机制主要包括氧化应激、补体激活、炎性细胞浸润、炎性因子释放及细胞凋亡[5-7]。但这些科研思路和方法大多还处于科研研发阶段,真正用于临床发挥疗效还任重而道远。
熊果酸(ursolic acid, UA)是一类五环三萜类化合物,具有显著的生物活性并广泛存在于自然界各种水果、蔬菜和药用植物中[8-10]。生理活性主要有抗氧化、抗炎、抗肿瘤、抗病毒、抗菌等药理作用[11]。目前UA 在干预疾病研究方面的报道主要包括Mazumder 等[12]报道UA 能减轻糖尿病并发症的发生;Kim 等[13]报道UA 降低MCF-7 细胞来源的乳腺癌干细胞样细胞的增殖;此外,UA 在直肠癌、肺癌、皮肤癌等肿瘤疾病均具有不同程度的干预作用[14-16]。UA 在干预临床各种疑难杂症中发挥着广泛的药理作用,非常值得进一步探究在其他病症中潜在的药理作用及分子机制。
网络药理学的概念是英国药理学家Hopkins[17]在2007 年提出的,其阐明疾病的发生是人体相互作用的多基因、多功能蛋白、多通路相互作用的动态平衡被打乱所造成的结果,也就是说发生疾病的分子基础是多维的。网络药理学能从分子、基因水平层面分析药物单一成分作用于不同靶点、细胞和器官的特点,系统地预测和揭示药物的作用和机制,从而评估药物的疗效、不良反应及发现高效低毒的新药。因此,这种研究方式为传统中药的研发带来了巨大的转机与希望[18]。
本项目前期的动物实验表明,HIRI + UA 组能显著降低小鼠血清中丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate transaminase,AST)的表达,且与HIRI 组比较具有显著性差异(P <0.01),表明UA 能有效干预小鼠HIRI 的发生。因此,我们运用生物信息网络药理学进一步探讨UA 减轻HIRI 发生的潜在机制,为临床研制干预HIRI 的新药提供理论参考。
1 资料与方法
1.1 材料:熊果酸(北京索莱宝科技有限公司),批号:SU8082,纯度≥98%;羧甲基纤维素钠(北京索莱宝科技有限公司),批号:316X021;EDTA 抗原修复液 (Servicebio,pH =9.0),批号:G1203;4%多聚甲醛(Servicebio),批号:G1101;PTGS2(Servicebio),批号:GB113892;HRP-山羊抗兔二抗(Servicebio),批号:GB23303;组化试剂盒DAB 显色剂 (Servicebio),批号:G1211。
病理切片机,上海徕卡仪器有限公司,型号:RM2016;包埋机,武汉俊杰电子有限公司,型号:JB-P5;显微镜,Nikon,型号:E100;成像系统,尼康,型号:Nikon DS-U3。
1.2 动物与实验用药:实验动物由中国医学科学院医学实验动物研究所提供,许可证号:SCXK(京)2014-0004。雄性C57BL 小鼠,5 ~6 周龄,体重19 ~23 g。饲养在装有空调的SPF 环境,温度控制在(23.5±1.0)℃,湿度控制在(65±20)℃,并喂食饲料与水。
使用0.5%羧甲基纤维素钠加热溶解UA。并以20 mg/g、40 mg/g(药物/小鼠体重质量)的剂量灌胃给药。其中Sham + UA 组,UA 高剂量为40 mg/g。
1.3 动物药效学实验:将31 只小鼠分为5 组,分别为假手术组(Sham)、假手术+UA 高剂量组(Sham+HUA)、HIRI 模型组、模型组+UA 低剂量组(HIRI+LUA)、模型组+UA 高剂量组(HIRI+HUA)。前2 组每组5 只小鼠,后3 组每组7 只小鼠。其中Sham+HUA、HIRI+LUA、HIRI+HUA 灌胃给予UA 7 d,1 次/d,其他Sham 与HIRI 模型组灌胃给予等量羧甲基纤维素钠溶液。预处理末次给药1 h后,腹腔内注射戊巴比妥钠(40 ng/g)麻醉小鼠,在上腹正中打开腹腔,小心暴露肝脏,并游离肝门韧带。HIRI、HIRI+LUA 与HIRI+HUA 3 组夹闭肝左叶和肝中叶入肝血管阻断血流,1 h 后松开血管夹,恢复血流(其中Sham 与Sham+HUA 两组仅游离肝门且不阻断血流)。再灌注6 h 后摘眼球取血,分离部分肝脏组织储存于-80 ℃,另一部分储存于10%福尔马林中。
1.4 血清生化分析:首先,将收集到的小鼠血液常温静置60 min 后,3 000 r/min 离心 20 min,分离血清。然后,使用全自动临床生化分析仪(Sysmex CHEMIX-180)测定小鼠血清中ALT 及AST 的水平。
1.5 肝脏组织病理学检测:从10% 福尔马林中取出各实验组肝脏组织样本进行组织病理学检测。首先将样品固定在4% 的多聚甲醛缓冲溶液中,然后嵌入石蜡中。接着将样本切片5 μm,用二甲苯和乙醇脱蜡,苏木精和伊红染色(hematoxylin and eosin,HE),脱水。最后用显微镜观察切片,在随机选择的200 倍镜下观察组织学改变。
1.6 活性成分-HIRI 靶基因网络的构建:在中药系统药理学数据库和分析平台TCMSP 获取UA 相关的小分子化合物结构,然后,运用Pharm Mapper、Swiss Target Prediction 数据库预测其对应的靶基因。将获得的靶基因合并、去除重复后统一在UniProt 服务平台上校正和转化,最终以UniProt ID 表示,建立UA 活性成分靶点数据库。
首先在GeneCards 数据库上以“hepatic ischemia reperfusion injury”为关键词预测与HIRI 相关的靶基因,然后在UniProt 服务平台上校正和转化,最终以UniProt ID 表示。收集UA 成分与 HIRI 的交集靶基因共36 个,并运用Cytoscape 3.7.2 软件映射活性成分-HIRI 疾病靶基因可视化网络图。
1.7 交集靶基因的蛋白-蛋白相互作用:将36 个交集靶基因的gene symbol 导入STRING 服务平台,限定种类为homo sapiens,获得蛋白-蛋白相互作用网络(PPI)数据集。将PPI 数据集导入Cytoscape 3.7.2 利用插件cytoHubba 中MCC 功能获得前10 个hub 靶基因。
1.8 KEGG 通路分析:将36 个交集靶基因以OFFICIAL_GENE SYMBOL 为Select Identifier, 物种为Homo sapiens,使用DAVID 在线数据库进行KEGG(Kyoto Encyclopedia of Genes and Genomes)分析。以P <0.01 为筛选条件获得KEGG 富集数据集。
1.9 初步关键靶基因的获得:取KEGG 中最重要的Pathways in cancer 所 包 含 的 靶 基 因 与MCC 功能获取的核心靶基因的交集靶基因为初步关键靶基因。
1.10 通过分子对接分析确定最终hub 靶基因:取KEGG 中最重要的Pathways in cancer 所包含的靶基因与MCC 功能获取的核心靶基因的交集靶基因。运用PDB 及PubChem 数据库下载交集靶蛋白和UA 小分子化合物的结构,并使用DockThor 在线工具进行分子对接。根据分子对接结果最终确定hub 靶基因并进行实验验证,进一步揭示UA 干预HIRI 的分子机制。
1.11 免疫组织化学法:首先依次将小鼠肝组织切片放入二甲苯、无水乙醇、蒸馏水中完成石蜡切片脱蜡。接着将组织切片置于盛满柠檬酸 (pH =6.0)液的盒中,把盒子放入微波炉进行抗原修复,中火加热8 min 至沸,停火8 min 保温再转中、温火加热7 min,自然冷却后将切片置于PBS(pH =7.4)中,并于脱色摇床上晃动洗涤3 次,每次5 min。然后将切片放入3%双氧水溶液室温避光孵育25 min 以阻断内源性过氧化物酶。接着在切片圈内均匀滴加3% BSA,室温封闭30 min。然后轻轻甩掉封闭液,在切片上滴加用PBS 稀释的PTGS2(1 ∶200)抗体,切片平放于湿盒内4 ℃孵育过夜。第2 天,切片用PBS 洗涤后在圈内滴加与一抗对应种属的二抗(HRP 标记)覆盖组织,室温孵育50 min。接着用PBS 洗涤切片后在圈内滴加新鲜配制的DAB 显色液,显微镜下控制显色时间,阳性为棕黄色,自来水冲洗切片终止显色。最后用苏木素复染细胞核,脱水封片。
1.12 统计学分析:免疫组化实验通过Histochemistry Score(H-Score)方法对每组3 个切片(n =3)的阳性染色强度进行定量分析。数据均采用one-way ANOVA 和Tukey’s post-hoc 统计学分析组间差异。P <0.05 为差异有统计学意义。
2 结 果
2.1 血清生化与肝组织HE 检测结果:将5 组动物实验的血清样本经全自动临床生化分析仪检测后,与Sham 组比较,HIRI 模型组小鼠血清中的ALT、AST 水平显著升高 (P <0.01),说明造模成功。与HIRI 模型组比较,HIRI+LUA、HIRI+HUA 组小鼠血清中的ALT、AST 水平明显降低(P <0.01),说 明UA 对HIRI 小 鼠 有 保 护 作 用。Sham 组 与Sham + HUA 组比较小鼠血清中ALT、AST 的变化没有统计学意义(P >0.05),说明UA 不会对正常小鼠肝组织造成损伤,表明UA 的安全性。HIRI+LUA 组与HIRI+HUA 组相比,没有统计学意义(P >0.05)。表明以20 ~40 mg/g(药物/小鼠体重质量)剂量范围UA 能起到保护小鼠HIRI 的作用,但没有剂量依赖性(图1A、1B)。本项目选用HIRI+LUA 组完成后续各组的免疫组化实验验证。
选取各组小鼠肝组织的切片做HE 染色,各组实验结果显示,与Sham 组比较,HIRI 组小鼠肝组织表现为不同程度的肿胀/坏死、脂肪变性、炎症细胞浸润等。与HIRI 组比较,HIRI+LUA 组小鼠肝组织病理现象逆转变好,表明UA 对小鼠HIRI有保护作用。Sham 组与Sham+LUA 组小鼠肝组织基本没有发生变化,表明UA 基本对正常小鼠肝组织不造成损伤(图1C ~1F)。

图1 UA 对HIRI 小鼠药效学及HE 检测结果
2.2 活性成分-HIRI 靶基因网络结果分析:将TCMSP 数据库下载获得的UA 小分子化合物结构以MOL2 格式上传至Pharm Mapper 服务平台进行靶点预测。将UA 化学成分的SMILES 上传到Swiss Target Prediction 数据库平台进行靶点预测。收集靶点,整理并去除重复项后以UniProt ID 表示,最终得到UA 的预测靶点共有 197 个靶点。
以“hepatic ischemia reperfusion injury”为 关键词在GeneCards 数据库获得1 117 个靶基因,并以UniProt ID 表示。与上述获得的197 个成分预测靶基因取交集,共得到36 个共有靶基因,然后利用Venn diagram 软件将其可视化(图2)。运用Cytoscape 3.7.2 软件绘制成分-HIRI 网络映射可视图,图中红色菱形节点表示UA 小分子化合物,蓝色圆形节点表示HIRI 相关的靶基因,绿色线条表示成分与疾病靶基因的相交线(图3)。

图2 UA 成分与HIRI 共有靶基因示意图
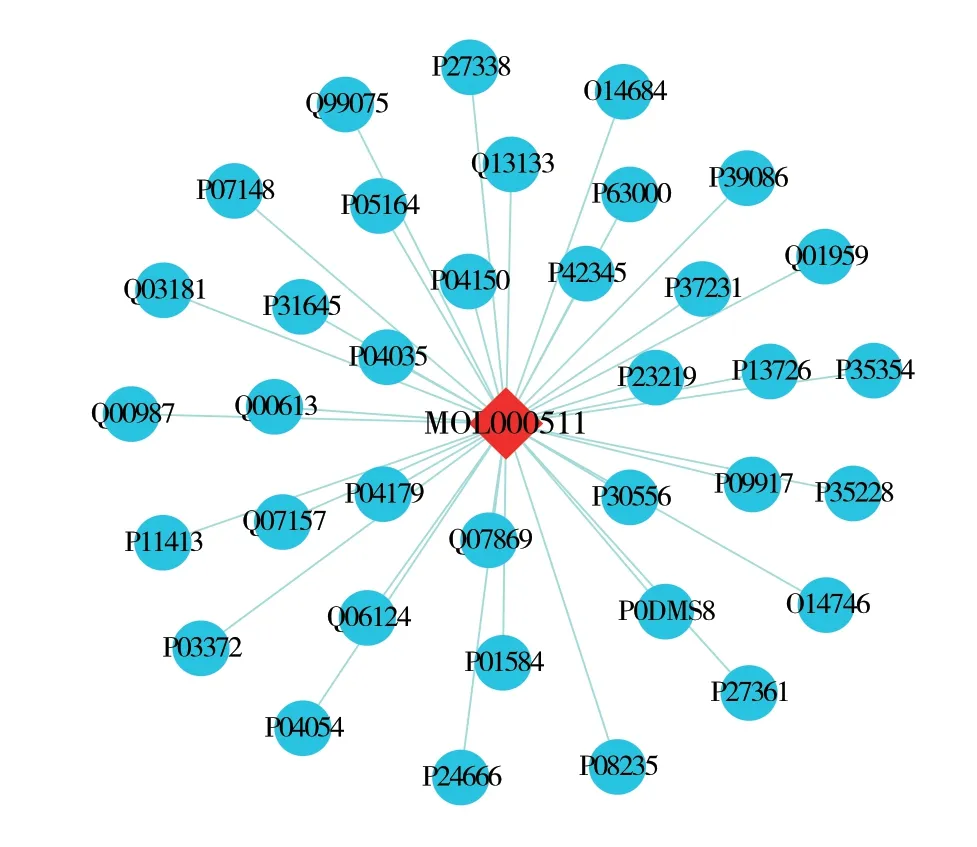
图3 UA 成分-HIRI 网络映射图
2.3 关键靶基因的初步获得:将在STRING 数据库获取的36 个交集靶基因的PPI 数据集导入Cytoscape3.7.2 软件并利用其插件cytoHubba中MCC 功能获得前10 个Hub 靶基因,分别为MAPK3(P27361)、P35354 (PTGS2)、PPARG(P37231)、PTGS1(P23219)、PLA2G1B(P04054)、ALOX5 (P09917)、IL1B (P01584)、MPO (P05164)、PTGES (O14684)、SOD2 (P04179)。
36 个交集靶基因使用DAVID 在线数据库设定P <0.01 为筛选条件共获得19 条KEGG 通路(图4)。得 分 最 佳 的Pathways in cancer 共 含 有9 个 靶 基 因,分 别 为MAPK3 (P27361)、PTGS2(P35354)、PPARG (P37231)、AGTR1 (P30556)、RAC1 (P63000)、PPARD (Q03181)、MDM2(Q00987)、MTOR (P42345)、NOS2 (P35228)。
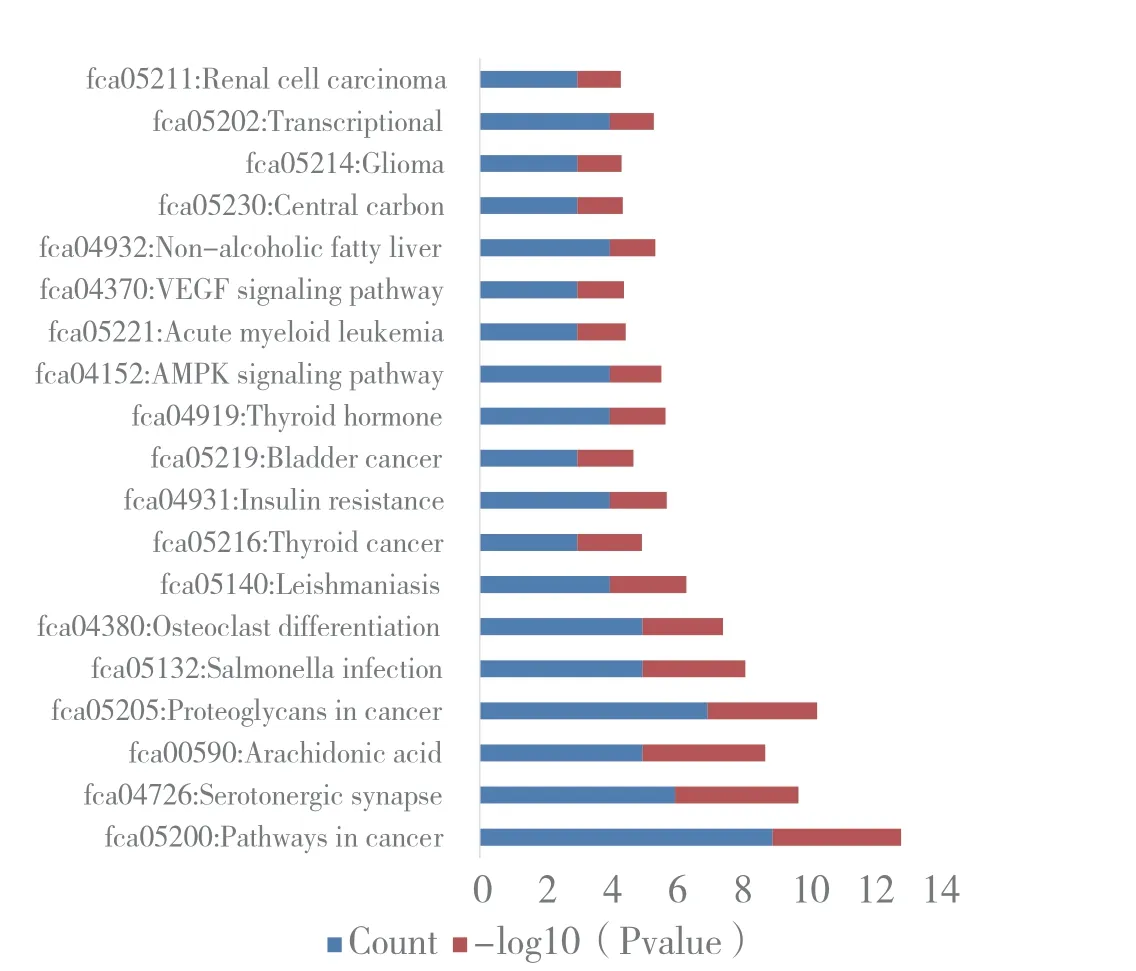
图4 成分与HIRI 交集靶基因KEGG 通路示意图
获取Pathways in cancer 通路与MCC 功能所含的交集靶基因分别为MAPK3、PTGS2 及PPARG(图5)。

图5 Hub 靶基因的获得
2.4 分子对接分析最终确定hub 靶基因:将从上述KEGG 与MCC 中得到的交集靶基因(MAPK3、PTGS2、PPARG)应用PDB 数据库获得其蛋白晶体结构,并上传至DockThor 在线分子对接工具。同时在PubChem 数据库下载UA 的3D 结构并以sdf 形 式 上 传 至DockThor,点 击Blind Docking 确定活性位点,进行分子对接,结果显示,UA 通过2 个氢键与PPARG、MAPK3 的活性位点结合形成复合物;UA 通过5 个氢键与PTGS2 的活性位点结合形成复合物(表1)。从表中数据可知:UA 与PTGS2 的对接得分最小且通过5 个氢键相互结合。可见,UA 与PTGS2 具有非常强的亲和力。所以本研究最终确定PTGS2 为最终的hub 靶基因(图6)。
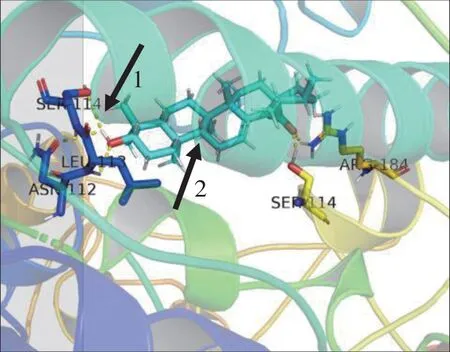
图6 UA 与PTGS2 分子对接结果

表1 UA 与靶基因的分子对接信息表
2.5 免疫组化实验结果分析:将Sham、Sham +HUA、HIRI 及HIRI + LUA4 组(n =3)切片经PTGS2(1 ∶200)免疫染色处理后,运用Histochemistry score (H-score)组织学评分方法将每张切片内阳性数量及其染色强度转化为相应的数值,达到对组织染色半定量的目的。H-score 为0 ~300 之间的数值,数值越大说明综合阳性强度越强[19-20]。结果表明,与Sham 组比较,HIRI 组中PTGS2 的表达显著上升(P <0.01),说明该靶基因在正常肝组织中低表达,在HIRI 时高表达;与HIRI 组比较,HIRI+LUA组中PTGS2的表达显著下降 (P<0.01),说明UA 通过降低这2 种靶基因的表达能保护小鼠HIRI;Sham 组与Sham+HUA 两组中PTGS2 的表达没有显著性差异(P >0.05),说明UA 对小鼠正常肝组织没有造成伤害(图7A ~E)。
3 讨 论
HIRI 是肝胆外科手术后发生肝衰竭和死亡的主要因素。限于目前针对HIRI 没有良好的防范措施,积极探索干预HIRI 的发病机制对提高手术成功率具有重要意义[21-25]。UA 是广泛存在于诸多天然植物中的一类五环三萜类化合物,具有显著的药理活性,对多种疾病已有很好的防范作用[11]。我们前期的药效学实验已经验证UA 对HIRI 小鼠具有保护作用。因而,我们应用生物信息网络药理学挖掘到PTGS2 是发生小鼠HIRI 的hub 靶基因,后续应用HE 染色和免疫组化实验对hub 靶基因进行了验证。
前列腺素内过氧化物合酶(prostaglandin G/H synthase,PTGS),又称为环加氧酶(cyclooxygenase,COX),是花生四烯酸代谢生成前列腺素的关键酶,在体内广泛分布。PTGS 有两种同工酶,一种为结构型表达的PTGS1(又称为COX1),另一种为诱导型表达的PTGS2(又称为COX2)。PTGS1与PTGS2 在各种组织的分布及表达调控各不相同[26-27]。其中PTGS2 在静息细胞与正常生理状态下的多数组织内低表达。但当组织或细胞收到相应的刺激,导致疼痛或炎症反应时,一般在24 h 内PTGS2 的表达会大幅度上升[28-29]。这一现象与我们的实验结果相一致。图7 免疫组化实验结果显示:与Sham 组相比,PTGS2 在HIRI 组的表达有非常显著的上升(P <0.01),表明PTGS2 可能是血管在遭遇缺血/再灌注损伤引起炎症反应中的生物标志物;与HIRI 组比较,HIRI+UA 组中PTGS2的表达水平显著下降(P <0.01),表明UA 通过氢键与PTGS2 蛋白活性位点结合形成复合物能很好地抑制、减轻了炎症反应,从而对HIRI 起到保护作用;与Sham 组相比,Sham+HUA 组中PTGS2的表达没有差异(P >0.05),表明UA 对正常小鼠肝脏组织没用造成伤害,说明UA 自身的安全性。但同时也存在些许的不足之处,比如:HIRI+LUA组、HIRI+ HUA 组与HIRI 组比较虽都能起到抑制PTGS2 表达的作用(P <0.01),但彼此之间的比较没有差异(P >0.05),也没有形成剂量依赖性。这些问题在后续的研究中会更缜密地探讨。

图7 免疫组化法验证PTGS2 在HIRI 小鼠肝组织中的表达
综上,本研究通过药效学实验确定UA 对HIRI有治疗作用,接着运用生物信息学筛查并获取hub靶基因,最后通过实验验证来阐明UA 通过下调PTGS2 分子机制起到对HIRI 小鼠的保护作用,同时对未来临床探究抗HIRI 的新药提供了理论参考。

