微波消解-石墨炉原子吸收光谱法测定食用菌中总砷
宋 玥 周天慧 张 萍 姚晓慧 刘丽萍* 韩丹丹
(1.河北大学 公共卫生学院,河北 保定 071002;2.北京市疾病预防控制中心,食物中毒诊断溯源技术北京市重点实验室,北京 100013;3.珀金埃尔默企业管理(上海)有限公司,上海 200131)
砷是公认的致癌物,人群主要通过受污染的饮用水、食品、空气等暴露砷[1]。长期低剂量暴露砷,可罹患皮肤癌等多种疾病。当土壤、水等环境中砷含量高时会对农作物造成污染,食用受砷污染的食品将对健康造成严重危害。我国对食品、饮用水中砷的限量进行了严格的规定。
食用菌以其独特的美味成为人们日常喜爱的食品,研究表明食用菌易积累各种重金属,文献[2]报道食用菌极易富集砷。食品安全国家标准 GB 2762—2017《食品中污染物限量》中规定,食用菌中总砷限量为0.5 mg/kg,《食品安全国家标准 食品中总砷及无机砷的测定》GB 5009.11—2014中砷的检测方法有电感耦合等离子体质谱法(ICP-MS)、氢化物原子荧光光谱法、银盐法。ICP-MS操作简便、灵敏度高,是目前元素分析最强有力的分析技术[3],但也因其价格昂贵、氩气消耗量高,限制了其广泛使用;氢化物原子荧光光谱法虽广泛应用于不同的实验室[4],但由于检测原理的要求,样品前处理时需将样品中不同形态的砷全部消解为三价砷或五价砷,对于砷形态复杂的食用菌,样品前处理繁琐,消解时间长,简便快捷的微波消解技术的使用受到限制;银盐法灵敏度低,操作烦琐,适用性差。
石墨炉原子吸收光谱法具有灵敏度高、选择性好等优势,广泛应用于食品中铅、镉的分析检测。以往由于砷的空心阴极灯能量低,限制了石墨炉原子吸收测定砷的使用,随着砷的高性能灯、无极放电灯的推出和使用,目前石墨炉原子吸收光谱法已应用于食用油[5-6]、茶叶[7]、土豆[8]、保健品[9]、大米[10]、鸡肉[11]、乳及乳制品[12]、高盐食品[13]、天然药材[14]等样品中总砷的测定。食用菌中总砷超标被屡屡报道[15],研究表明不同食用菌中砷形态复杂[16-18],本文采用微波消解-石墨炉原子吸收光谱技术对食用菌中总砷进行分析研究,为不同实验室测定食用菌中总砷提供一种快速、准确、经济的方法。
1 实验部分
1.1 仪器与试剂
美国PerkinElmer公司PinAcle900T原子吸收光谱仪(附自动进样器和石墨炉),砷无极放电灯,iCAP RQ 型电感耦合等离子体质谱仪、U3000型HPLC高效液相色谱仪、Dionex IonPac AS7 色谱柱(4 mm×250 mm)赛默飞世尔科技有限公司;Milli-Q Integral超纯水处理系统(美国Millipore公司),Mettler Toledo电子天平,TOPEX+ 微波消解仪、G-400赶酸仪(上海屹尧仪器科技发展公司),Grinder HM100 研磨仪,德国MMM公司Venticell高温烘箱。
砷标准储备液(100 mg/L,中国计量科学研究院),硝酸(65%,德国Merck),过氧化氢(30%,国药集团化学试剂有限公司),碳酸铵(优级纯),硝酸钯[Pd(NO3)2,1 g/L],亚砷酸根As(Ⅲ,GBW08666)、一甲基砷酸(MMA,GBW08668)、二甲基砷酸(DMA,GBW08669)、砷酸根As(V,GBW08667)、砷甜菜碱(AsB,GBW08670)、砷胆碱(AsC,GBW08671)等砷形态标准溶液均购于中国计量科学院。实验中所用试剂为优级纯,分析用水均为超纯水。
1.2 样品前处理
将市场购买的食用菌(干剂)样品去除不可食部分,粉碎研磨均匀后储存于聚乙烯管中。称取粉碎均匀的食用菌试样0.25 g(精确到0.000 1 g)于微波消解罐中,加入6 mL硝酸和1 mL过氧化氢,预消解2 h,放入微波消解系统中按微波消解程序(见表1)进行消解。消解完全后于140 ℃赶酸至0.5 mL,用超纯水定容至25 mL,混匀待测,同时做空白实验。

表1 微波消解程序Table 1 Microwave digestion procedure
1.3 仪器工作条件
测定时采用塞曼背景校正,硝酸钯(1 g/L)为基体改进剂,进样体积为5 μL,样品进样体积为20 μL,石墨炉原子吸收光谱仪的工作条件设定为:波长193.7 nm,灯电流(无极放电灯)440 mA,狭缝 0.7 nm。石墨炉升温程序见表2。

表2 石墨炉升温程序Table 2 Furnace program
2 结果与讨论
2.1 样品前处理方法的选择
测定总砷时样品前处理方法主要有微波消解法、电热板消解法、干灰化法、石墨消解法。采用原子荧光光谱法测定砷时由于原理所限,不同样品中砷的存在形式不同,一般选择电热板消解、干灰化法或石墨消解法,保证样品消解完全至关重要。石墨炉原子吸收光谱法测定样品中总砷时,其原子化阶段的高温可以将不同形态的砷原子化。由于干灰化法时需要加入灰化辅助剂,会引入过多的干扰,避免选用。电热板和石墨消解法操作繁琐,需要加入大量强酸,且消化时间长;微波消解法操作简单,消解能力强,用时短[19]。本文选择微波消解进行样品前处理,由于样品消解后消解液中的酸浓度较高,测定时会导致较高的背景,且也会对石墨管造成不可逆的损坏,因此消解后要进行赶酸处理[20]。经对赶酸温度进行优化,结果表明赶酸温度低于120 ℃时,赶酸时间过长,影响工作效率;赶酸温度高于150 ℃时,不好把控赶酸的终点,也会造成砷的损失。经实验选择赶酸温度为135~145 ℃,3 h可完成赶酸过程。
2.2 样品预处理选择
实验发现个别干剂食用菌样品基质复杂,背景吸收较高,无法准确测定砷含量。进一步研究发现消解液中残存少许无机盐,可能为样品预处理不完全所致,带入了外源性的土壤颗粒等杂质,影响了测定的准确性,经对干剂食用菌进行泡发,除去根部粘带的土壤颗粒等杂质,可消除此现象。建议干剂食用菌预处理时一定要去除食用菌根部粘带的杂质,取可食部分进行预处理,粉碎均匀,保障样品的代表性。
2.3 基体改进剂的选择
基体改进剂不仅能改善基体性能,使基体转化为易挥发的化学形态,以利于在灰化阶段驱尽,且能改善被测元素的性能,使之转化为更稳定或更易挥发的形态,以使用更高的灰化温度除尽基体杂质而被测元素又不损失,或先于基体挥发以避免基体的干扰。砷是易挥发元素,需要加入基体改进剂,提高灰化温度,降低背景干扰。钯和镍都可以提高灰化温度,但是钯的灵敏度比镍高[21]。硝酸钯是石墨炉原子吸收光谱法测定砷的常用基体改进剂[22-24],其能与待测组分砷结合成更稳定的化合物,有效提高灰化温度,降低背景干扰。本实验选择硝酸钯为基体改进剂,测试了无基体改进剂和加入基体改进剂硝酸钯时食用菌消解液的吸光度,结果见图1,不加基体改进剂时,待测元素损失较多,背景峰很高,无法准确测定。

图1 未加基体改进剂和加入基体改进剂时样品消解液的吸收峰和背景峰Figure 1 The absorption peak and background peak of sample digestion solution without and with matrix improver.
对基体改进剂硝酸钯浓度进行优化,分别配制0.1、0.5、1.0、1.5和2.0 g/L的硝酸钯溶液进行实验,结果见图2和图3,硝酸钯作为基体改进剂时,浓度在0.5、1.0、1.5和2.0 g/L时对吸光度的影响差别不大,但是1 g/L的峰形图最好,因此本研究选用1 g/L硝酸钯作基体改进剂。
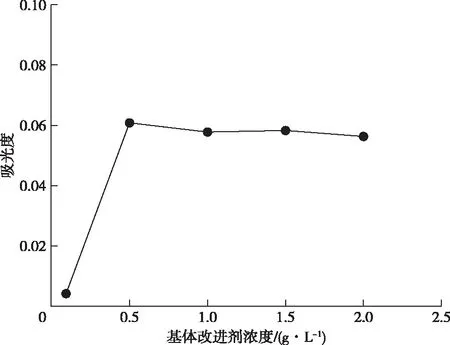
图2 基体改进剂浓度与吸光度曲线图Figure 2 Matrix improver concentration and absorbance curve.
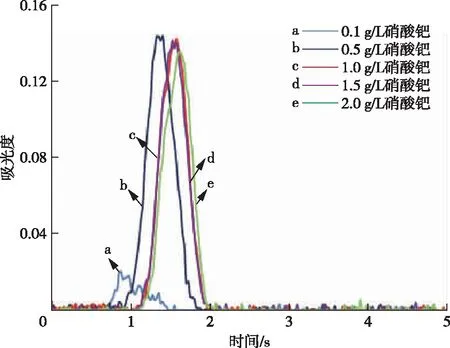
图3 不同浓度基体改进剂中食用菌样品消解液的峰形图对比Figure 3 Comparison of peak patterns of digestion solution of edible mushrooms samples in different concentrations of matrix improvers.
2.4 石墨炉升温程序的优化
灰化温度和原子化温度是石墨炉原子吸收光谱法分析中的两个关键温度。
2.4.1 灰化温度的选择
灰化的作用是尽量将与被测元素共存的基体除去,避免在原子化阶段对目标元素的原子化效率产生影响,同时防止基体成分在测定波长区域产生非特征的背景吸收。灰化温度过高会造成被测元素的损失,使方法灵敏度降低;灰化温度过低,会造成背景偏高,且对原子化阶段产生干扰。
分别在800~1 400 ℃测定某食用菌样品,如图4和图5所示,实验结果表明,灰化温度在1 200 ℃时吸光度高,峰形较好,因此选择1 200 ℃作为灰化温度进行后续实验。
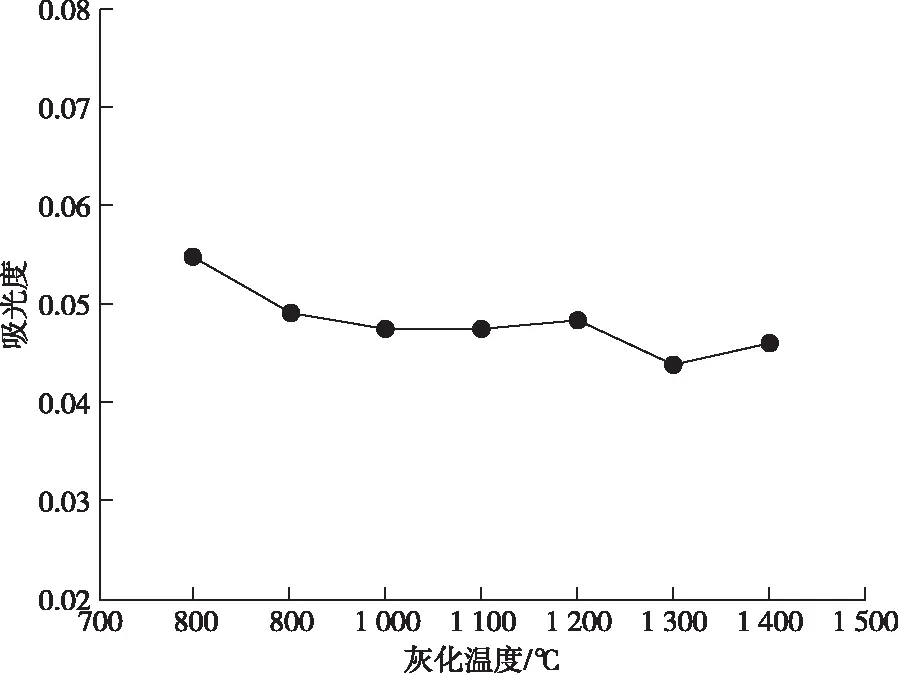
图4 灰化温度对吸光度的影响Figure 4 The effect of pyrolysis temperature on absorbance.

图5 不同灰化温度的峰形图对比Figure 5 Comparison of peaks at different ashing temperatures.
2.4.2 原子化温度的选择
原子化阶段的目的是将处于分子或离子状态的目标元素通过热分解的作用使其变成处于基态的自由原子。原子化温度过高,导致噪音增加及石墨管寿命降低;原子化温度过低,会使吸收峰变的平坦且吸光度值变小。
分别在1 900~2 400 ℃测定某食用菌样品,如图6和图7所示,实验结果表明,原子化温度在2 300 ℃时吸光度较高,峰形较好,因此选择2 300 ℃为原子化温度。

图6 原子化温度对吸光度的影响Figure 6 The effect of atomic temperature on absorbance.

图7 不同原子化温度的峰形图对比Figure 7 Comparison of peaks at different atomization temperatures.
2.5 方法学考察
2.5.1 线性范围及检出限
采用砷标准溶液逐级稀释后分别配制成浓度为0、2.0、4.0、8.0、10.0、12.0、16.0、20.0和30.0 μg/L的标准系列溶液进行线性范围实验,线性方程见表4。采用空白溶液测定检出限,测定11次空白溶液,根据检出限计算公式LOD=3SD/b(b为工作曲线斜率)和定量限计算公式LOQ=10SD/b(b为工作曲线斜率)测得检出限为0.4 μg/L,定量限为1.30 μg/L,当样品取样量为0.25 g,定容体积为25 mL时,方法检出限为0.04 mg/kg,方法定量限为0.13 mg/kg,结果见表3。

表3 线性范围及检出限Table 3 Linear range and detection limit
2.5.2 方法的准确性和重现性实验
以精密度考察方法的重现性,以加标回收实验和有证标准物质考察方法准确性。
2.5.2.1 精密度和加标回收实验
选用市售香菇和银耳,分别添加三个不同浓度水平的砷标准溶液进行加标回收和精密度实验,实验结果显示三个浓度水平的加标回收率均在80.6%~104%。三个浓度水平的相对标准偏差RSD均小于6.6%,结果见表4。

表4 香菇、银耳加标回收率和精密度Table 4 Spiked recovery and precision of lentinus edodes and tremella (n=6) /(mg·kg-1)
2.5.2.2 实际样品的精密度
选取三个不同浓度砷含量的食用菌样品进行方法精密度考察,平行制备6个样品,测定总砷含量,结果见表5,RSD值均小于5.0%。

表5 实际样品精密度测定结果Table 5 Actual sample precision measurement results (n=6) /(mg·kg-1)
2.5.2.3 有证标准物质测定
由于没有含砷高的食用菌基体标准物质,采用其他基质的有证标准物质考察方法的准确性,测定结果见表6。结果显示,测定值均在标准值范围内。

表6 标准物质测定结果Table 6 Standard material determination results(n=6) /(mg·kg-1)
2.6 实际样品的分析
采集市售食用菌样品,按所建方法进行样品中总砷含量测定,结果如表7所示。

表7 实际样品测定结果Table 7 Actual sample determination results
GB 2762—2017规定,食用菌及其制品总砷限量指标为0.5 mg/kg,编号为Y3、Y6、Y7、Y8的食用菌已超出限量范围,属超标样品。由于石墨炉测定砷含量线性范围较窄,对于砷含量较高,超过标准曲线范围的样品应稀释到标准曲线范围内再进行测定,以得到准确可靠的结果。如图8和图9所示,样品稀释后的背景峰更低,吸收峰形更好。

图8 Y6与Y6稀释5倍后的吸收峰和背景峰对比图Figure 8 Contrast diagram of absorption peak and background peak of Y6 and Y6 diluted by 5 times.

图9 Y7与Y7稀释5倍后的吸收峰和背景峰对比图Figure 9 Contrast diagram of absorption peak and background peak of Y7 and Y7 diluted by 5 times.
2.7 砷含量高的食用菌样品分析
为了研究微波消解后消解液中砷的形态,选取5个砷含量超过0.4 mg/kg的样品经微波消解后的消解液过0.45 μm滤膜后,采用高效液相色谱-电感耦合等离子体质谱法(HPLC-ICP-MS)测定其砷形态(色谱条件:Dionex IonPac AS7色谱柱;流动相A相:10 mmol/L碳酸铵;B 相:100 mmol/L碳酸铵;洗脱方式:梯度洗脱)。结果见图10,样品编号为Y6和Y8的食用菌样品消解液中AsB含量高,为主要砷存在形式,样品编号为Y3、Y7和Y9的食用菌样品消解液As(V)含量高,为主要砷存在形式。
实验表明,不同的食用菌样品经微波消解赶酸后,砷形态仍然复杂,若采用原子荧光光谱法测定该类样品,不能采用微波消解进行样品前处理,否则会造成测定结果偏低,特别是编号Y6和Y8食用菌,可能会出现假阴性。而采用石墨炉原子吸收光谱法测定总砷时可以采用微波消解进行样品前处理,快速准确测定有机砷含量高的食用菌样品中总砷含量。

图10 食用菌样品砷形态色谱图(a—Y3,b—Y6,c—Y7,d—Y8,e—Y9)Figure 10 Arsenic chromatogram of edible mushrooms samples(a—Y3,b—Y6,c—Y7,d—Y8,e—Y9).
3 结论
采用微波消解-石墨炉原子吸收光谱法测定食用菌中总砷含量。通过优化灰化温度、原子化温度、基体改进剂的浓度等条件,与HGAFS相比,该方法在样品前处理时无需将食用菌样品中不同砷形态全部转化为无机砷,大大缩短了食用菌样品前处理的时间。实验结果表明,方法具有操作简便、经济、准确、可靠等优点,适用于食用菌中总砷含量的测定。但方法线性范围较窄,对于砷含量高的样品需稀释到标准曲线范围内测定才能保证测定的准确性。

