东印度洋、南海海域鸢乌贼种群遗传结构研究
赵 炎,王丛丛,2,3,4,5,刘必林,2,3,4,5,林龙山,李 渊
(1.上海海洋大学海洋科学学院,上海 201306;2.大洋渔业资源可持续开发教育部重点实验室,上海 201306;3.国家远洋渔业工程技术研究中心,上海海洋大学,上海 201306;4.农业农村部大洋渔业开发重点实验室,上海 201306;5.农业农村部大洋渔业资源环境科学观测实验站,上海 201306;6自然资源部第三海洋研究所,福建厦门 361005)
鸢乌贼(Sthenoteuthis oualaniensis)隶属于软体动物门(Mollusca),头足纲(Cephalopoda),鞘亚纲(Coleoidea),枪形目(Teuthoidea),柔 鱼科(Ommastrephidae),鸢乌贼属,广泛分布于赤道太平洋、印度洋等海域,其中以印度洋西北部和中国南海海域资源最为丰富[1-2]。鸢乌贼作为次要经济种,潜在资源量尤为可观,南海鸢乌贼潜在资源量约为457万t[3],西北印度洋鸢乌贼潜在资源量约为1 000万t[4],具有极大的潜在商业价值。近年来,关于鸢乌贼的渔业资源[5-6]、渔业生物学[7]、营养生态位[8]、角质颚生长特性[9]、耳石微结构及微量元素[10-12]等方面的研究日趋完善。
鸢乌贼种群结构十分复杂,种群内除了不同产卵群外,尚具有不同的体型群,且分布较为广泛。刘金立等[13]对西北印度洋海域两个鸢乌贼种群的遗传结构进行分析,发现两个种群内遗传变异较高,且种群遗传背景差异显著。李敏等[14]利 用 线 粒 体NADH(nicotinamide adenine dinucleotide)脱氢酶亚基2基因(ND2)的全序列对南海两个表型群遗传结构进行研究,发现两个种群之间存在显著遗传分化,但是各类群分布范围高度重合,不存在地理差异。刘连为等[15]采用线粒体细胞色素b基因对东海、南海与菲律宾3个地理区域的鸢乌贼群体进行遗传研究发现,3个地理群体间遗传差异显著,在渔业管理上应划分为不同单元。李敏等[16]利用线粒体ND2、细胞色素氧化酶I(cytochrome oxidase subunit I,CO I)和16S核糖体DNA序列对南海的鸢乌贼进行种群遗传结构分析,研究发现,该海域两个形态学群体(中型群和微型群)分布区域重合但是遗传分化显著,其中中型群和微型群遗传分化达到种间水平,揭示该海域地理群体分布不单一的现象。
总体而言,关于鸢乌贼的遗传结构研究主要集中在南海、印度洋西北部和太平洋海域[13-17],缺乏对东印度洋鸢乌贼的研究,且该海域鸢乌贼群体与其他海域群体间的关系也尚不明确。东印度洋赤道海域洋流模式复杂[18],使得东印度洋赤道海域可能存在不同的种群遗传模式。Cytb基因是广泛应用于种群遗传结构研究以及分子系统地理学研究重要分子标记[19-21]。因此,本研究采用Cytb基因序列来检测东印度洋赤道和南海海域的鸢乌贼种群遗传结构,以期填补东印度洋海域研究空缺,也期望为鸢乌贼渔业资源的可持续利用提供基础。
1 材料与方法
1.1 站点位置与采样时间
本研究所用鸢乌贼样本共120尾,其中鸢乌贼群体1(东印度洋北部)、2(东印度洋南部)采集于东印度洋赤道海域(60尾,88°E~92°E、2°N~5°S),群体3(南海南部)、4(南海北部)采集于南海海域(60尾,112°E~117°E、11°N~20°N),存放于船舱冷库并运回实验室。采样及分组情况见表1。
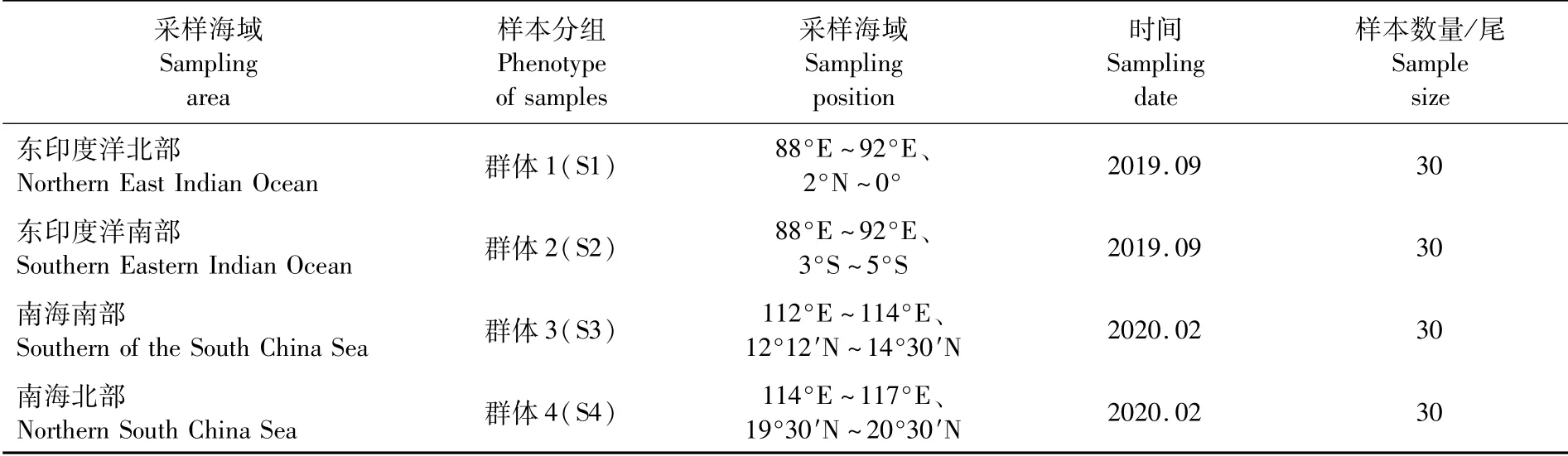
表1 鸢乌贼样本站点信息Tab.1 Sample site information of S.oualaniensis
1.2 实验方法
1.2.1 基因组DNA提取
实验中剪取背部或腹部肌肉组织,置于无菌离心管中,保存于冰箱备用。采用海洋动物组织基因组DNA提取试剂盒(广州东盛生物科技有限公司)提取鸢乌贼基因组DNA,用1%琼脂糖凝胶电泳检测提取的DNA质量,用紫外分光光度计检测(NanoDrop2000C)DNA浓度以及纯度A260/A280值,-80℃超低温冰箱保存备用。
1.2.2 PCR扩增与测序
参照NCBI(National Center for Biotechnology Information)上传的鸢乌贼线粒体DNA序列中Cytb基因,序列号:NC_010636.1,使用Primer5.0软件自行设计引物。引物序列为:
上游引物F:TGTTTAGTCGTTCAAGTGGCT
下游引物R:ACACTCAACACTCGACCGATC
PCR(polymerase chain reaction)反应体系为25μL体系,其中Taq PCR Master Mix(2×)15 μL,上下游引物(10μmol·L-1)各1μL,DNA模板0.1μL,用ddH2O补足至25μL。PCR反应程序:预变性94℃、2 min;变性94℃、30 S,退火58℃、45 S,延伸72℃、45 S,30个循环;最后延伸72℃、2 min。PCR产物经过1%琼脂糖凝胶电泳检测,并用紫外分光光度计(NanoDrop 2000C)检测其浓度和A260/A280值。选取合格样本送至生工生物工程(上海)股份有限公司进行纯化并进行双向测序。
1.3 数据分析
测序结果经过拼接之后,使用MEGA 7.0软件进行校对并加以人工比对,序列整理校对之后计算DNA的碱基组成、个体间以及种群间的遗传距离。使用DNASP 5.0软件计算单倍型多样性指数(h)、单倍型数、核苷酸多样性指数(π)等遗传多样性指数。构建单倍型NJ(neighborjoining tree)进化树和最小跨度树,揭示不同单倍型之间的连接关系,由NetWork 10.2软件完成。利用Arlequin 3.5.2软件进行AMOVA(analysis of molecular variance)、两两群体之间的遗传分化系数Fst(F-statistics)(重复次数1 000次)、Tajima’s D和Fu’s Fs中性检验和核苷酸不配对分布的估算。
2 结果与分析
2.1 Cytb基因片段序列分析
实验结果分析校对之后共获得120条序列,长度为757 bp,T、A、C、G碱基平均含量分别为36.9%、30.3%、15.2%、17.6%,其中A+T含量(67.2%)明显高于C+G含量(32.8%)(表2)。在120条Cytb基因片段中共检测到484个变异位点,其中包括单碱基变异位点31个,简约信息位点453个,无插入和缺失,转换和颠换分别为90个和109个。全部120条分析的序列一共定义了84个单倍型,其中单倍型H1、H5为S1和S2共有,单倍型H43、H44、H47、H49和H52为S3和S4共有;单倍型H2和H9为S1独有,单倍型H22为S2独有,单倍型H46为S3独有,单倍型H81为S4独有;其余单倍型仅为群体中单个个体具有,且没有4个群体共享单倍型。
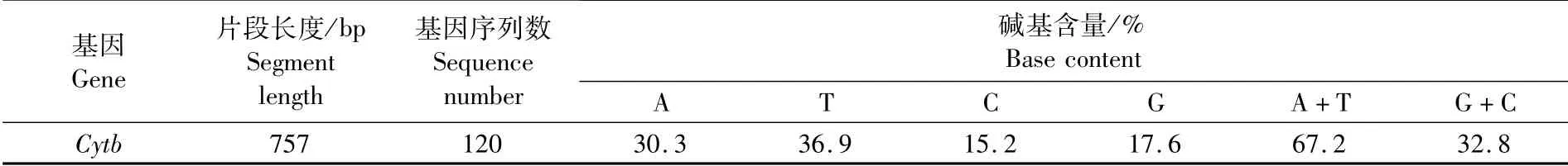
表2 鸢乌贼Cytb基因片段序列组成Tab.2 Sequence composition of Cytb gene of S.oualaniensis
2.2 种群遗传多样性
基于Cytb基因片段所有序列得到的4个群体总的单倍型多样性指数(h)、单倍型数、核苷酸多样性指数(π)和平均核苷酸差异数(k)分别为0.981、84、0.273 32、196.794。由表3可以看出,S3、S4的单倍型多样性指数、核苷酸多样性指数和平均核苷酸差异数均高于S1和S2,尤其是核苷酸多样性指数和平均核苷酸差异数显著高于其他两个群体。
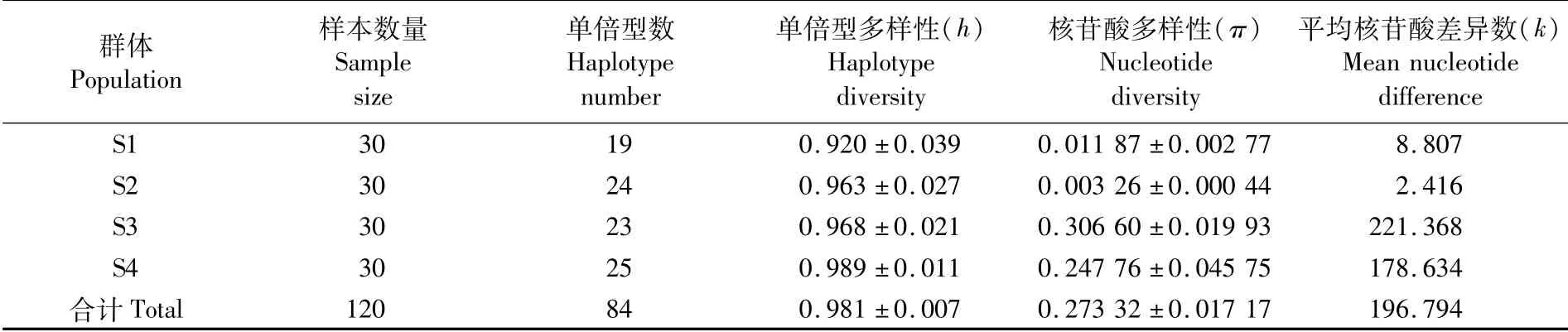
表3 基于Cytb基因片段序列的鸢乌贼遗传多样性Tab.3 Genetic diversity index of S.oualaniensis based on Cytb sequence
AMOVA分析结果表明,来自群体间的遗传变异为54.90%,且遗传分化显著(P<0.01),来自群体内部的遗传变异为45.10%,地理隔离导致的遗传变异要略高于群体内部个体间的变异(表4)。

表4 基于Cytb基因序列的鸢乌贼群体AMOVA分析Tab.4 AMOVA analysis of S.oualaniensis based on Cytb sequence
评估群体间的遗传分化常用遗传分化系数(Fst),其取值范围在0~1之间,数值大小与遗传分化程度成正比[22]。根 据WRIGHT和MAXSON[23]的研究,本文中两两群体间的Fst分析表明(表5),S1与S2两个群体间有中等程度遗传分化;S3与S4两个群体间没有遗传分化;东印度洋群体S1和S2与南海群体S3和S4之间遗传分化很大。
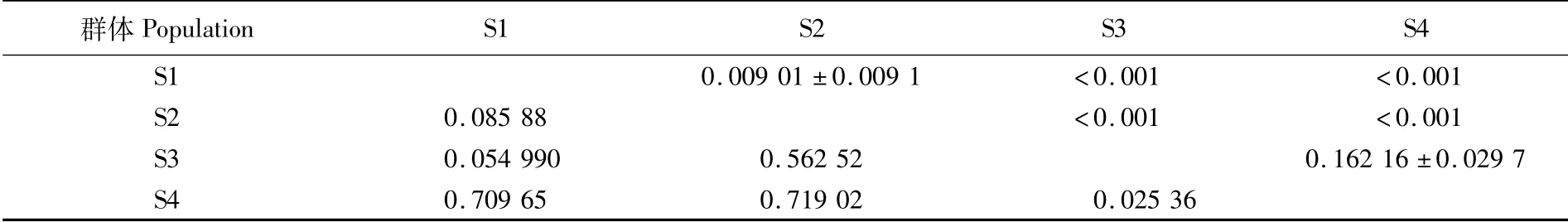
表5 基于Cytb基因序列的鸢乌贼群体间遗传分化系数(F st)分析Tab.5 F-statistics(F st)analysis among populations of S.oualaniensis based on Cytb sequence
基于Cytb基因序列构建的分子系统发育树显示,120个个体聚为3类。绝大多数S1、S2聚为一类;S1中有5个个体与S3、S4部分个体亲缘关系较近;剩余S3、S4个体聚为一类(图1)。Cytb单倍型最小跨度树呈现星状结构,单倍型之间通过多步突变或单一突变彼此相连接,S1和S2形成一个单倍型组群,S3和S4形成两个单倍型组群(图2)。

图1 基于Cytb基因序列的鸢乌贼分子系统发育树Fig.1 Phylogenetic tree of S.oualaniensis based on Cytb sequence
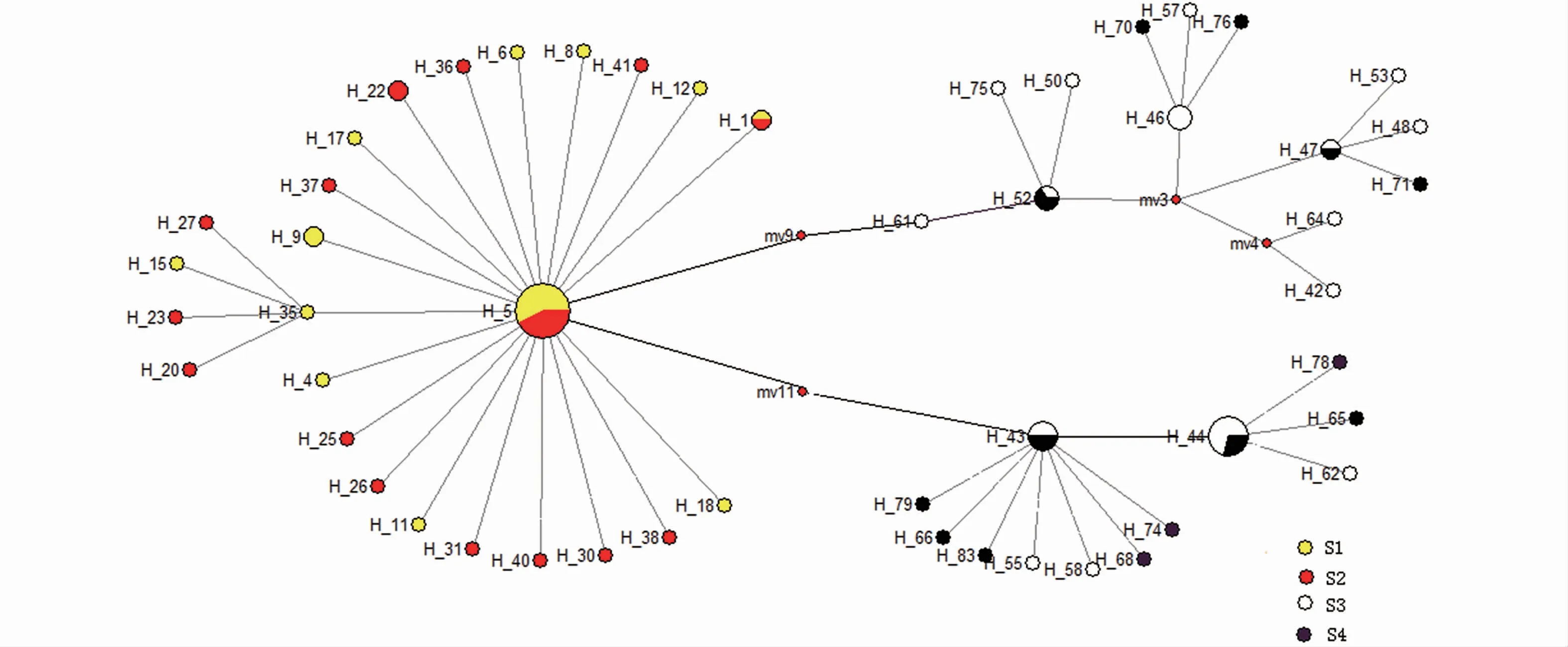
图2 基于Cytb基因序列的鸢乌贼单倍型最小跨度树Fig.2 Reduced median network showing genetic relaionship in S.oualaniensis based on Cytb sequence
2.3 群体历史动态
Tajima’s D和Fu’s Fs中性检验的D值和Fs值均为负值,且统计检验如果均显著,就可以证明该鸢乌贼群体近期内可能经历过历史扩张。结果表明(表6),仅S2满足该条件,对该群体核苷酸不配对分布进行分析可得,核苷酸不配对分布图呈现单峰类型(图3),S1、S3、S4均呈现双峰。上述结果显示,S2群体可能经历群体扩张。核苷酸分歧速率按照2.15%/百万年~2.60%/百万年,基于Cytb核苷酸不配对分布可以得到τ值为2.429,计算得到S2的种群扩张时间为7.3万年前—6.1万年前。

表6 鸢乌贼Cytb序列的中性检验Tab.6 Result of neutrality test on Cytb sequences of S.oualaniensis
3 讨论
3.1 种群遗传多样性及种群遗传结构
Cytb分子标记由于进化速率适中,已经广泛应用于柔鱼种群内、种群间遗传研究,进行遗传多样性分析[24-26]。其中根据Cytb核苷酸的分歧速率,常常被用来估算种群的历史扩张事件[27]。基于Cytb分子标记分析发现,鸢乌贼两个地理群体(东印度洋赤道、南海)均具有较高的单倍型多样性(h=0.981)和核苷酸 多 样 性(π=0.273 32),说明两个群体遗传多样性较高,遗传资源丰富,这可能与鸢乌贼生命周期短、生长速度快、产卵周期较长且孵化期贯穿全年等生活史特性有关[28]。两个地理群体核苷酸多样性存在显著差异,南海群体(π=0.277 18)和(k=200.001)远高于东印度洋群体(π=0.007 57)和(k=5.612),反映出每条序列间碱基组成差异巨大,极有可能是南海海域群体组成不单一,中型群和微型群多个种群交叉存在。
东印度洋三面皆是陆地,南部则是开阔的海洋,因此形成了很多独特性质,主要表现在它具有季风海洋的特点,在季风影响下,洋流系统复杂多变。在印度洋季风转换期春季和秋季(4—5月、10—11月),印度洋赤道海域附近会出现一支自西向东的强流-赤道急流(Wyrtki),也有报道称其核心位置在赤道偏南[18],影响深度在50 m左右。与此同时,赤道以南有一支自东向西的洋流-南赤道流,以及东西两个边界流,共同组成了一个顺时针的闭合环流。在印度洋夏季和冬季(6—9月、12—3月),赤道附近的赤道急流消失,夏季赤道北部的莫桑比克海流与赤道以南的南赤道流、以及东西两个边界流,构成一个环流系统。冬季,赤道以北的西北向东北季风流,和赤道偏南的南赤道流被赤道附近东向的南赤道逆流分隔开[29](图4)。南海海域地处热带西太平洋的边缘地带,与其他大洋相比,是一个半封闭性的海域,因此也具备了某些大洋的特征,也是一个典型的季风海洋[30]。南海海域群体S4主要受到南海暖流和广东沿岸流影响[31],S3群体所处海域受季风影响,容易形成涡流(图5)。基于东印度洋复杂的海流变化,导致赤道南北群体之间产生一定的遗传分化,特别是冬季的南赤道逆流则把赤道两侧阻隔。而在夏季,北部的莫桑比克海流则有可能穿过S1群体进入马六甲海峡,从而有可能与南海海域群体发生基因交流。这也很好地解释了本研究中鸢乌贼群体组成不是单一群体的原因。

图4 热带东印度洋海流图(此图参照WU等[33]的图13)Fig.4 Tropical East Indian Ocean current chart(This figure refers to figure 13 in WU et al[33])

图5 南海海流图(此图参照何映辉等[30]的图3)Fig.5 South China Sea current chart(This figure refers to figure 3 in He et al[30])
基于遗传距离绘制的鸢乌贼个体系统发育树显示,东印度洋北部海域S1群体中的个体2、3、4、6、25与南海海域S3、S4部分个体遗传距离较小,而东印度洋南部海域S2群体则没有类似情况,推测东印度洋北部群体S1部分个体可能通过马六甲海峡与南海海域部分个体有一定的基因交流,而印度洋南部海域受赤道逆流影响,从而与南海海域群体交流困难。这也与鸢乌贼分布广泛以及有较强的游泳能力相关[1]。S3和S4个体互相交织,但是形成两个支系,也印证了表3中k值和π值的异常数据。
两两群体的Fst显示,东印度洋北部群体S1与南部群体S2之间Fst=0.085 88、南海南部群体S3 Fst=0.549 90、南海北部群体S4 Fst=0.709 65,显示两个地理群体之间的遗传差异显著,但是S1与S3之间的Fst小于S1与S4的,与遗传距离显示的结果一致。南海海域两个群体(Fst=0.025 36),没有遗传差异,但是有一定的遗传距离(0.597),且图3中,南海两个采样群分化为两个支系,但是均包含两个群体的样本,这也印证了南海海域种群结构复杂,与李敏等[16]研究该海域种群高度重合、但是种间遗传差异显著的结果相一致。图4中S3、S4有明显的双峰,极有可能是每个采样群包含了有遗传差异的连个群体,每个群体对应一个峰。总体而言,东印度洋赤道北部群体S1和南部群体S2之间遗传距离要远远小于东印度洋与南海之间的遗传距离,说明地理隔离影响效应可能要远远超过洋流对其的影响。
大洋性柔鱼的群体遗传学研究主要依赖于形态学标记,划分不同种群结构的有效方法之一是依据其外部形态特征来进行判断[32]。但是,种群结构的差异往往与性别、年龄、产卵季节、性成熟胴长等诸多因素有关,稳定性不高[33]。因此,形态学与分子标记相结合,一起对其群体进行遗传变异分析会更为准确。今后有必要增加形态学数据对分子标记结果加以佐证。同时,增加马六甲海峡海域的鸢乌贼样本能更好地证明以上的结果。
3.2 系统发育地理格局和群体历史动态
系统发育地理格局和群体历史动态隶属于分析系统地理学,其针对种群历史性的进化特征进行推论,得出相应的结论[27]。基于S2鸢乌贼种群Cytb单倍型核苷酸不配对分布的τ值为2.429,计算可得S2鸢乌贼种群发生种群扩张事件的时间在7.3万年前—6.1万年前,处于末次冰期(7.5万年前—1万年前)[34]。在过去100万年间,地球经历了一系列周期为10万年的冰期-间冰期变化,伴随着每次冰期,海平面下降的峰值可达120~140 m[35],冰期的温度要比间冰期低3~4℃[36]。全球气候变化以及海洋环境因子的变化对众多海洋生物的空间结构分布产生了深远影响,从而形成了当今格局。
4 小结
本研究通过对东印度洋赤道南北海域、南海南部、北部海域120尾鸢乌贼个体的Cytb基因研究,揭示了东印度洋赤道海域群体和南海海域群体遗传分化显著,在渔业管理上应该看作两个独立的单元管理,进而更好地保护种群多样性。而东印度洋赤道两侧群体出现中等程度的遗传分化,未来可增加马六甲海峡海域的鸢乌贼样本以更好地验证本文的推测。
本研究所用Cytb基因片段只能反映母本的种群遗传分化特征,而不同的基因片段进化速率及其所展现的系统发育信息存在一定差异,今后有必要整合其他基因片段或基因组DNA数据,更全面地反映种群遗传结构信息。而且今后可以增加形态学数据信息,结合形态学所反映的种群结构信息,更加深入地了解鸢乌贼的种群遗传结构。

