PLA2R-IgG间接荧光定量免疫层析分析的构建与应用*
张艺 周颖 周衍 马骐 叶燕 殷皓 俞蕾 周彬 王春新*
(1)江苏省原子医学研究所,国家卫生健康委员会核医学重点实验室,江苏省分子核医学重点实验室,无锡 214063;2)南京医科大学附属无锡人民医院医学检验科,无锡 214023;3)南京医科大学原子医学教学科研基地,南京 211166)
特发性膜性肾病(idiopathic membranous nephropathy,IMN)发病率在中国呈逐年上升趋势,其诊断的金标准为肾脏活检[1-2]。然而肾脏穿刺具有侵入性和复杂性,需要操作专业的医护才能开展,而且需要患者入院进行,这使得IMN的准确诊断受到了局限。Beck等[3-4]发现70%以上的IMN患者体内存在磷脂酶A2受体(phospholipase A2 receptor,PLA2R)的抗体IgG,随着研究深入,肾脏病权威组织“改善全球肾脏病预后组织(Kidney Disease Improving Global Outcomes,KDIGO)”制定了IMN的临床实践指南,提出血清PLA2R-IgG作为首要诊断依据,根据测定结果再考虑是否活检[5],因此该指标的检测必要且关键。同时,PLA2R-IgG水平与IMN疾病进程和缓解相关,能够指导个性化用药,低浓度水平意味着可持续使用保守疗法[5-6]。因此,定量分析PLA2RIgG也是新方法必备的性能。目前临床主要采用酶联免疫吸附分析(enzyme-linked immune sorbent assay,ELISA)作为检测手段[7]。ELISA检测线性范围宽,适合批量测试,但不适合门诊患者随到随检。因此,研制单人份、快速且定量的PLA2RIgG检测方法十分必要。
本研究首次报道采用两步法进行PLA2R-IgG的间接免疫层析分析(immunochromatographic assay,ICA),令抗原抗体能在短小的试纸条上充分反应,在保证快速性的前提下,提高检测的特异性;使用镧系元素铕(Eu)作为发光物质,发挥该元素荧光信号强、背景低、抗干扰的特性,进而实现PLA2R-IgG抗体的快速、灵敏、定量检测。
1 材料与方法
1.1 仪器与试剂
HG-98免疫层析定量分析仪为上海互帼公司产品,酶标仪为美国Bio-Rad公司生产,喷金划膜仪和切条机由杭州赛凯生物公司制造。带羧基的Eu荧光微球(Bangs Laboratories,美国),重组表达的PLA2R抗原(无锡傲锐东源),抗人IgG单抗(Hytest,芬兰);羊抗鼠IgG抗体、样品垫、硝酸纤维素膜、吸水纸、6 cm底板和卡壳购自杰一生物(中国)。N-羟基丁二酰亚胺(NHS),2-[N-吗啉]乙磺酸(MES),1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)和牛血清白蛋白(BSA)购自Sigma-Aldrich(美国)。其他试剂均为国药沪试生产,纯度为分析纯。PLA2R-IgG抗体标准品和ELISA检测试剂盒为德国欧蒙医学实验诊断股份公司产品。
1.2 抗体偶联荧光微球的制备
将1 mg羧基微球溶解在500 μl的制备液(0.1 mol/L的MES溶液)中,先用超声仪分散,再离心15 000×g,时长20 min,将上清液小心地吸去,重复两次;之后,向微球中加入100 μl含有1 mg NHS和1 mg EDC的水溶液,用制备液补齐体积至500 μl,避光振荡反应0.5 h后,用该溶液洗涤微球3次;再将一定量的抗人IgG单抗加入至已活化的微球中,避光振荡2 h;然后,向反应液中加入10 μl含10% BSA的Tris-HCl缓冲液(0.05 mol/L,pH7.2),避光振荡0.5 h;用蒸馏水洗涤去除多余抗体,方法同前;最后,将偶联了抗人IgG单抗的微球复溶于含1%BSA和0.1%Tween-20的Tris-HCl缓冲液(0.05 mol/L,pH7.2)中,使其浓度为2.5 g/L。
1.3 试纸条的制备
PLA2R-IgG-ICA试纸条由样品垫、硝酸纤维素膜(NC膜)、吸水纸和6 cm底板构成,制备时,先把硝酸纤维素膜贴在背板中央,再把PLA2R抗原或羊抗鼠二抗分别喷涂在硝酸纤维素膜上,构成间隔5 mm的检测线(test line,T line)和质控线(control line,C line)。30℃烘干膜条2 h,以固定上述蛋白质。然后,将样品垫和吸水纸分别粘贴于上述硝酸纤维素膜两端,形成2 mm的重叠。最后,将切割成4 mm宽的免疫层析试纸条带装入单人份的塑料卡壳中,再放入铝膜袋长期保存。
1.4 检测步骤
将血清样本用稀释液(含有0.5%BSA的pH7.8 0.05 mol/L的Tris-HCl缓冲液)按适当比例稀释,滴加入速测卡加样孔内,37℃孵育。再加入由稀释液配制的抗人IgG单抗标记的Eu微球,37℃孵育适当时间。随后将速测卡插入HG-98免疫层析定量分析仪检测,仪器自动显示检测结果。反应过程示意见图1。

Fig.1 Reaction principle diagram of PLA2R-IgG-ICA
1.5 性能考核
参照现行国家标准[8],对构建的PLA2R-IgGICA进行方法学考核。a.线性:检测PLA2R-IgG标准品0、10、20、100、500、1 500 RU/ml,各3次,对结果进行线性拟合并计算相关系数R;b.准确性:通过向两个低值样本等体积添加PLA2RIgG标准物质,每个添加样重复测定2次,实测值与理论值的比值为回收率;c.精密度:对浓度为19.8 RU/ml和102.7 RU/ml两个血样各重复测定10次,通过计算均值(Mean)和标准差(SD),获得变异系数(CV);d.灵敏度:平行测定20次标准品稀释液,计算所测浓度的Mean+2×SD的值,此值即为灵敏度;e.特异性:检测高纯度的350 IU/ml抗过氧化物酶抗体和3 250 IU/ml抗甲状腺球蛋白抗体,若交叉反应率低于1%则认为特异性较好;f.加速稳定性:将37℃放置10 d与2~8℃保存的试剂同步检测标准品,计算各浓度点漂移率,若平均偏差小于15%,认为试剂稳定。
1.6 临床应用
IMN患者的血清样本采集由南京医科大学附属无锡人民医院提供,经医院伦理委员会批准,批准号:2020LLSL-ⅡYZ-08-01,收集时间是2020年10月~2021年4月。血样使用分离胶血清管采集,离心分离后分装保存于-40℃冰箱,检测前恢复至室温使用。方法比对的相关性用Passing-Bablok分析,相关系数R>0.9且P<0.05认为相关性好;阴阳一致性和其他参数的比较通过Pearson卡方检验统计分析,P<0.05认为有显著性差异。
2 结 果
2.1 PLA2R-IgG免疫层析法的反应模式
本研究采用间接法检测,首先对反应步骤进行考察。传统的免疫层析法采用一步法检测,将样品与微球一起加在样品垫上,经毛细管层析作用与T线和C线的抗原、抗体反应。从图2a的1和2条带荧光照片可知,一步法荧光微球与样品在样品垫和NC膜交叠处产生蓄积,形成非特异条带。此外,从图2b的剂量曲线可知,一步法测量低浓度和高浓度标准品时曲线弯曲,影响线性范围。为解决此现象,本研究采用两步加样:先加入PLA2R-IgG标准品或稀释样品,令抗体与T线的PLA2R抗原反应,同时未反应的干扰物可被吸水纸吸附;再加入微球标记的抗人IgG抗体,经层析作用,于T线形成PLA2R抗原-人PLA2R IgG-微球抗人IgG抗体的复合物,过量的微球可被C线的羊抗鼠IgG捕获,未反应的试剂被吸水纸吸收。从图2可知,两步法比一步法降低了微球的非特异结合,且检测的线性范围更宽。

Fig.2 Comparison of PLA2R-IgG-ICA between one-step and two-step methods
2.2 检测方法的优化
为优化微球标记效率,本研究对微球制备液的pH和Eu微球-抗体反应比率进行选择,按照二步法反应,用标记的微球分别检测空白和高值标准品(1 500 RU/ml的PLA2R-IgG),每个浓度水平测量2次。用pH4.5、5.0和5.5的制备液标记的微球分别检测标准品(图3)。当制备液pH为5.0时,空白标准品的T/C(T线与C线荧光信号的比值)低,高浓度标准品T/C最高,所以采用pH5.0为制备液的最佳反应pH体系。

Fig.3 The effect of pH of MES buffer
为提高微球-抗体荧光信号,降低非特异吸附,对Eu微球和抗人IgG单抗的反应质量比按10∶1、25∶1、50∶1和100∶1进行筛选(图4)。当按照25∶1反应时,反应的高值标准品T/C高、空白标准品T/C较低,效果最佳,因此选择该条件制备微球。

Fig.4 The effect of the reactive ratio of Eu-microspheres vs anti-human IgG
为方便操作,令每步反应时间一致,然后考察了5、10和15 min/步对结果的影响(图5)。综合空白和高值标准品荧光计数的差异与时效,选择10 min/步为最适反应时间,即总孵育时间为20 min。
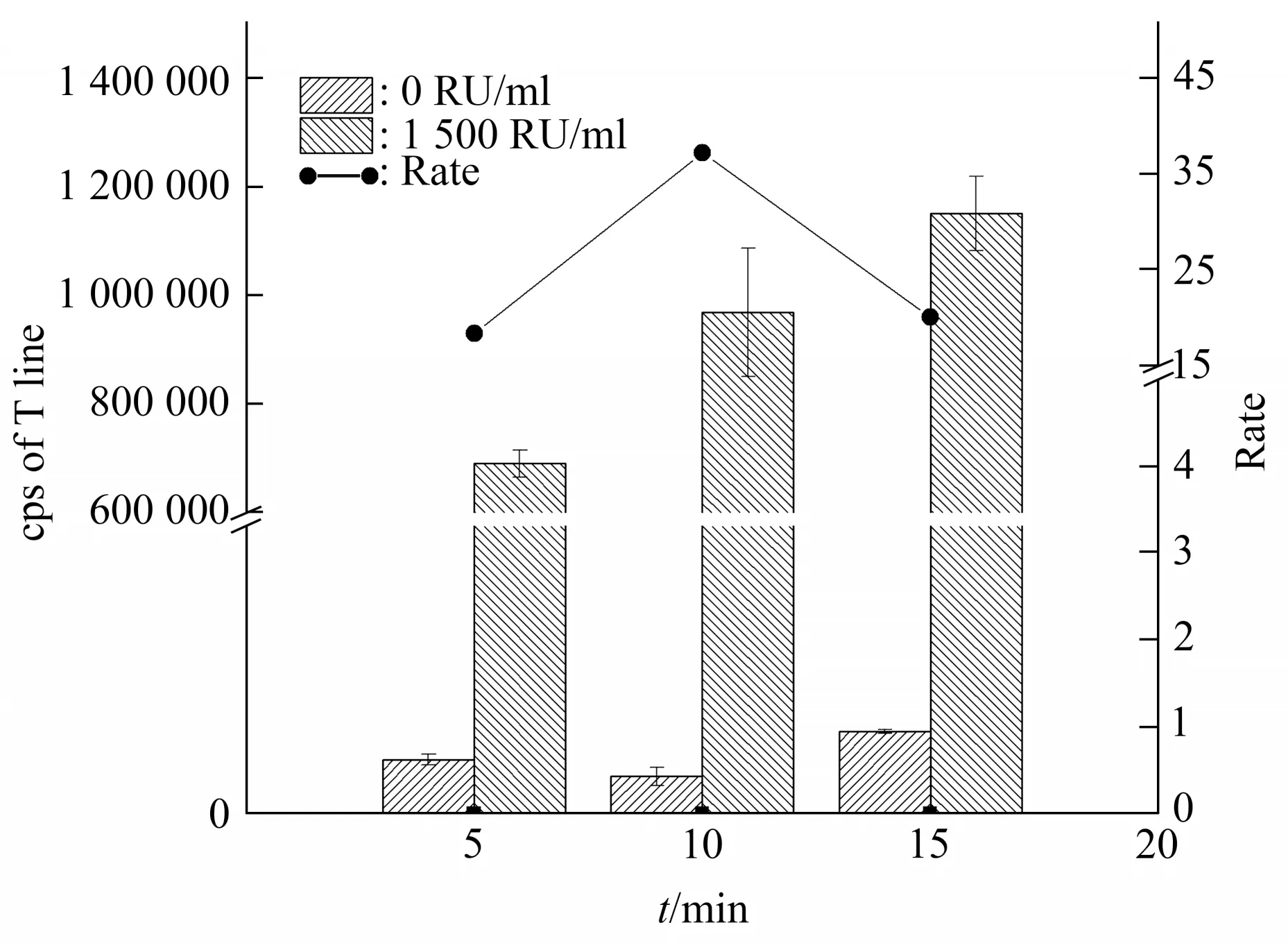
Fig.5 The effect of different reaction time
2.3 检测方法的性能指标
采用优化方案构建的PLA2R-IgG ICA灵敏度为0.7 RU/ml,标准曲线方程为y=0.771x-1.437,相关系数R=0.995,线性测量范围为0.7~1 500 RU/ml(图6)。向健康体检者血清样本中添加系列标准品,计算方法的添加回收率。由表1可知本方法回收率为86.27%~98.98%,在80%~120%范围内,判为方法准确。平行测定2例PLA2R-IgG浓度值分别为(18.91±1.94)RU/ml和(111.50±6.70)RU/ml的血样,平均批内CV为8.13%,小于15%,认为方法重复性好。用本方法分别检测350 IU/ml抗过氧化物酶抗体和3 250 IU/ml抗甲状腺球蛋白抗体,结果分别为0.6 RU/ml和0.3 RU/ml,交叉反应率均小于0.1%,认为新方法具有特异性。为考核按此方法制备试剂的稳定性,将已稀释微球溶液和试纸条置于37℃烘箱10 d,再检测标准品,与2~8℃保存的试剂相比,各浓度点偏移程度分别为:4.7%、14.7%、13.1%、0.4%和4.2%,平均值为7.4%,因此可知试剂存于37℃10 d稳定。

Fig.6 The standard curve of PLA2R-IgG ICA
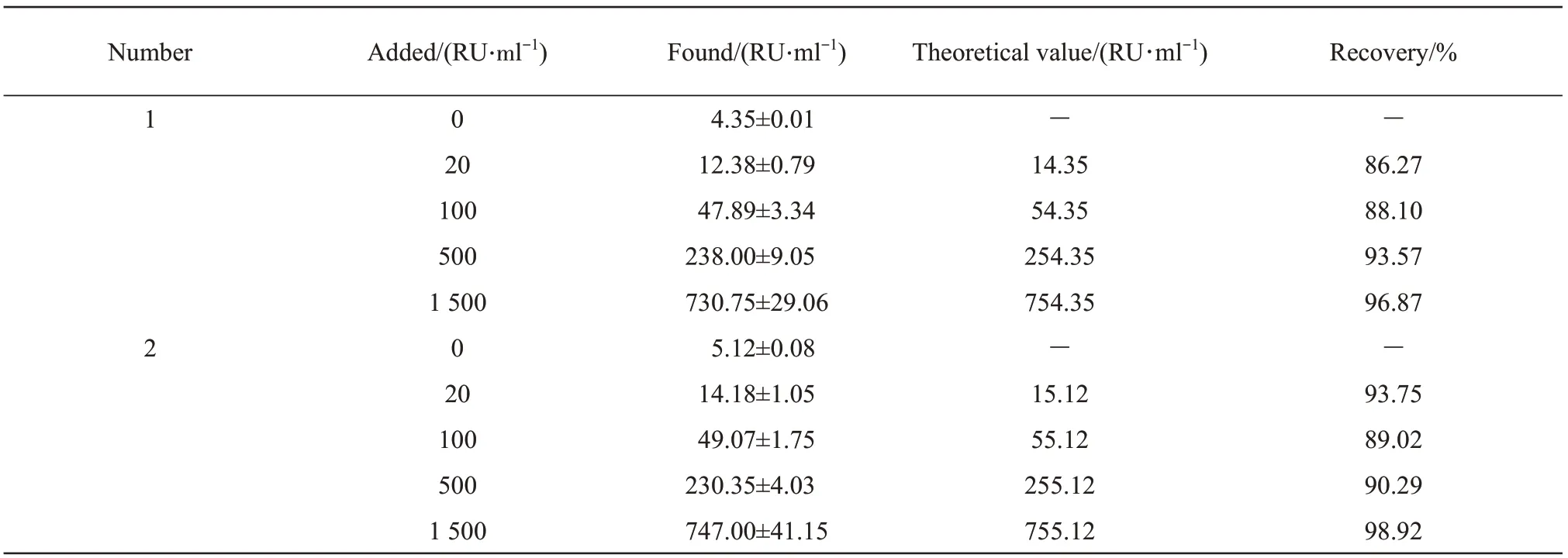
Table 1 The recoveries of PLA2R-IgG ICA
2.4 临床应用
采用本方法与市售的ELISA试剂盒同步检测52例IMN患者的血清样本(图7),得到的相关性回归方程y=0.805x+0.373,R=0.953。R>0.9且P<0.01认为两种检测相关。本方法与ELISA试剂盒的正常参考值均为20 RU/ml,<20 RU/ml判为阴性,否则为阳性。表2显示了两个方法的一致性比较和临床样本的一般信息,结果表明:IMN患者的性别与PLA2R-IgG水平有显著相关(P<0.05),而是否老年患者、肾小球滤过率(eGFR,按CKD-EPI公式计算)异常程度与PLA2R-IgG水平无显著关系(P>0.05),与市售ELISA试剂盒阴阳性判断一致(P<0.05)。本方法对IMN的检出率为76.9%(40/52),与现有报导相符[3]。
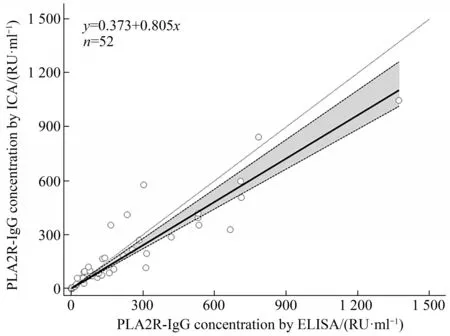
Fig.7 The correlation of PLA2R-IgG-ICA and ELISA for detection IMN samples
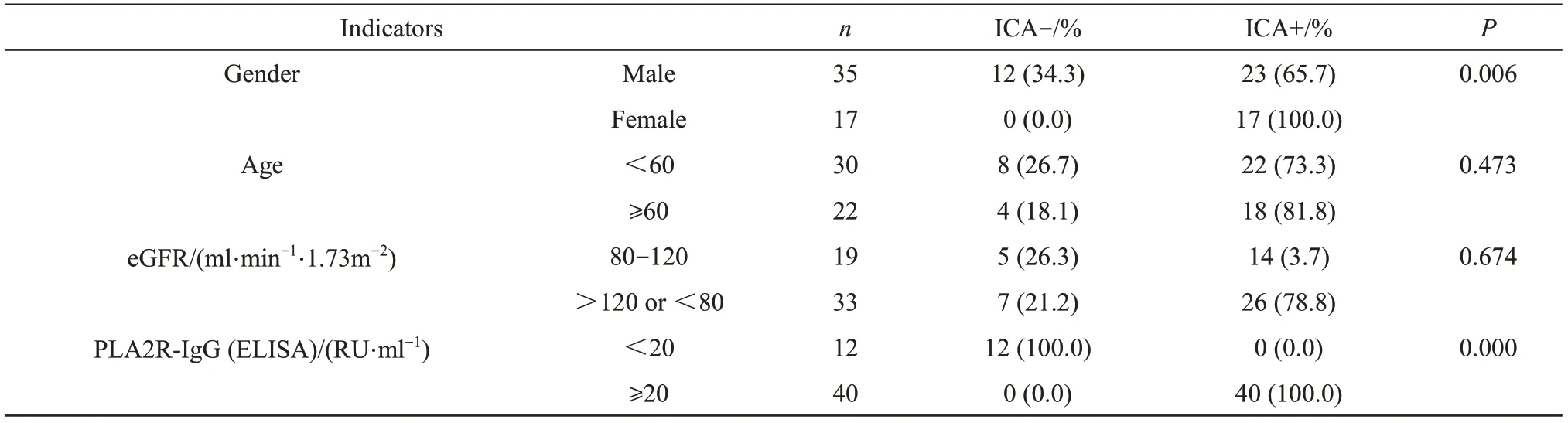
Table 2 The results of PLA2R-IgG in serum samples of IMN patients with clinical parameters
3 讨 论
本研究构建了一种采用镧系元素为荧光剂的PLA2R-IgG-ICA,反 应 时 间20 min,灵 敏 度0.7 RU/ml,线性范围跨3个数量级,测量上限至1 500 RU/ml,且方程回归系数R>0.990,对IMN的临床检出率达到76.9%,与国内外报道相符。而同类的ELISA试剂盒灵敏度0.6 RU/ml,线性范围6~1 500 RU/ml,回归系数R>0.975,且需要1.25 h反应。综上,PLA2R-IgG-ICA性能指标与ELISA近似,能准确定量,且反应时间大幅减短。而ICA具有单人份特性,因此本检测方法在小样本量和随到随检方面具有优势。
由于人血清中抗体混杂,若同时加入荧光剂标记的二抗,容易在层析试纸条上产生非特异结合,并造成勾状效应,缩短测量范围,造成结果判读不准[9],这些现象在本研究采用一步法检测PLA2RIgG时也存在。为解决上述问题,本方法采用两步法加液,将样本与示踪微球先后加入样品垫,令待测物与NC膜中的靶抗原充分反应,使得再加入的微球二抗能更精准的捕获T线上的一抗,进而形成目标免疫复合物。本研究首次通过二步法反应,提高了试纸条免疫反应的充分性,提升了标记抗体的靶向性,增加了反应灵敏度和测量范围。本方法总孵育时间20 min,较常规ICA的15 min[10]适当延长,但与ELISA相比仍具有时间优势。
床旁检测价格低廉、操作便捷、即时高效,不使用复杂的仪器,也不需要专业的检验人员,因此特别适合于迅速指导临床治疗,在单人次临床检测中发挥越来越大的作用[11-13]。ICA为床旁检测的最常见形式,广泛用于医学检测、治疗监测、食品安全等领域[13-16]。ICA常采用胶体金示踪,根据颜色的深浅判断结果,只能定性和半定量检测。而通过前期研究可知:镧系元素的激发光波长范围较宽,发射峰范围窄,本底荧光强度低,有助于提高检测灵敏度[17-19],将镧系元素与ICA融合将大幅度地提高检测的灵敏度和特异性,实现ICA的全定量检测[20-21]。本研究使用含Eu的微球作为示踪物,用微球将Eu包裹其中,使后者与水相隔离,避免了荧光猝灭,也无需使用增强液等信号放大试剂,从而进一步提高了反应效率和便捷度,并且在已构建的夹心法的基础上[20],拓展了镧系元素ICA的反应类型,再次证明间接法在该检测体系上的可行性。
然而ICA受层析介质的影响,不同厂家的硝酸纤维素膜、吸水纸都可能产生不同的层析效果,而且试纸条长短也会影响免疫反应[22]。本方法仅针对杰一公司提供的试纸条原材料,在6 cm试纸条上进行了PLA2R-IgG检测研究,其他长度和厂家的试纸条是否适用于本指标检测有待进一步考量。
4 结 论
本文基于首创的两步法反应和Eu荧光微球示踪的免疫层析技术,实现了即时、定量、灵敏、准确检测人血清中PLA2R-IgG。与市售ELISA试剂相比,本方法具有单人份和随到随测的优势,具有普及推广前景。

