海洋微生物铁载体的研究进展*
张笑雨 朱建明 蔡中华 周 进**
(1)清华大学深圳国际研究生院,海洋工程研究院,深圳 518055;2)哈尔滨工业大学(威海),海洋科学与技术学院,威海 264209)
海洋中微量金属元素的生物地球化学循环是一个备受关注的议题。在众多的微量金属中,铁是代表性成员之一;对绝大多数海洋浮游生物来说,铁是其生长所必须的一种重要元素。铁作为辅因子在生化反应、电子传递、代谢途径等生命活动过程中发挥着关键作用,重点表现在控制浮游植物的生产力和群落结构等[1]。尽管在地壳中铁元素储量丰富,但铁在海洋环境中主要以不易溶解的三价(Fe3+)氧化铁或氢氧化铁复合物形式存在,使得其生物可利用性极低。因此,生物常通过合成和分泌对Fe3+具有高亲和力的小分子化合物铁载体(siderophores),来螯合环境或宿主细胞中的铁元素以满足正常生命活动的需求(图1)[2]。
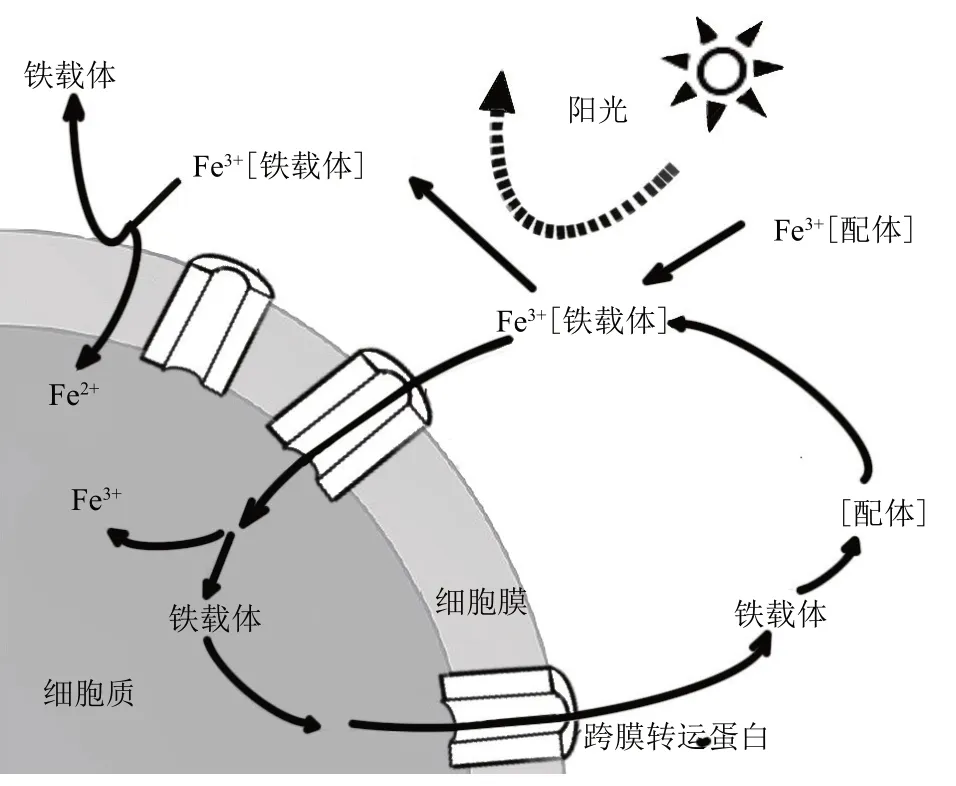
Fig.1 The affinity of siderophore to iron and its binding process with divalent and trivalent iron[2]图1 铁载体对铁的亲和及其与二价和三价铁的结合过程[2]
海洋细菌产生了水体中大部分的有机铁螯合剂[3]。这些细菌通过产生不同类型的铁载体与浮游植物竞争铁,对海洋环境中的铁含量和溶解度产生重大影响[4]。海洋铁载体含有羟基羧酸官能团,由柠檬酸类(如链球菌素(snychobactins)、岩杆菌素(petrobactin)、产气菌素(aerobactin)和海藻菌素(marinobactins))或β-羟基天冬氨酸类(如水杨酸(aquachelins)、洛希其林(loihichelins)和细菌素(alterobactin))所提供,铁载体通过形成Fe3+-载体复合物参与铁的循环,从而增加细菌对铁的利用率[5-6]。在海水中提取的天然有机物中,已检测到具有典型铁载体性质的羟酯和儿茶酚(catecholates)化合物[7-8]。同时有研究发现,在表层和深海分别存在多样化的铁氧胺G和铁氧胺E,这两种物质是铁载体典型的赋存形式,并维持着铁的生物可利用度。这表明铁载体在提高海洋水体中铁的丰度和有效性方面发挥了重要作用,从而推动了铁的生物地球化学循环[9-10]。
对海洋中铁载体的分离、鉴定和生物学功能研究已有几十年的历史,对它们在微生物中的转运机制、合成途径、生态功能也有了广泛而深入的认识。对于铁载体的生物合成机制及相应生态学功能,近十年间也取得了显著进展。基于这些进展,本文主要围绕海洋微生物铁载体的生态学过程展开评述,以期对这类天然产物的生物合成机理、代谢途径、生态功能和未来研究态势进行系统梳理,提高对其在整个海洋铁循环中所起生态作用的理解。
1 铁循环的微生物学过程
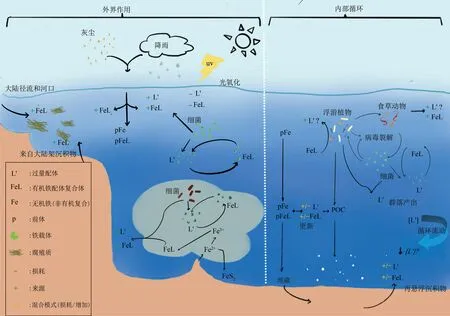
Fig.2 The main iron cycle process in the ocean(siderophores)[11]图2 海洋中主要铁循环过程(含铁载体)[11]
依据物理、化学和生物的原理,Kappler等[11]总结了海洋微生物铁循环,勾勒了不同水层中铁的氧化-还原状态及涉及的关键微生物学过程(图2)。微生物介导的铁代谢主要包括氧化和还原反应,氧化过程大体分为4类,即O2氧化、生物矿化、光化学反应以及硝酸盐氧化[12]。介导铁氧化的微生物被称为铁氧化菌(Fe-oxidizing microorganism,FOM),包含4种类型:中性好氧铁氧化菌(aerobic neutrophilic FOM)、嗜酸性好氧铁氧化菌(aerobic acidophilic FOM)、厌氧光合铁氧化菌(anaerobic anoxygenic photosynthesis FOM)以及硝酸盐依赖型铁氧化菌(anaerobic nitrate-dependent FOM,ANDFOM)[13]。在海洋中,不同水层的光照、溶氧、温度及元素组成不同,这使得铁的氧化过程还耦合了其他元素的代谢循环。例如,在与氮(N)元素的耦合关系上,异化铁还原、铁氨氧化、反硝化过程是海洋环境中铁氮循环耦联的重要方式。浮游植物的光合作用是固定大气CO2的主要形式,将无机碳转化为有机碳是食物网C循环的主要推手。有研究发现铁有利于提升浮游植物的固碳效率[14],铁的利用与再生为碳循环网络的运行提供了驱动力[15]。
铁的还原过程包括胶体铁的还原、铁-有机配体的光还原或生物还原。铁在海洋中主要以无机态Fe3+离子或者绑定有机配体的铁载体复合物(Fe3+L)形式存在,其中Fe3+L是主要的存在形式(占99%以上)。铁还原可以引起Fe3+L的解离或产生Fe3+离子,前者是解离性还原,后者是非解离性还原[16]。Fe3+异化铁还原是古菌和细菌等铁还原菌通过氧化有机或无机物将电子传递给末端电子受体Fe3+并产生其所需能量的过程,因此异化铁还原又称铁呼吸[17]。异化铁还原细菌采用以下3种方式将电子传递到Fe3+矿物表面:a.微生物与Fe3+直接接触;b.微生物分泌胞外螯合物促进Fe3+的溶解;c.微生物利用电子穿梭体作为中介使电子到达矿物表面[18]。到目前为止已有超过71种海洋铁还原菌被鉴定[19],其中地杆菌(Geobacteraceae)和希瓦氏菌(Shewanella)是研究最多的两种铁还原菌[20]。
2 铁载体的类型
铁载体的分子质量在500~1500 u之间,多为八面体构型,主要为异羟肟酸(hydroxamates)或邻苯二酚衍生物。目前,从海洋环境中分离并鉴定的铁载体已超过200种,主要分为异羟肟酸、儿茶酚、羧酸盐(carboxylates)以及一些混合类型(图3)。具有铁载体产生能力的细菌也较为广泛,包括变形菌(Proteobacteria)(α-、β-、γ-、δ-纲)、厚壁菌(Firmicutes)、放线菌(Actinobacteria)和酸杆菌(Acidobacteria)等[21]。
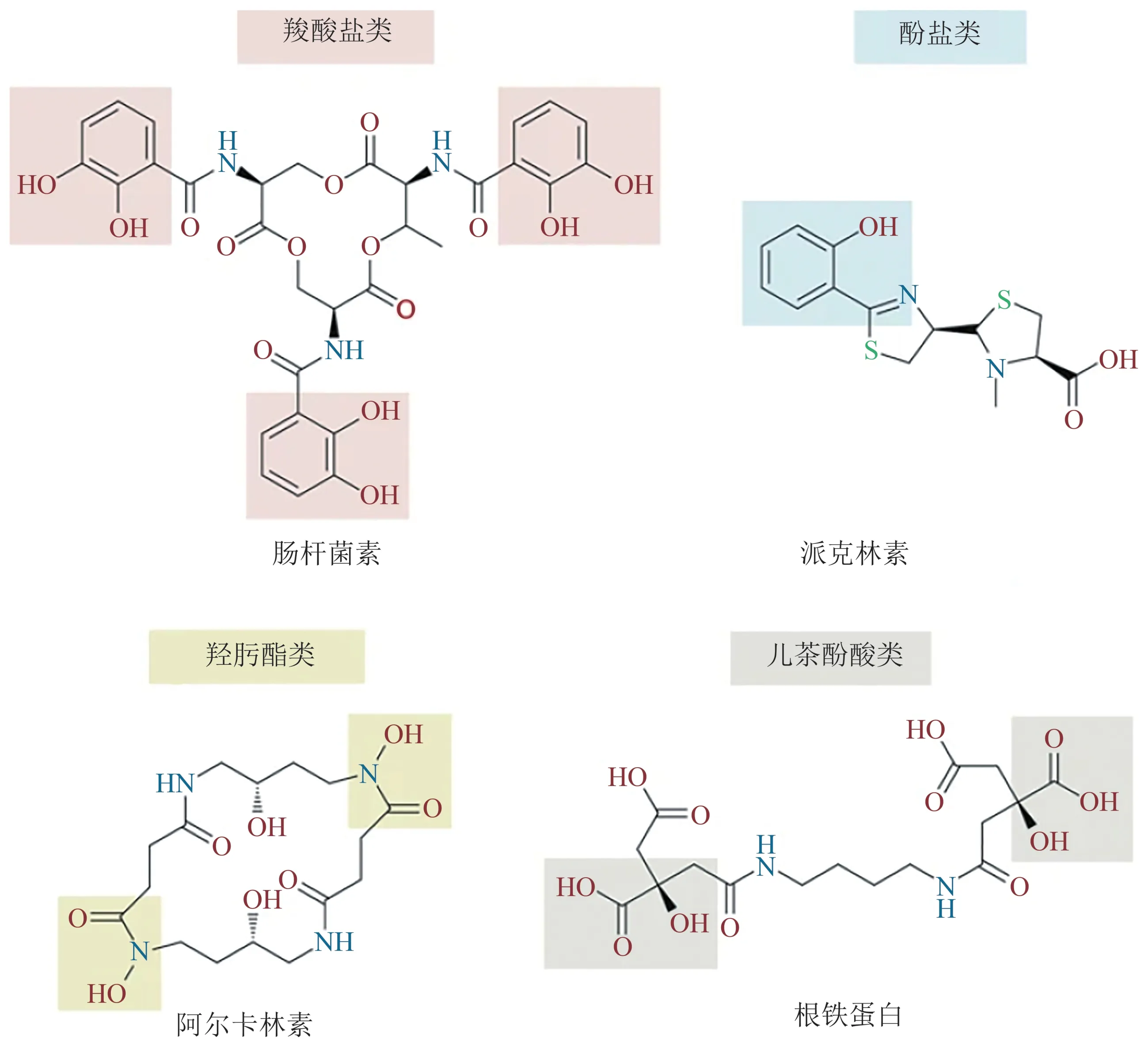
Fig.3 Main types of siderophores图3 铁载体的主要类型
3 铁载体的生物合成
真核生物中,铁载体的生物合成常始于柠檬酸、氨基酸、二羟基苯甲酸盐和酰基-羟基镍氨等前体[22],负责铁载体合成的操纵子包括sidA、sidD、sidG、sidF、sidC以及sidL基因,其中真菌的铁载体合成都是从L-鸟氨酸(L-ornithine)开始,一般仅产生羟肟酸类铁载体[23];原核生物中常见铁载体前体是肠杆菌素(enterobactin),其合成操纵子包括entC/D/E/B/A/H家族、fepA/B/C/D/E/G家族以及entS元件[24]。
在微生物中负责铁载体生物合成的途径主要分为两大类:一类是依赖于非核糖体肽合成酶(nonribosomal peptide synthetase,NRPS)的生物合成途径。目前NRPS的催化机制已经得到很好的阐明,许多铁载体如肠杆菌科(Enterobacteriaceae)产生的肠杆菌素[25]、假单胞菌(Pseudomonas)中的铜绿假单胞菌铁载体(pyoverdine)[26]以及黑粉菌(Ustilago maydis)产生的高铁色素(ferrichrome)[27]等都是通过这一机制合成。另一类是不依赖于NRPS的合成途径,参与这一途径的铁载体合成酶家族直到近年才开展精细的研究,例如肠杆菌产生的产气菌素[28]、金黄葡萄球菌(Staphylococcus aureus)合成的载铁素(staphyloferrin)[29]以及链霉菌(Streptomycete)分泌的去铁草酰胺(desferrioxamine)[30]等。
在第一种途径中,典型的NRPS是以模块形式存在的多功能酶,通常包含3种基本模块(起始、延伸和终止模块)。每个模块含有一套独特的、非重复使用的催化功能域。起始模块只含有一个腺苷化功能域(adenylation domain)和一个肽酰基载体蛋白(peptidyl carrier protein,PCP)。而延伸模块通常至少含有3个最基本的催化功能域,即腺苷化功能域、肽酰基载体蛋白,以及缩合结构域(condensation domain)。在终止模块中,除了一个正常的延伸模块外,在其碳末端还有一个硫酯酶功能域(thioesterase)。此外,有的模块还含有其他的修饰功能域,例如甲基化酶(methytransferase)功能域和表异构化酶(epimerase)功能域。在第二种途径中,即不依赖于NRPS体系,大肠杆菌(Escherichia coli)K-12产生的产气菌素是最早发现并确认的不依赖于NRPS方式合成的铁载体。在铁缺乏的培养基中,多种革兰氏阴性菌如大肠杆菌、志贺氏菌、耶尔森氏菌和沙门氏菌中都能产生产气菌素,并且在大肠杆菌的质粒pColV-K30上鉴定了它的生物合成基因簇[28]。
4 铁载体的转运与调控机制
4.1 铁载体的转运
革兰氏阴性菌对Fe3+L的吸收依赖于外膜受体(OMR)、周 质 结 合 蛋 白(periplasmic binding proteins,PBPs)、TonB复合物 以 及ABC转运体(ATP binding cassette transporters)等。Fe3+L到达的第一个靶点是能识别并结合该复合物的特定OMR。Fe3+L的跨膜运输是一个依赖能量的过程[31],这个能量由TonB复合物提供,它由3种周质膜蛋白构成(TonB、ExbB和ExbD)[32],且分别嵌于细胞质膜上[33]。TonB复合物借助细胞膜上的质子动力到达外膜,从而促进Fe3+L从外膜主动转运到细胞周质,然后与周质结合蛋白相结合[34]。形成的Fe3+-铁载体-PBPs复合物通过ABC转运体跨过细胞内膜转运到细胞质(图4a)[35]。ABC转运体位于细胞内膜,它能利用ATP水解产生的能量将复合物逆浓度梯度泵到细胞质外,一旦铁载体到达细胞质Fe3+就会被释放出来[36]。对海洋模式生物三角褐指藻(Phaeodactylum triconutum)的研究发现:铁载体基因sid编码的蛋白质会结合Fe3+,绑定上游结合蛋白1(far upstream element binding protein 1,FBP1),从而实现Fe3+离子化合物向膜内的运输(图4b)[37]。
与革兰氏阴性菌不同,革兰氏阳性菌不具备外膜或周质区,Fe3+L转运到细胞质的途径不确定是否与革兰氏阴性菌不同,但它们都存在周质结合蛋白受体和ABC转运体。如金黄色葡萄球菌的PBPs受体对Fe3+L表现出更高的亲和力,从而可以从环境中摄取Fe3+L,并在ABC转运体的协助下转运到革兰氏阳性菌的细胞质[38]。
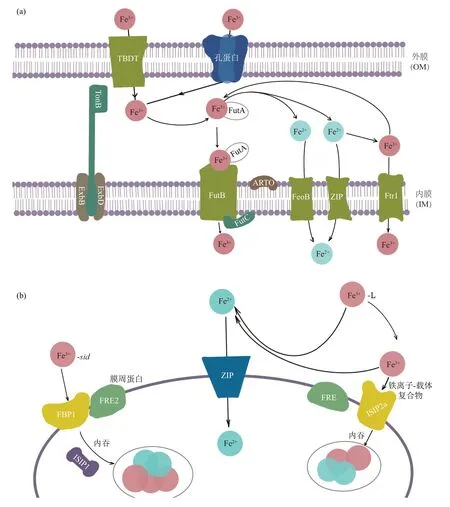
Fig.4 Transmembrane transport involved in siderophores[35-37]图4 铁载体的跨膜运输过程[35-37]
此外,近年来海洋真菌也证实具有铁载体转运系统,其工作原理大体分为4类。a.穿梭机制,铁载体复合物被运输穿过细胞膜,在那里Fe3+被配体释放并被还原酶还原,例如真菌(如黑粉菌U.maydis)对高铁色素的运输[39]。b.“的士”机制,来自胞外铁载体的Fe3+通过细胞膜转移到细胞内配体上,类似于搭乘的士进行内外穿梭。c.水解机制,整个Fe3+L被运输到细胞中,经过多次还原和降解过程释放Fe3+离子化合物。Fe3+在细胞内被还原为Fe2+,铁载体再次被分泌到胞外[40]。d.还原机制,Fe3+-载体复合物不跨细胞膜运输,Fe3+还原为Fe2+发生在细胞膜上,然后还原的Fe被细胞吸收,这一过程常被稗黑穗病菌(Ustilago sphaerogena)用于从高铁色素中吸收Fe3+[41]。
4.2 调控机制
在生物合成之后,铁载体被分泌到环境中以获取铁[42]。其外排动力主要包括协同转运超家族蛋白(major facilitator superfamily,MFS)和抗性-结瘤-细胞分裂超家族外排泵(resistance-nodulationdivision,RND)等。在第一种途径MFS中,许多依赖NRPS合成途径的铁载体基因簇都含有MFS转运蛋白编码基因。MFS家族蛋白是分子质量最大的一类转运蛋白,拥有12个以上的跨膜α螺旋[43],负责转运离子、碳水化合物、脂质、肽、核苷和其他次生代谢产物[14]。第二种途径RND最早在铜绿假单胞菌(P.aeruginosa)中发现,该菌的MexAB-OprM系统是在铁载体荧光素分泌中发现的第一个RND泵[44]。在大肠杆菌中,TolC与RND泵互补负责将铁载体肠杆菌素泵出外膜[45]。此外,MmpS5-MmpL5型RND外排泵在结核分枝杆菌(Mycobacterium tuberculosis)中被鉴定[46],该泵受转录调节因子Rv0678的调节[47],缺少Rv0678的突变体不会影响铁载体羧基分枝杆菌素的吸收,但会影响细胞的生长[48]。
铁载体的调控机制主要包括铁吸收调控蛋白和σ因子调节。第一种方式中调节胞内铁平衡利用的是Fur蛋白(ferric uptake regulator)[49]。在高浓度铁的条件下,过量的铁离子与Fur蛋白结合,从而抑制铁载体合成和铁转运基因的转录,同时Fur蛋白通过小RNA RyhB来间接促进储铁蛋白的表达,以防止胞内过量的铁发生芬顿反应(Fenton reaction)产生羟基自由基损伤细胞;而在低铁浓度条件下,Fur蛋白上无铁离子结合从而失去了活性,解除了对铁载体合成基因和铁转运基因转录的阻遏,间接调控着储铁蛋白的表达[49]。在第二种方式中,主要通过σ因子调节铁载体受体的转录来实现。σ因子几乎存在于所有的细菌中,调节多个基因的转录并参与铁载体的合成和吸收[50]。铜绿假单胞菌的PvdS、荧光假单胞菌(Pseudomonas fluorescens)的PbrA、恶臭假单胞菌(P.putida)的PfrI/PupI以及大肠杆菌K-12的Fec家族都具有σ因子属性并行使对铁载体的调节[51]。以大肠杆菌的σ因子为例,FecA是大肠杆菌K-12中转运柠檬酸盐-铁结合体的受体,fecA基因属于fecA/B/C/D/E操纵子族,而fecA/B/C/D/E的转录依赖于σ因子FecI。当胞外铁载体结合到受体FecA之后,FecA将信号传递到内膜蛋白FecR,FecR将信号穿过内膜传递到FecI,随后FecI指导RNA聚合酶转录fecA/B/C/D/E操纵子,FecI的活性受抗σ因子的元件——FecR调控。FecA与FecR以及FecR与FecI之间的相互作用已被证明,其中FecA的N端和FecR的C端相互作用,而FecR的胞质部分和FecI相互关联[12]。
5 海洋微生物铁载体的摄取
海水中铁的不足催生了螯合剂的出现,促使生物能更为有效地获取铁,原核生物和真核生物中均存在不同的铁载体摄取机制。
5.1 原核生物铁载体的摄取
在革兰氏阴性菌中,每个铁载体复合物都被一个特定的OMR所识别。虽然OMR极其多样,但铁载体复合体被吸收的普遍模式是:OMR与内膜蛋白TonB相互作用,以促进铁载体复合体的吸收。目前的模型(图5)表明,TonB将内膜蛋白ExbB和ExbD以及细胞呼吸时产生的能量传递给OMR,从而导致OMR的构象变化以促进铁与铁载体向细胞内转运[52]。在大肠杆菌中,铁载体肠杆菌素被外膜受体FepA识别,一旦肠杆菌素穿过外膜,周质结合蛋白FepB就会将其运送到内膜,在内膜上由FepC、FepD和FepG组成的复合体将肠杆菌素运输到细胞质中。其他铁载体的吸收机制大体相似,但略有不同,例如铜绿假单胞菌的荧光铁载体被OMR识别后,是在周质结合蛋白FpvC和FpvF的作用下泵入细胞质[53]。
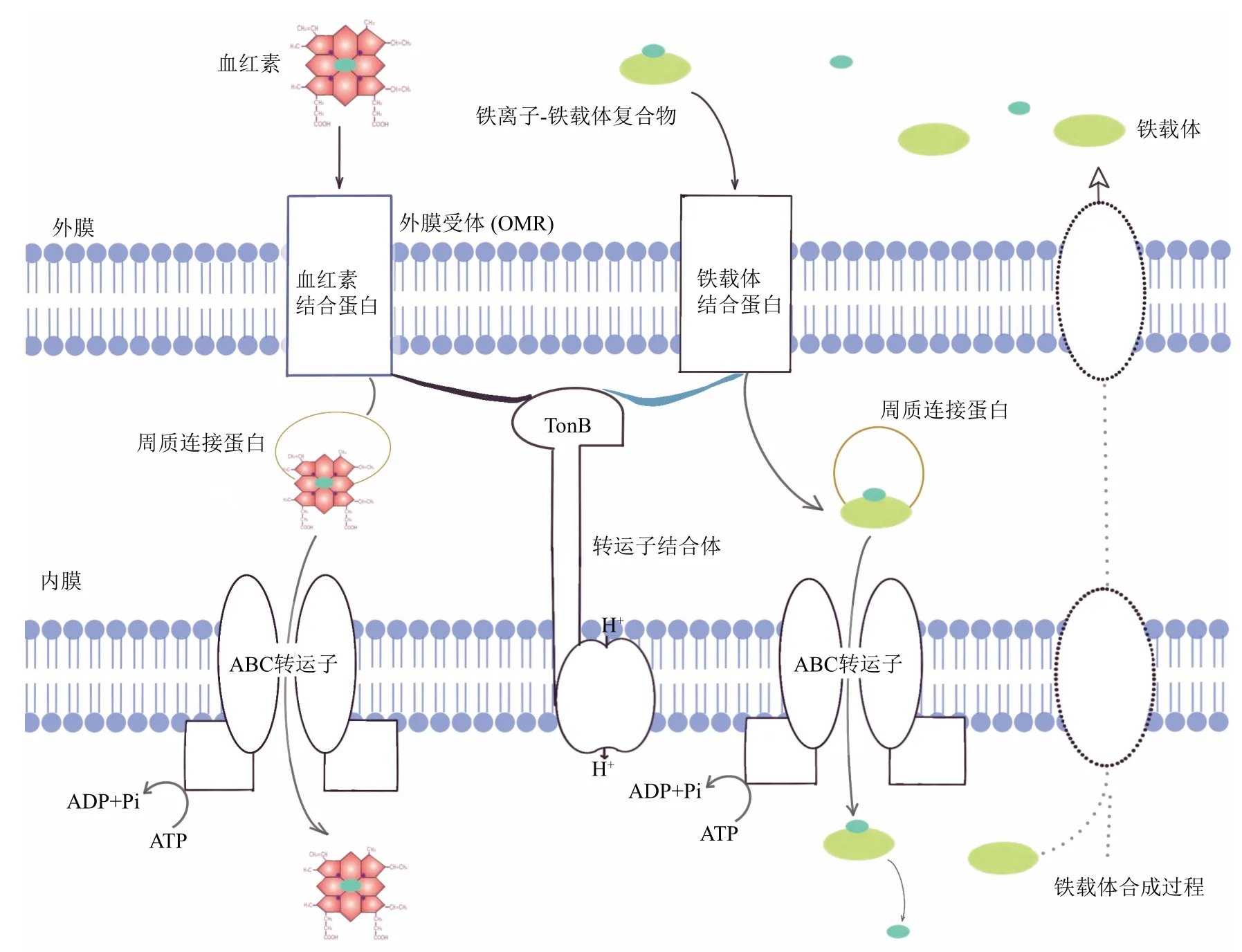
Fig.5 Microbial iron uptake and siderophore transport(Gram-negative bacterium)[53]图5 微生物的铁摄取与铁载体转运(革兰氏阴性菌)[53]
目前证据表明原核生物能够通过还原机制从有机螯合物中获得铁,其效率取决于铁复合物和原核生物种类。细菌通常通过TonB依赖的外膜受体运输铁载体,这是一类依赖于TonB蛋白的转运体,它跨越周质空间为外膜的吸收作用供能[54-55]。依赖TonB的受体在蓝细菌Synechocystis sp.PCC 6803中得到确认[56],这些受体基因经常存在于它们的基因组中。生物不产生铁载体,但可能利用其TonB依赖受体来窃取其他物种产生的铁载体,这也是许多细菌常用的策略[57]。海洋环境中蓝细菌Synechococcus sp.PCC 7002和Synechococcus sp.WH7803能够从各种羟酯和儿茶酚酸铁载体中获得铁[58]。从大西洋收集的束毛藻(Trichodesimum sp.)发现其能够从一系列铁载体(包括去铁氧胺、红乌酸和铁铬)中获取铁[59-60]。与近岸的蓝细菌不同,远洋微小蓝细菌(Picocyanobacteria)和固氮菌的基因组中还未发现TonB依赖受体的基因,这表明细菌运输铁载体的途径具有空间差异和种属异质性[61-62]。此外,鱼腥藻Anabaena sp.PCC 7120中裂殖素受体与已知的羟肟酸铁载体受体同源,并在基因组中与裂殖素生物合成基因搭配,最近已通过基因敲除实验验证了其功能[63]。
除了依赖TonB的方式,一些细菌缺少TonB依赖外膜受体,它们进化出了一个备选方式,即将Fe3+转化为Fe2+的还原过程,从而促进铁的吸收。还原过程可以像真核生物那样直接发生在膜表面,也可能通过电子穿梭间接发生。底栖海洋蓝藻(Lygbya majuscula)已被证实由自由基阴离子超氧化物充当穿梭器[64]。最近对大洋聚球藻属(Synechococcusspp.)和红海束毛藻(Trichodesmium erythraeum IMS101)的研究表明,这两种生物都能还原铁,而对于Trichodesmium erythraeum IMS1011来说,二价铁螯合剂的加入降低了铁载体对铁的吸收速率,表明吸收过程涉及到一个还原步骤。此外,“铁载体穿梭”机制还可以解释异养细菌中不加区分的铁载体转运,虽然对其机制的了解才刚刚开始,但推测可能与以下因素有关:铁螯合物电位的差异,电子穿梭还原的敏感性,铁载体通过外膜扩散的能力以及膜孔蛋白的大小等[65]。
5.2 海洋真核生物铁载体的摄取
真核生物获得铁载体的机制在角毛藻属Thalassiosira中得到了最充分的展现。目前的硅藻铁吸收途径模型及其分子基础与酵母菌(Saccharomyces cerevisiae)的模型非常相似。在酵母中,铁以及铁的有机螯合物,被细胞表面的铁还原酶还原释放出Fe2+,然后被细胞质膜中的多功能铁氧化酶氧化,并被一种渗透酶内化[66]。类似地,硅藻会减少铁载体和其他有机铁配合物的结合,并促进铁的吸收[67-69]。尽管硅藻产生的超氧化物最终在环境中会促进铁的消耗,但氧气的快速氧化会形成一种无效的氧化-还原循环,不利于铁的吸收[70]。相反,硅藻吸收途径可能包括细胞表面的铁还原酶,其中一些已在三角褐指藻的基因组中被鉴定,并受铁元素的制约[71]。
以真核环境的藻际生态位为例,Sutak等[37]总结了硅藻生物铁的来源、主要的氧化-还原过程以及铁载体的作用(图6),这为认识藻类真核生物的铁获取机制提供了重要参照。由于藻类种类繁多,也存在一些与硅藻不同的机制,如两种真核绿藻(金牛鸵球藻(Ostreococcus tauri)和绿色鞭毛藻(Ostreococcus lucimarinus)),它们缺乏还原酶型铁吸收系统[72],而具有与原核铁载体摄取途径相似的基因,因而表现出与硅藻不同的铁摄取策略,即更倾向于针对特定的铁螯合物[73]。
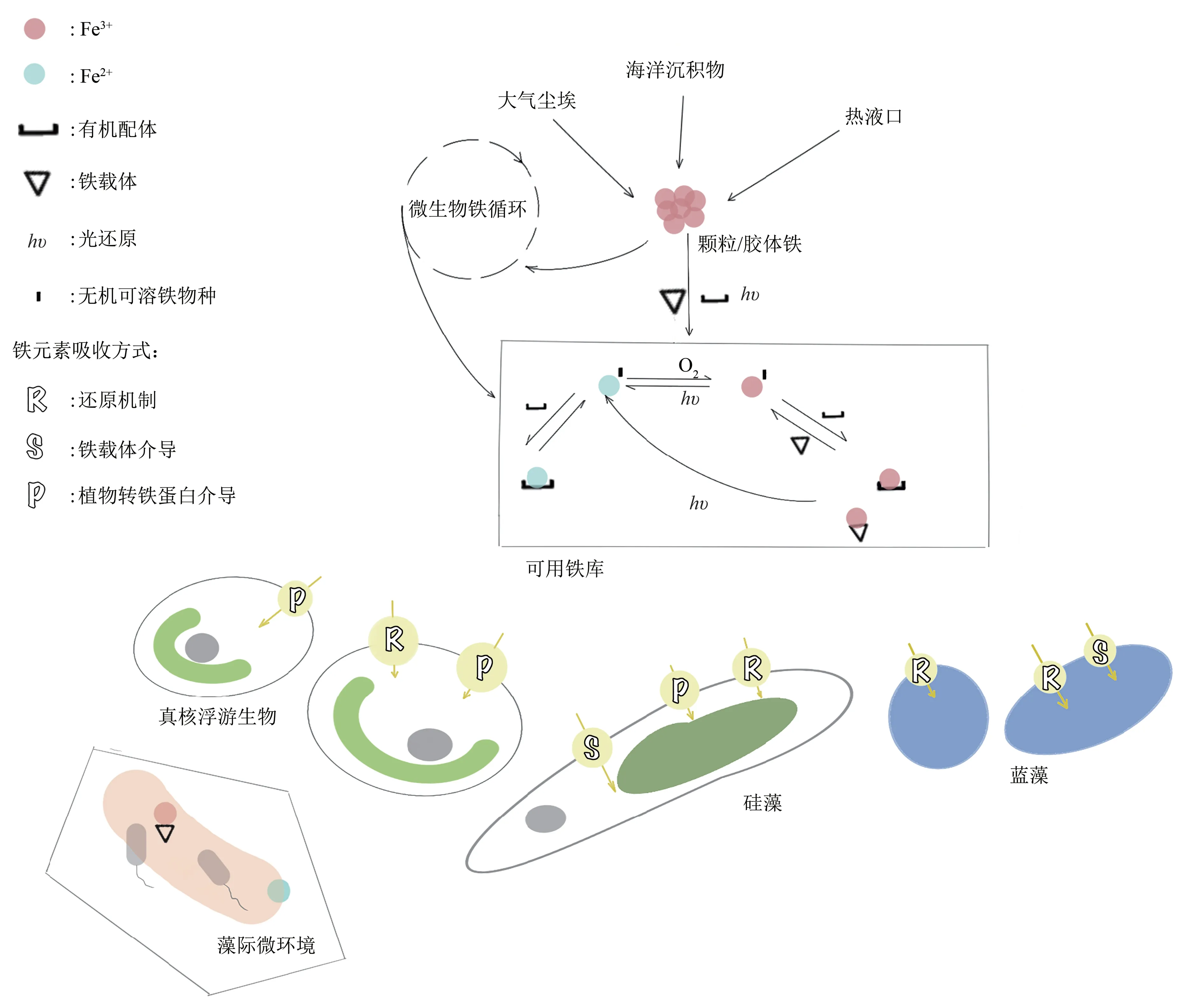
Fig.6 The source of iron in marine planktonic algae,the participation of siderophores and the process of iron turnover[73]图6 海洋浮游藻类铁的来源、铁载体的参与及铁周转过程[73]
海洋环境中铁载体和其他强铁螯合剂的存在推动了浮游植物铁捕获机制的发展。几乎所有被研究中,有机螯合物中的Fe3+被还原成Fe2+是吸收途径的重要环节[64,68,74],光还原以及随后从铁载体中释放铁也可能是增加无机铁和生物可利用铁浓度的重要过程之一[5,75]。铁载体的产生和利用的分子过程机理是今后研究的热点,未来工作中了解铁载体在海水中的分布和影响因素(铁的有效性、理化参数、化学感应、级联效应等)将有助于揭示真核生物捕获铁载体的机制。
6 铁载体的功能
6.1 抗氧化应激
铁载体被认为可以减少微生物的氧化应激,如肠杆菌素在氧化应激期间通过降低氧化应激源对铁的亲和力,进而稳定活性氧(reactive oxygen species,ROS)抵消铁的抑制作用[24]。在巨噬细胞入侵鼠伤寒菌(Salmonella typhimurium)的模型中,肠杆菌素通过抑制活性氧对细胞提供保护[76]。除了肠杆菌素的抗氧化活性,铁载体还具有远程感应的能力来缓解氧化应激。远程感应即铁载体在配体结合条件下,通过诱导特定的遗传应答感知元件来调节微生物附近的铁浓度[77]。这种机制已在铜绿假单胞菌中被观察到,铜绿假单胞菌可分泌两种主要的铁载体——荧光载铁素和螯铁蛋白(pyochelin)。在金属胁迫过程中,抗氧化酶如超氧化物歧化酶(ruperoxide dismutase,SOD)和过氧化物酶(peroxidase,POD)的活性增加以对抗活性氧的上升,活性氧的增加也会导致脂质过氧化体的增加。研究发现,当存在铁载体时脂质过氧化反应增加,而SOD和POD活性双双降低[78]。
6.2 毒力控制
铁载体在病原体的毒力代谢过程中起着重要作用。在动物体内血清病原体必须结合到转铁蛋白、铁蛋白和血红蛋白上才能获得铁。因此,铁载体螯合剂对病原体的毒力至关重要。一种被称为铁钙素的中性粒细胞明胶酶脂蛋白(NGAL)能与细菌儿茶酚类铁载体结合,削弱毒力表达[79]。相应地,为了对抗毒力的削弱,大肠杆菌产生弱铁载体(如产气菌素)以减少这种结合。在烟曲霉引起的肺曲霉病小鼠模型中,缺乏完整的铁载体系统使真菌完全失去毒性[80]。Fetherston等[81]的一项研究表明,当小鼠皮下感染时,鼠疫耶尔森菌(Yersinia pestis)中铁载体系统的丢失导致了毒力损失,其损失程度变为未丢失时的4.3×105倍。在败血症模型中发现铁载体系统与基因毒素(coliobactin)一起在细菌感染过程中发挥关键作用[82]。此外,有报道称,编码外膜受体的基因psn发生突变时,会导致鼠疫耶尔森菌的毒力减弱至3%[81]。另有一些作者报道,细菌毒力的有无取决于铁载体类型,如有氧肌动蛋白(aerobactin)、耶尔西尼亚肌动蛋白(yersiniabactin)和血红素受体(heme receptors)对大肠杆菌CFT073和尿路感染小鼠模型的毒力很重要,但儿茶酚酸受体对其则无影响[83]。
6.3 铁硫聚合物的形成
铁-硫簇是许多蛋白质中必不可少的辅因子,具有多样的功能,其产生大致源于两种机制,其一是线粒体的铁硫团簇机制(iron-sulfur cluster machinery,ISC)[84],其二是产生胞质铁硫团簇组装 产 物(cytosolic iron-sulfur cluster assembly,CIA)[85-86]。Fe-S簇生物合成对维持细胞稳态具有重要作用,且参与Fe-S簇生物合成的基因都是必需基因,例如铁载体。目前铁载体在真菌中的核心ISC铁感应作用已在酿酒酵母(Saccharomyces cerevisiae)、白色念珠菌(Candida albicans)、酒色 酵 母(Saccharomyces pombe)、假 丝 酵 母(Candida neoformans)、烟 曲 霉 菌(Aspergillus fumigatus)和禾谷镰孢菌(Fusarium graminearum)中得到证实[84-85,87-88]。同时,在海洋中发现隐孢子虫Cryptosporidium fumigatus和白色念珠菌Candida neoformans的铁载体具有与CIA发生物理接触的作用,缺乏铁载体会严重干扰铁硫聚合物的形成,从而引起对细胞的损伤甚至死亡[74,89]。在一些生态现象中(例如海湾沉积物的底质黑臭),本课题组最新的研究发现铁硫聚合物的形成是导致深圳湾沉积物H2S产生的原因,而铁载体的存在为微生物的铁代谢提供了原初动力,其中最活跃的基因是铁存储基因(iron storage genes,ISG)和 铁 转 运 基 因(iron transport genes,ITG)[90]。
6.4 病原体的防控
铁是病原体及其宿主必需的微量元素,然而病原体在感染期间通常会遇到铁限制,因为宿主的铁通常被蛋白质紧紧隔离。在海洋哺乳动物宿主中,铁主要以血红素形式存在于血红蛋白中,以离子的形式存在于胞内储铁蛋白和细胞内铁转运蛋白中,如铁S簇和血红素。为侵染宿主,病原体进化出从宿主那里“偷取”铁的策略。因此,对铁的竞争是决定宿主-病原体关系的关键因素[91-93]。铁载体通过限制细菌必要铁元素的获取,在疾病防控中扮演重要角色[94]。这一过程的主要原理是通过产生转铁蛋白来与宿主竞争铁并抑制宿主生长[95]。宿主的生防机制是依赖于病原菌产生的转铁蛋白与生防菌产生的铁载体在与铁形成配合物方面的竞争,生防菌因铁载体具有较高的铁稳定常数而在博弈中胜出[96]。芽孢杆菌菌株NM 12产生的铁载体具有广泛的抗菌谱,抑制了62.5%的海水鱼类肠道细菌的生长[94]。此外,还发现蜡样芽孢杆菌产生的铁载体可以抑制致病菌嗜水气单胞菌的生长[97]。最近的研究表明荧光假单胞菌可抑制几种常见海洋鱼类病原体(鳗弧菌(Vibrio anguillarum)、霍乱弧菌(Vibrio ordalii)、气单胞菌(Aeromonas salmonicida)、链球菌(Lactococcus garvieae)、海豚 链 球 菌(Streptococcus iniae)、黄 杆 菌 属(Flavobacterium)和嗜冷微生物属(Psychrophilum)),并 当 作 益 生 菌 添 加 剂使用[98-100]。
除了抗病,铁载体还具有规避致病菌耐药性的作用,其原理是借助抗生素分子与铁载体连接形成铁载体-抗生素耦合物,该耦合物能够选择性地结合细胞膜表面的铁载体外膜受体,在此基础上经主动运输进入细胞膜,然后通过释放药物进而发挥抗菌作用[101]。近年来发现高铁霉素可以作为治疗海洋细菌感染的潜在药物[33,102]。高铁霉素是天然产生的可以共价连接到抗生素分子部分的铁载体-药物耦合物,它采用“特洛伊木马策略”[103],将药物分子传递到特定药物分子的靶定位点,起到精准输药的作用。作为一种传递抗生素分子的新型方法,目前高铁霉素对解决细菌的耐药问题具有巨大潜力。此外本课题组最近的研究发现,藻际微生物群落中铁载体的合成、铁离子的氧化和转运可能和有害藻华的开始和消亡有相关性[104]。
7 总结与展望
铁载体在海洋中的作用已有不少探讨,包括其来源、类型、合成途径、生物学功能等,这些为认识微生物的进化策略和海洋铁循环提供了重要帮助,同时也为理解系统层面的海洋微量元素循环提供了视角。然而,基于整个海洋生态系统的生境多样性和时空多变性,同时也基于铁循环的复杂性,有必要在更多的细节上进行精细考虑,以期更好的认识铁载体的驱动作用,未来的工作中可重点关注的方向如下:
a.深入研究铁载体与海洋微生物之间的互作机理。尽管目前针对铁载体影响藻类、细菌、古菌的研究已取得了一定的进展,但研究结果往往局限于对实验现象的描述,部分机理还停留在推测阶段,尚未在大尺度环境中证实铁载体对生物的级联效应或食物链效应。此外,现有的研究工具主要是微生物学方法和组学技术,还缺乏一些“一对一”的功能验证方式,未来需要扩展更为高阶的方法,如拉曼光谱分选、偏振光检测,以及稳定同位素标记等技术。
b.加强合成生物学手段的应用。铁载体的独特生物学作用使得人们对它的研究兴趣与日俱增。伴随合成生物学技术的发展,合成基因簇中特殊功能酶的编辑拓宽了对铁载体类型的选择渠道,提升了铁载体获取能力,也为化学与生物学交叉研究提供了一个很好的支点。例如,开发铁载体-药物耦合物,解决多重耐药性细菌性疾病问题,以及开发特殊功能微生物(益生菌等),进行海洋中生态位营造和受损系统的生态修复等。
c.拓展生物耦合研究。现有的研究主要集中于海洋微生物分泌铁载体的类型、利用铁载体能力、产铁载体的特殊微生物(如固氮、固碳等),而对于铁载体在整个物质循环中的调控机制研究得还较少,尤其是铁载体行为与其他元素(C、N、P、S)的耦合能力。后续的研究需要进一步绑定铁代谢与主导元素的调节过程和生态机制,更好地解释海洋元素的物质循环机理和周转过程,为扩大海洋碳中和的能力探索更多的科学方法。

