EB 病毒感染继发噬血细胞综合征患儿外周血T淋巴细胞亚群及细胞因子水平变化
陈开澜,杨李,宋娜,吴彬,李晖
华中科技大学同济医学院附属武汉儿童医院血液肿瘤科,武汉 430016
噬血细胞淋巴组织细胞增生症(HLH)是由过度活化的淋巴组织细胞无效增生导致的高炎症反应,其产生的细胞因子风暴常引起持续发热、肝脾肿大、多器官功能障碍、血细胞进行性下降、组织细胞吞噬血细胞等现象。HLH 在儿童和婴幼儿高发,起病急,病情进展迅速,病死率高[1]。HLH 分为原发性HLH 和继发性HLH,儿童继发性HLH 原因主要是感染,特别以EB 病毒(EBV)感染最常见。按照国际组织细胞协会推荐的HLH-1994 方案给予激素联合依托泊苷治疗虽然可控制HLH 的高炎症反应,但对EBV 无清除作用,特别是对感染T 淋巴细胞和NK 细胞的EBV 清除无能,往往会导致疾病复燃恶化[2-3]。其他慢病毒诸如乙肝病毒、人类免疫缺陷病毒及某些肿瘤中均存在的T 细胞功能耗竭,即在慢病毒感染及肿瘤负荷的机体中T 淋巴细胞在持续抗原刺激下功能异常状态,主要是抑制性受体表达,分泌细胞因子能力以及穿孔素、颗粒酶的杀伤功能减退,T 淋巴细胞自我更新及增殖能力降低等一系列功能耗竭表现[4-5]。EB 病毒感染后的HLH 可能同样存在这种T 淋巴细胞耗竭而导致T淋巴细胞不能清除感染细胞。本研究对EBV 感染继发噬血细胞综合征(EBV-HLH)患儿的T 淋巴细胞亚群和细胞因子水平进行分析,探讨T 细胞功能耗竭在EBV 感染的HLH 中发挥的作用,为临床诊治提供帮助。
1 资料与方法
1.1 临床资料 EBV 感染确诊标准:实验室检查抗EB 病毒VCA-IgM 和抗EBV-VCA-IgG 抗体阳性,或实时定量聚合酶链式反应(PCR)检测EBV-DNA阳性,满足以上任一种情况即可确诊。HLH 的诊断根据国际组织细胞协会HLH 2004 诊断标准(以下 8 条至少满足 5 条)[3]:①发热;②全血细胞减少(三系中至少两系减少):血红蛋白<90 g/L、血小板<100×109/L 或中性粒细胞<1×109/L;③脾肿大(肋下≥3 cm);④低纤维蛋白原血症和(或)高甘油三酯血症:纤维蛋白原≤1.5 g/L,甘油三酯≥3 mmol/L;⑤骨髓或淋巴结形态学涂片发现吞噬细胞存在,无恶性肿瘤证据;⑥可溶性CD25≥2 400 U/mL;⑦NK 细胞活性减低或缺乏;⑧铁蛋白≥500µg/L。选取 2019 年 2 月—2021 年 11 月我院收治的EBV-HLH 患儿23例,男15例、女8例,年龄1.6~14 岁、中位年龄5.6 岁,外周血免疫球蛋白IgG(9.9 ± 2.9)g/L,EBV-DNA 载量 2 480(87,7 030)×103copies/mL;另选择同期收治的EBV 感染相关传染性单核细胞增多症(IM)患儿29 例作为对照组,男 22 例、女 7 例,年龄 1.8~13 岁、中位年龄3.9 岁,外周血免疫球蛋白IgG(11.08 ± 3.25)g/L,EBV-DNA 载 量 937(176,2 210)×103copies/mL。两组性别、年龄、外周血免疫球蛋白水平及EBVDNA 载量具有可比性。
1.2 外周血T 淋巴细胞亚群检测 使用EDTA 抗凝管采集患儿静脉血2 mL,24 h内上BD 公司FACSCantoⅡ流式细胞仪检测。取100 µL 血加入PECD3、FITC-CD57、PE-Cy7-CD4、Apc-CD279(PD1)、V450-CD69、V500-CD45、Apc-Cy7-CD8 各 20 µL,同时设同型对照管。混匀后4 ℃避光孵育30 min,离心、洗涤、弃上清液,加入0.5 mL 预冷的PBS 重悬细胞,上流式细胞仪分别检测CD3(+总T 淋巴细胞)及CD4+CD3(+调节性T 淋巴细胞)、CD8+CD3(+杀伤性T淋巴细胞)亚群中的PD1+细胞(程序化死亡受体)、CD57+细胞(终末衰老T细胞)、CD69+活化细胞(刺激后活化的T细胞)比例。每管获取10 000个细胞,结果以百分率表示。
1.3 外周血T 淋巴细胞因子水平检测 采集患儿EDTA 抗凝的静脉血2 mL,应用BD 公司FACSCantoⅡ流式细胞仪和江西诺德医疗器械有限公司试剂盒,将捕获微球混合液(包含抗人IL-2 单抗、抗IL-4单抗、抗 IL-6 单抗、抗 IL-10 单抗、抗 TNF-α 单抗、抗IFN-γ 单抗)低速离心 2 000 r/min 离心 5 min,吸去上清,加入与所吸走上清等体积的微球缓冲液,涡旋充分混匀后,避光孵育30 min。每个实验管中加25 µL 孵育后的捕获微球混匀液,标准管加入25µL梯度稀释好的标准品,样本管加入25µL 待测血浆。所有实验管加25 µL 荧光抗体检测试剂,室温孵育2.5 h,加入 PBS 缓冲液,离心弃上清,加入 100 µL PBS 缓冲液,上机进行荧光检测 IL-2、IL-4、IL-6、IL-10、TNF-α、IFN-γ水平。
1.4 统计学方法 采用SPSS22.0 统计软件。采用Shapirowilk 检验和Q-Q图方法进行正态分布检验,符合正态分布的计量资料以表示,组间比较采用独立样本t检验;非正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-WhitneyU检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组T 淋巴细胞亚群比较 EBV-HLH 组活化的CD69+CD3+T 淋巴细胞比例高于EBV-IM 组,PD1+CD3+T 淋 巴 细 胞 比 例 低 于 EBV-IM 组(P<0.05),两组CD57+CD3+T 淋巴细胞比例无统计学差异(P>0.05),见表1。进一步比较显示,EBV-HLH组CD69+CD3+T 淋巴细胞主要以CD69+CD8+CD3+T淋巴细胞增高为主(P<0.05),而CD69+CD4+CD3+T淋巴细胞增高不明显(P>0.05);PD1+CD3+T 淋巴细胞主要以PD1+CD8+CD3+T 淋巴细胞减少为主(P<0.05),而PD1+CD4+CD3+T淋巴细胞减少不明显(P>0.05)。见表2。
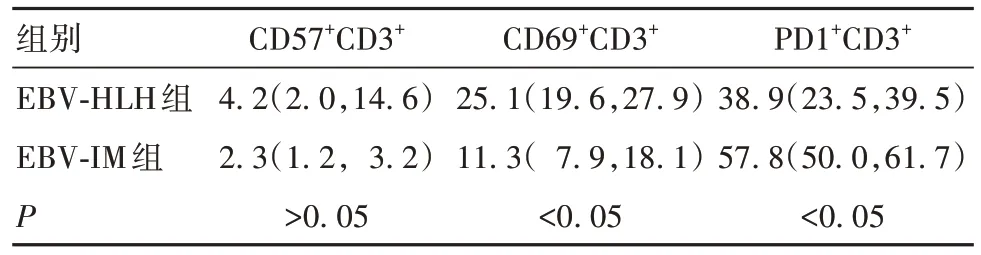
表1 两组CD3+T淋巴细胞中CD57+、CD69+及PD1+细胞比例比较[%,M(P25,P75)]

表2 两组CD4+CD3+及CD8+CD3+T淋巴细胞亚群中CD69+和PD1+细胞比例比较[%,(P25,P75)]
2.2 两组外周血细胞因子水平比较 见表3。
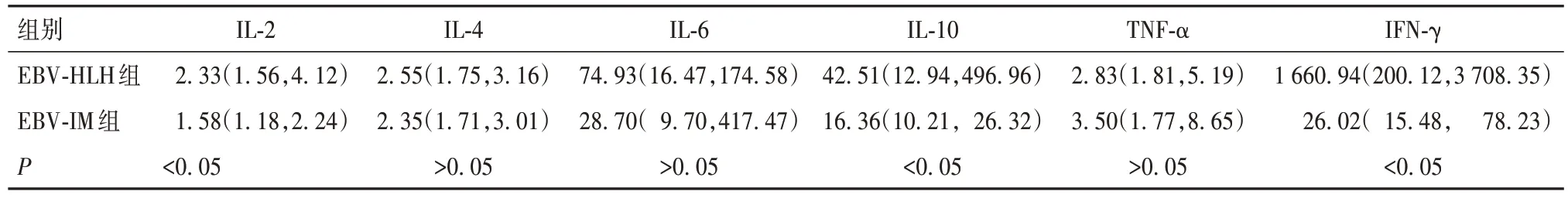
表3 两组外周血细胞因子水平比较[ng/L,M(P25,P75)]
3 讨论
目前,HLH 的治疗主要采用国际组织细胞协会的HLH-94/2004方案,包括地塞米松、依托泊苷等药物,治疗目标是抑制组织细胞/巨噬细胞过度激活和增殖导致的细胞因子风暴[6]。理想的EBV-HLH治疗不仅要控制细胞因子风暴,同时还要修复受损的免疫细胞功能,从而最终清除EBV感染细胞,达到从根本上治愈疾病。EBV-IM为原发性EBV感染,病毒多在B淋巴细胞内复制,杀伤性T淋巴细胞(CTLs)则负责清除感染的B 淋巴细胞,同时产生记忆细胞。而EBV-HLH的发病机制与IM不同,EBV多感染T淋巴细胞或NK 细胞,CTLs 清除病毒感染的细胞能力下降,被感染的细胞出现克隆增殖,引起持续性无效的T淋巴细胞和巨噬细胞激活,导致细胞因子大量释放和级联反应,从而形成噬血细胞综合征[7-8]。本研究结果显示,EBV-HLH 组 CD69+CD3+的活化 T 淋巴细胞比例高于EBV-IM 组,提示EBV-HLH 确实激活了更多的活化T 淋巴细胞进入血液,且主要激活的是CD69+活化细胞。EBV-HLH的发生与EBV感染负荷无明显相关性,表现为EBV-HLH 组与EBV-IM 组的病毒载量无明显差异。已有研究表明,细胞免疫而非体液免疫在EBV-HLH发挥主导作用,恢复受损的细胞免疫功能才能从根本上治愈EBV-HLH[9-10]。本研究中也显示,两组患儿外周血IgG、IgM等体液免疫的球蛋白水平接近,无明显差异。
T 细胞功能耗竭主要表现为细胞增殖能力下降、细胞毒作用减低甚至丧失、分泌细胞因子能力降低。细胞功能丢失按等级依次出现,首先丢失的是细胞毒性、增殖能力和IL-2产生能力,随后丢失的是TNF-α 产生能力,严重的耗竭则出现病毒特异性细胞部分或完全丧失细胞毒脱颗粒的能力,最终导致病毒特异性T 淋巴细胞凋亡[11-12]。既往研究认为,CD57、KLRG1 和PD1 均与细胞的复制性衰老相关,表达这些标志物的细胞增殖能力较弱,生长停滞,自我更新减退,丧失分化能力,对增殖刺激反应差[13]。但PD1 和CD57 并不总是同时表达,特别是终末分化效应记忆细胞(TEMRA)群会表达更高的CD57 和KLRG1但不表达PD1,而效应记忆性细胞(CD28-CD 45RA-)通常高表达PD1但却无CD57,这种差异性表达可能代表细胞从高增殖/低细胞毒性功能转换为低增殖/高细胞毒性[14]。终末效应细胞 TEMRA 有高水平的CD57 表达与复制性衰老有关,而程序化死亡受体PD1表达在效应记忆细胞与免疫细胞的耗竭有关。本研究结果显示,EBV-HLH 组与EBV-IM组CD57+CD3+T 淋巴细胞比例无明显差异,而PD1+CD3+T 淋巴细胞 EBV-HLH 组较 EBV-IM 组明显减少,说明这种代表复制性衰老的终末效应细胞在两组间无明显区别,而代表低增殖高细胞毒性的PD1+CD3+T 淋巴细胞在EBV-HLH 组明显减少。提示效应功能的T淋巴细胞减少而不是凋亡衰老导致EBV-HLH 发生。特别是在EBV-HLH 组中,以PD1+CD8+CD3+T 淋巴细胞减少为主而非PD1+CD4+CD3+T 淋巴细胞减少,也表明是T 淋巴细胞杀伤功能受损而非调节功能受损导致EBV-HLH,即EBVHLH中T淋巴细胞的耗竭主要表现在PD1+CD8+CD3+T淋巴细胞的耗竭。这为PD-1和PD-L1等程序化死亡受体相关因子在EBV-HLH 中的应用提供了部分依据。ROBERTS 等[15]在外周血单个核细胞培养体系中用PD1 特异性抗体pembrolizumab 阻断PD1/PDL1相互作用,可恢复PD1+T淋巴细胞的分泌细胞因子功能,表明免疫耗竭是可逆的。LIU 等[16]在EBV-HLH 患者中应用 PD1 抑制剂 Nivolumab,提高了PD-1、LAG-3表达的细胞毒性T淋巴细胞亚群,增强了T 淋巴细胞清除EBV 感染细胞的能力,同时控制了HLH的发展。
IL-2和IFN-γ促进T淋巴细胞终末分化与扩增,大量的静止T细胞转化为效应T细胞,而IL-10抑制T淋巴细胞增殖。IL-2由Th1细胞产生,使静止T淋巴细胞转化为活化T淋巴细胞,促进T淋巴细胞增殖及分化,IL-2增强CTLs、NK细胞杀伤活性及诱导IFN-γ产生[8]。IFN-γ 可以促进 T 淋巴细胞的增殖与分化,从而促使T淋巴细胞活化为效应细胞。活化的效应T淋巴细胞和巨噬细胞释放大量细胞因子,持续刺激T淋巴细胞和巨噬细胞不受控制的增殖,导致大量终末分化阶段的T淋巴细胞产生,T淋巴细胞一方面被耗竭,一方面其正常的杀伤功能减弱[14,17]。IL-10 高表达具有免疫抑制作用,抑制人IL-2分泌,抑制Th细胞分化及T淋巴细胞增殖[8]。本研究结果显示,EBVHLH组IL-2、IFN-γ水平较EBV-IM组升高,这两种细胞因子持续刺激可能导致T淋巴细胞大量进入终末分化阶段(持续被耗竭)而减弱其细胞毒杀伤作用;同时抑制性细胞因子IL-10 在EBV-HLH 组较EBVIM 组升高,抑制了正常T 淋巴细胞增殖。本研究与既往汤永民等[19]报道的HLH患儿Th1/Th2细胞因子谱表达差异相符,也一定程度上说明EBV-HLH中受损的细胞免疫功能可能由于T淋巴细胞耗竭导致。
总之,本研究支持在EBV-HLH 中存在以T 细胞功能耗竭为主的疾病发展机制,提示程序化死亡因子及其受体拮抗剂在EBV-HLH 应用具有一定临床意义。进一步研究需要通过单细胞功能测序探讨耗竭T淋巴细胞的具体亚型对免疫检查点拮抗剂具有最佳响应,从而依据其表型筛选出更适合应用免疫检查点抑制剂患者。

