卵泡抑素相关基因3 对肿瘤相关巨噬细胞在乳腺癌增殖、迁移和侵袭中的机制研究
吕凌云,彭宇,鲁亚琴,房贺,陈艳,姜玉,汪志平
世界卫生组织国际癌症研究机构(International Agency for Research on Cancer,IARC)发布的2020 年全球癌症数据显示,乳腺癌是目前全球新增发病人数最多的癌症[1]。在女性人群中,乳腺癌的发病率和死亡率呈现出逐年上升的趋势。控制乳腺癌的发生与发展,成为防治乳腺癌亟待解决的问题。
肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)是来源于外周血和组织中的巨噬细胞,占肿瘤质量的50%[2]。乳腺癌患者体内TAMs的积累通常与预后不良、治疗耐药和疾病复发有关[3]。TAMs 是连接炎症和肿瘤的关键细胞,可通过释放多种细胞因子和基质蛋白酶直接促进肿瘤的发生、发展和转移,或通过介导肿瘤血管生成和免疫抑制间接促进肿瘤生长[4]。TAMs 已成为癌症治疗的重要靶点。
卵泡抑素相关基因3(follistatin-related gene 3,FSTL3)是一种致癌基因,编码分泌型糖蛋白,与肿瘤细胞增殖和转移密切相关[5]。临床乳腺癌患者的肿瘤上皮细胞中具有FSTL3 高表达,提示FSTL3 可能参与调控乳腺癌的发生、发展,并可作为乳腺癌诊断的潜在血浆标志物[6]。最近有研究发现,FSTL3可通过调控骨形成蛋白(bone morphogenetic protein,BMP)信号通路,促进M2 型巨噬细胞极化,从而促进肿瘤进展[7]。但FSLT3 是否能够直接调控巨噬细胞的促肿瘤功能,还不清楚。本研究旨在评估FSTL3 在乳腺癌患者TAMs 中的表达,并探索FSTL3 是否可通过调控巨噬细胞的极化,促进乳腺癌的发展,为将来研究乳腺癌的致病机制和治疗提供参考。
1 材料与方法
1.1 材料
1.1.1 样本来源 收集2018 年3 月至2021 年3 月在海军军医大学第一附属医院接受切除手术的21 例乳腺癌患者的肿瘤及其癌旁组织(距肿瘤边缘≥3 mm)。所有患者均是原发病例,手术前未接受放疗和化疗。该研究方案在海军军医大学第一附属医院伦理委员会的监督下获得批准和实施(CHEC2017-096),患者均签署知情同意书。
1.1.2 主要材料 人单核细胞白血病细胞株THP-1 和人乳腺癌细胞株MCF7 购自中科院上海细胞库,胎牛血清(fetal bovine serum,FBS)、DMEM 和RPMI1640 培养基购自Giboco 公司,干扰素-γ(interferon-γ,IFN-γ)、白细胞介素-4(interleukin-4,IL-4)、TRIzol 试剂和LipofectamineTM3000 购自Invitrogen 公司,RNA 逆转录试剂盒和SYBR Green 试剂购自上海翌圣公司,Percoll 分离液、基质胶、佛波酯(phorbol-12-myristate-13-acetate,PMA)购自Sigma公司,细胞计数试剂盒CCK8 试剂购自南京诺维赞公司,Transwell 小室购自康宁公司,CD14 抗体、CD86 抗体、CD206 抗体购自BD 公司,FSTL3 抗体、3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体购自Proteintech 公司,FSTL3 和GAPDH 引物由生工生物工程(上海)股份有限公司合成,si-FSTL3 和si-阴性对照(si-Negative Control,NC)通过Merck 公司合成。
1.2 方法
1.2.1 细胞培养 MCF7 和THP-1 在37℃,5%CO2条件下培养。DMEM 和RPMI1640 培养基中含0.1 mg/ml 链霉素、青霉素和10%FBS。MCF7 使用DMEM 培养基培养,THP-1 使用RPMI1640 培养基培养,每2 d 更换1 次新鲜培养基。当细胞在其达到70%~90%密度,进行细胞传代或实验。
1.2.2 原代巨噬细胞的分离及培养 将收集的乳腺癌肿瘤及其癌旁组织转移至培养皿中,使用PBS浸泡并洗涤3 次。将组织剪成细小碎块,加入2 mg/ml的Ⅳ型胶原蛋白酶和0.25 mg/ml 透明质酸酶重悬组织,并转移至离心管。37 ℃,180 r/min 恒温消化2 h,每30 min 吹打1 次。消化所得细胞悬液过40 μm 筛网,收集滤过夜,2 000 r/min 离心5 min。使用PBS 重悬细胞,利用percoll 法分离巨噬细胞。吸取中间白色层巨噬细胞,用于后续实验。
1.2.3 PMA/IFN-γ 和PMA/IL-4 诱导THP-1 细胞将THP-1 细胞按3×105个/ml 数量铺至6 孔板内。加入含终浓度50 ng/ml PMA 的培养基诱导24 h后,获得初始巨噬细胞。弃培养液,PBS 清洗细胞。分别加入含终浓度20 ng/ml IFN-γ 和20 ng/ml IL-4的培养基诱导48 h,使细胞分化为M1 型和M2 型巨噬细胞。
1.2.4 siRNA 细胞转染 将THP-1 按3×105个/ml数量接种至6 孔板中,在细胞培养箱中培养过夜。按照LipofectamineTM3000 转染试剂说明将si-FSTL3和si-NC 转染至THP-1 中。更换新鲜培养基后继续培养2 d,进行后续实验。
1.2.5 THP-1 细胞分组以及THP-1 和MCF7 细胞共孵育 将THP-1 细胞分为5 组:使用PMA、PMA/IFN-γ 和PMA/IL-4 诱导THP-1 为初始、M1 型和M2型巨噬细胞,分别为PMA 组、PMA/IFN-γ 组、PMA/IL-4 组;采用脂质体转染法将si-FSTL3、si-NC 转染至THP-1,再使用PMA/IL-4 诱导转染后的THP-1,分别为si-FSTL3 组、si-NC 组。
将MCF7 按3×105个/ml 接种至6 孔板中,细胞培养箱中培养过夜,待细胞完全贴壁后,分别加入各组巨噬细胞上清继续孵育12 h。孵育后的MCF7细胞用于后续实验。
1.2.6 流式细胞术检测巨噬细胞分型 收集各组巨噬细胞,PBS 洗涤细胞2 次。随后利用不同荧光标记的CD14 抗体、CD86 抗体、CD206 抗体在4℃孵育40 min,染色后细胞重悬在流式细胞分析染色液(flow cytometry staining,FCS)buffer 中进行上机检测。使用FlowJo 10.0 软件进行流式数据分析,用前向角散射(forward scatter,FSC)和侧向角散色(side scatter,SSC)设门圈出活细胞群,通过CD14 设门圈出巨噬细胞群;通过CD86 设门圈出M1 型巨噬细胞;通过CD206 设门圈出M2 型巨噬细胞。
1.2.7 CCK8 细胞增殖实验 将各组细胞按5×104个/ml 数量接种于96 孔板中,细胞培养箱中培养过夜,待细胞完全贴壁后。分别继续培养24、48 和72 h。根据CCK8 检测试剂说明进行细胞增殖实验,使用酶标仪检测450 nm 波长下的吸光值。
1.2.8 细胞侵袭实验 在小室(transwell)中铺上基质胶,小室浸没在含DMEM 培养基的24 孔板中。将各组MCF7 按3×105个/ml 数量接种至小室中。在细胞培养箱中培养24 h。取出小室置于室温,使用4% 的多聚甲醛固定20 min,再用0.1% 结晶紫染色20 min,最后用PBS 洗涤2 次后在显微镜下拍照并计数,随机取10 个视野,取平均数,每组重复6 次。
1.2.9 细胞划痕实验 将MCF7 按3×105个/ml 数量接种至6 孔板中,细胞培养箱中培养过夜,待细胞完全贴壁后。用枪头尖端在各组细胞上进行垂直划痕。使用PBS 洗涤细胞2 次,在显微镜下拍照记录。继续培养24 h 后再次拍照记录,通过Image J 软件进行距离测量,每组重复6 次。
1.2.10 实时荧光定量聚合酶链式反应法 按照RNA 提取试剂说明书方法提取各组细胞RNA,使用反转录试剂盒将RNA 反转录成cDNA。随后使用SYBR Green 进行实时荧光定量聚合酶链式反应(qualitative real time polymerase chain reation,qRTPCR)。FSTL3 上游引物:5’-GTGCCTCCGGCAACATTGA-3’下 游 引 物:5’-GCACGAATCTTTGCAGGGA-3';GAPDH 上游引物:5’-AGGTCGGTGTGAACGGATTTG-3’,下游引物:5’-TGTAGACCATGTAGTTGAGGTCA-3。反应条件:95℃预变性1 min;95℃20 s,60℃1 min;72℃延伸5 min,共40个循环。GAPDH 为内参基因,采用2-ΔΔCT法计算FSTL3 的相对表达量,实验重复3 次。
1.2.11 Western blotting 法 在各组细胞中加入RIPA 裂解液(含蛋白酶抑制剂)裂解细胞,离心收集上清液。通过BCA 法测定上清液的蛋白浓度,按30 μg/孔进行SDS-PAGE 凝胶电泳。随后依次进行转膜、抗原封闭、一抗孵育(4℃,12 h)。第2 天加入荧光二抗孵育,最后加入曝光液在凝胶成像仪下拍照。一抗稀释比例:FSTL3(1∶1 000)、GAPDH(1∶3 000)。
1.3 统计学处理
采用SPSS 20.0 统计学软件进行数据分析。计量资料以±s表示,组间单因素比较使用Student’st检验分析,双因素比较使用two-way ANOVA 分析。P<0.05 表示差异有统计学意义。
2 结果
2.1 乳腺癌TAMs 分型和FSTL3 表达量检测
采用流式细胞术检测乳腺癌肿瘤及其癌旁组织中巨噬细胞分型,结果显示肿瘤组织中CD206 阳性的巨噬细胞比例高于癌旁组织,两者比较差异具有统计学意义(P<0.05),而CD86 阳性的巨噬细胞比例与癌旁组织相比无明显差异。见表1。说明乳腺癌TAMs 呈M2 型极化。qRT-PCR 结果显示肿瘤组织中TAMs 的FSTL3 mRNA 表达水平高于癌旁组织,差异具有统计学意义(P<0.05),说明乳腺癌TAMs 高表达FSTL3。见表2。
表1 乳腺癌及其癌旁组织中TAMs 分型检测(%,±s,平行样例数n=3)

表1 乳腺癌及其癌旁组织中TAMs 分型检测(%,±s,平行样例数n=3)
注:与癌旁组织比较aP<0.001
组织肿瘤组织癌旁组织CD206 55.35±2.32a 15.23±1.25 CD86 12.72±0.23 14.36±0.57
表2 乳腺癌及其癌旁组织中FSTL3 的mRNA 水平(± s,平行样例数n=3)

表2 乳腺癌及其癌旁组织中FSTL3 的mRNA 水平(± s,平行样例数n=3)
注:与癌旁组织比较aP<0.001;FSTL3 为卵泡抑素相关基因3
FSTL3 mRNA 12.32±0.97a 1.01±0.21组织肿瘤组织癌旁组织
2.2 PMA/IFN-γ 和PMA/IL-4 诱导THP-1 分型鉴定和FSTL3 表达量检测
对PMA、PMA/IFN-γ 和PMA/IL-4 诱导后的THP-1 巨噬细胞进行细胞分型鉴定,流式细胞术结果显示,与PMA 组相比,PMA/IFN-γ 组CD86 阳性细胞的比例增加,差异具有统计学意义(P<0.05)。与PMA 组相比,PMA/IL-4 组CD206 阳性细胞的比例增加,差异具有统计学意义(P<0.001)。见表3。说明PMA/IFN-γ 和PMA/IL-4 分别诱导THP-1 为M1 和M2 型巨噬细胞成功。qRT-PCR 和Western blot 结果显示与PMA 组相比,PMA/IL-4 组细胞FSTL3 mRNA 和蛋白表达水平增加,差异具有统计学意义(P<0.001),而PMA 组和PMA/IFN-γ 组间比较差异无统计学意义(P>0.05)。见表4、图1。说明PMA/IL-4 诱导后的M2 型THP-1 巨噬细胞FSTL3 表达水平增加,与乳腺癌TAMs 表型更为接近,因此选择此组细胞进行后续研究。
表4 M1 型和M2 型巨噬细胞中FSTL3 的mRNA 和蛋白水平(± s,平行样例数n=3)

表4 M1 型和M2 型巨噬细胞中FSTL3 的mRNA 和蛋白水平(± s,平行样例数n=3)
注:与PMA 组比较aP<0.001;IFN-γ 为干扰素-γ,IL-4 为白细胞介素-4,PMA 为佛波酯,FSTL3 为卵泡抑素相关基因3,GAPDH 为3-磷酸甘油醛脱氢酶
FSTL3 蛋白0.24±0.11 0.38±0.13 1.21±0.12a组别PMA 组PMA/IFN-γ 组PMA/IL-4 组FSTL3 mRNA 1.00±0.24 0.92±0.26 6.35±0.87a
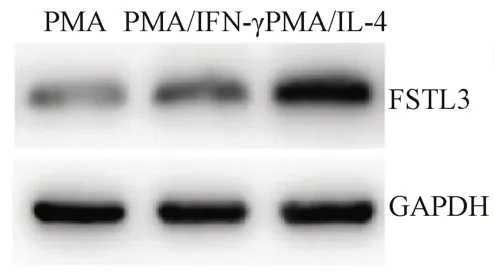
图1 M1 型和M2 型巨噬细胞中FSTL3 蛋白水平检测
表3 诱导THP-1 为M1 及M2 型巨噬细胞鉴定(%,± s,平行样例数n=3)

表3 诱导THP-1 为M1 及M2 型巨噬细胞鉴定(%,± s,平行样例数n=3)
注:与PMA 组比较aP<0.001;IFN-γ 为干扰素-γ,IL-4 为白细胞介素-4,PMA 为佛波酯
CD206 8.34±2.12 8.25±2.32 89.92±3.39a组别PMA 组PMA/IFN-γ 组PMA/IL-4 组CD86 7.24±1.28 87.12±4.25a 9.74±1.74
2.3 TAMs 促进MCF7 细胞增殖
收集PMA 和PMA/IL-4 诱导后的THP-1 巨噬细胞上清与MCF7 细胞共孵育,采用CCK8 检测MCF7 细胞24、48、72 h 的增殖情况。结果显示与PMA 组相比,PMA/IL-4 组细胞的增殖能力增加,在72 h 时差异具有统计学意义(P<0.01)。见表5。说明TAMs 上清能够促进乳腺癌细胞增殖。
表5 M2 型巨噬细胞对MCF7 细胞增殖能力的影响(± s,平行样例数n=3)
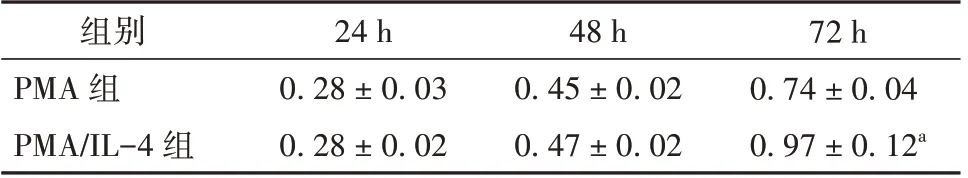
表5 M2 型巨噬细胞对MCF7 细胞增殖能力的影响(± s,平行样例数n=3)
注:与PMA 组比较aP<0.01;IL-4 为白细胞介素-4,PMA 为佛波酯
72 h 0.74±0.04 0.97±0.12a组别PMA 组PMA/IL-4 组24 h 0.28±0.03 0.28±0.02 48 h 0.45±0.02 0.47±0.02
2.4 TAMs 促进MCF7 细胞迁移和侵袭
收集PMA 和PMA/IL-4 诱导后的THP-1 巨噬细胞上清与MCF7 细胞共孵育,通过Transwell 实验检测对MCF7 细胞侵袭能力的影响。结果显示与PMA 组相比,PMA/IL-4 组细胞侵袭能力增加,差异具有统计学意义(P<0.001)。见图2A、表6。采用细胞划痕检测对MCF7 细胞迁移能力的影响。结果显示与PMA 组相比,PMA/IL-4 组细胞24 h 内相对迁移能力增强,差异具有统计学意义(P<0.001)。见图2B、表6。说明TAMs 上清能够促进乳腺癌细胞迁移和侵袭。
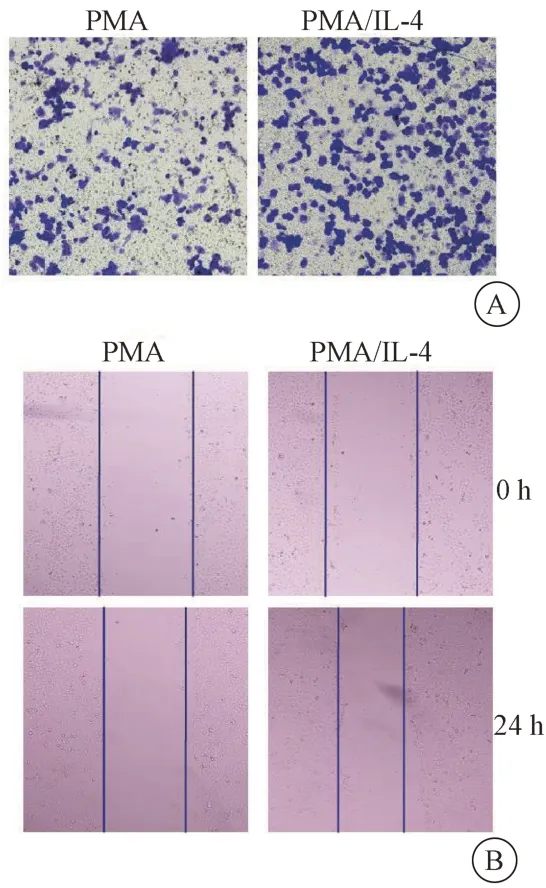
图2 M2 型巨噬细胞对MCF7 细胞侵袭和迁移能力的影响
表6 M2 型巨噬细胞对MCF7 细胞侵袭和迁移能力的影响(± s,平行样例数n=6)

表6 M2 型巨噬细胞对MCF7 细胞侵袭和迁移能力的影响(± s,平行样例数n=6)
注:与PMA 组比较aP<0.01;IL-4 为白细胞介素-4,PMA 为佛波酯
组别PMA 组PMA/IL-4 组相对迁移率(%)16.32±0.77 24.24±2.16a侵袭细胞数(个)143±6 248±8a
2.5 沉默FSTL3 对TAMs 极化影响
使用si-NC 和si-FSTL3 分别转染THP-1 细胞后,再使用PMA/IL-4 进行诱导,通过qRT-PCR 和Western blotting 检测FSTL3 的mRNA 和蛋白表达水平。结果显示与si-NC 组相比,si-FSTL3 组细胞FSTL3 的mRNA 和蛋白表达水平降低,差异具有统计学意义(P<0.01)。见图3、表7。说明沉默FSTL3 有效拮抗PMA/IL-4 诱导的TAMs FSTL3 表达水平增加。通过流式细胞术检测si-NC 组和si-FSTL3 组巨噬细胞分型,结果显示与si-NC 组相比,si-FSTL3 组CD206 阳性细胞的比例减少,差异具有统计学意义(P<0.001),而2 组间CD86 阳性细胞的比例无明显差异。见表8。说明沉默FSTL3 有效拮抗PMA/IL-4 诱导THP-1 向M2 型TAMs 极化。

图3 沉默FSTL3 对TAMs 中FSTL3蛋白表达水平的影响
表7 沉默FSTL3 的mRNA 和蛋白表达(± s,平行样例数n=3)

表7 沉默FSTL3 的mRNA 和蛋白表达(± s,平行样例数n=3)
注:与si-NC 组相比aP<0.01;FSTL3 为卵泡抑素相关基因3,GAPDH 为3-磷酸甘油醛脱氢酶
FSTL3 蛋白0.43±0.08 0.22±0.07a组别si-NC 组si-FSTL3 组FSTL3 mRNA 1.00±0.12 0.26±0.04a
表8 沉默FSTL3 对TAMs 极化影响(%,± s,平行样例数n=3)

表8 沉默FSTL3 对TAMs 极化影响(%,± s,平行样例数n=3)
注:与si-NC 组相比aP<0.001;FSTL3 为卵泡抑素相关基因3,TAMs 为肿瘤相关巨噬细胞
CD206 87.13±2.63 43.21±3.63a组别si-NC 组si-FSTL3 组CD86 8.93±1.36 8.34±1.73
2.6 沉默FSTL3 拮抗TAMs 对MCF7 细胞的促增殖作用
收集si-NC 组和si-FSTL3 组上清与MCF7 细胞共孵育,采用CCK8 检测MCF7 细胞24、48、72 h 的增殖情况。结果显示与si-NC 组相比,si-FSTL3 组细胞的增殖能力减弱,在72 h 时差异具有统计学意义(P<0.05)。见表9。说明沉默FSTL3 有效拮抗TAMs 促进MCF7 细胞增殖的能力。
表9 沉默FSTL3 对TAMs 促MCF7 细胞增殖作用中的影响(± s,平行样例数n=3)

表9 沉默FSTL3 对TAMs 促MCF7 细胞增殖作用中的影响(± s,平行样例数n=3)
注:与si-NC 组相比aP<0.05;IL-4 为白细胞介素-4,PMA 为佛波酯,FSTL3 为卵泡抑素相关基因3
72 h组别24 h 48 h 0.82±0.09 0.63±0.08a PMA 组PMA/IL-4 组0.29±0.01 0.29±0.04 0.52±0.02 0.46±0.02
2.7 沉默FSTL3 拮抗TAMs 对MCF7 细胞的促迁移和侵袭作用
收集si-NC 组和si-FSTL3 组上清与MCF7 细胞共孵育,通过Transwell 实验检测对MCF7 细胞侵袭能力的影响。结果显示与si-NC 组相比,si-FSTL3组细胞侵袭数量减少,差异具有统计学意义(P<0.05)。见图4A、表10。采用细胞划痕检测对MCF7 细胞迁移能力的影响。结果显示与si-NC 组相比,si-FSTL3 组细胞24 h 内相对迁移能力减弱,差异具有统计学意义(P<0.05)。见图4B、表10。说明沉默FSTL3 有效拮抗TAMs 促进MCF7 细胞迁移和侵袭的能力。
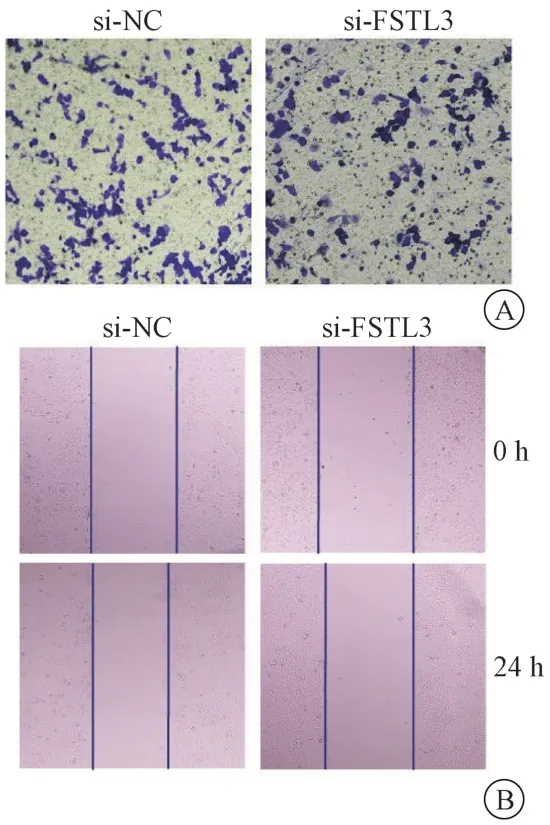
图4 沉默FSTL3 对TAMs 促进MCF7 细胞侵袭和迁移的影响
表10 沉默FSTL3 对TAMs 促进MCF7 细胞侵袭和迁移能力的影响(± s,平行样例数n=6)

表10 沉默FSTL3 对TAMs 促进MCF7 细胞侵袭和迁移能力的影响(± s,平行样例数n=6)
注:与si-NC 组比较aP<0.05;FSTL3 为卵泡抑素相关基因3,TAMs 为肿瘤相关巨噬细胞
相对迁移率(%)20.15±1.38 12.63±0.43a组别si-NC 组si-FSTL3 组侵袭细胞数(个)145±5 109±7a
3 讨论
乳腺癌是全球女性癌症相关死亡的主要原因之一,由于其高复发率和转移率,导致其死亡率呈逐年上升趋势[8]。目前的乳腺癌治疗是以手术治疗为主,再辅以放疗、化疗内分泌治疗、靶向治疗等综合治疗,但乳腺癌的存活率因分期不同仍有很大差异[9]。乳腺癌的发生发展与长期的慢性炎症有关,炎症下巨噬细胞浸润,分化为经典活化巨噬细胞M1 型和替代活化巨噬细胞M2 型[10]。Sousa 等[11]发现,在乳腺癌的肿瘤微环境中,乳腺癌细胞分泌因子调节巨噬细胞向M2 型分化。Li 等[12]发现,通过抑制TAMs 的数量来重塑免疫抑制性肿瘤微环境(tumor microenvirmment,TME),能够抑制乳腺癌的免疫逃逸和转移。Mu 等[13]的研究表明,乳酸可以通过细胞外调节蛋白激酶/信号转导与转录激活因子(extracellular regulated protein kinases/signal transducer and activator of transcription3,ERK/STAT3)信号通路刺激巨噬细胞M2 型极化,以促进乳腺癌增殖、迁移和血管生成,从而驱动乳腺癌发展。本研究显示,乳腺癌患者的肿瘤组织中的TAMs 呈M2型极化,极化后的TAMs 可以促进乳腺癌细胞的增殖以及迁移,说明巨噬细胞向M2 型巨噬细胞极化在乳腺癌的发生发展中扮演重要角色。
近年越来越多的研究表明,FSTL3 与癌症的发病机制相关。FSTL3 在非小细胞肺癌组织中的表达增加,在体外和体内,敲低FSTL3 显著抑制了肺癌细胞的活力和迁移、侵袭能力[14]。Razanajaona 等[15]发现,在乳腺癌中FSTL3 通过抵消激活素来促进肿瘤细胞的增殖。此外最新研究发现FSTL3 家族成员可作为乳腺癌的替代标志物,也可以作为人类浸润性乳腺癌的预后标志[16]。本研究发现,乳腺癌TAMs 中FSTL3 的表达明显增加,暗示FSTL3 影响TAMs 在乳腺癌中的作用。已有文献报道,在许多疾病模型中,FSTL3 被证明和巨噬细胞之间存在相互作用。在动脉粥样硬化中,FSTL3 促进巨噬细胞中的脂质积累,刺激巨噬细胞分泌炎性细胞因子和趋化因子从而加重疾病的进展[17]。Liu 等[7]发现,在胃癌患者中FSTL3 表达与M2 浸润呈正相关,FSTL3 的过表达促进M2 型TAMs 的增殖,FSTL3敲低后降低了胃癌细胞迁移和侵袭能力。此外,FSTL3 还可以通过促进巨噬细胞和成纤维细胞极化和T 细胞耗竭形成抑制性免疫微环境来加速结肠癌的发生[18]。本研究发现PMA/IL-4 诱导THP-1 向M2 型TAMs 极化后,FSTL3 的表达水平增加,而沉默FSTL3 有效拮抗PMA/IL-4 诱导THP-1 向M2 型TAMs 极化,说明FSTL3 能够促进巨噬细胞向M2 型极化的过程。当FSTL3 过表达时,能够促进TAMs对于MCF7 增殖、迁移及侵袭的作用,而沉默FSTL3,将拮抗TAMs 对MCF7 细胞的促进恶化作用。上述结果说明在乳腺癌中,FSTL3 通过促进TAMs 的M2 型分化,促进了癌细胞的增殖、迁移和侵袭。
综上所述,乳腺癌患者肿瘤组织中存在的TAMs 呈M2 型极化,FSTL3 在TAMs 中呈现高表达。FSTL3 通过促进TAMs 的M2 型极化增加了MCF7 细胞的增殖、迁移和侵袭。以上结果初步明确了FSTL3 及M2 型TAMs 在乳腺癌发生发展中的作用,可为进一步探讨乳腺癌增殖和转移机制提供新的思路。

