生物炭对甜瓜幼苗质量与根系生理特性的影响
马光恕,梁 枭,张 渟,李润哲,廉 华
(黑龙江八一农垦大学园艺园林学院,黑龙江 大庆 163319)
生物炭是一种新型的土壤改良剂,是当前农业、环境等领域共同关注的热点。生物炭是在厌氧或无氧条件下,经高温热解(350~600℃)产生的一种多孔富碳、高度芳香化难溶性的固态物质,具有稳定性强、比表面积大、吸附能力强的特点[1],近几年因其独特的结构特征和理化性状,在土壤理化改良、增加土壤肥力及提高作物产量等方面具有良好的效果[2-5]。生物炭主要是通过有机物质在缺氧的环境下热解所形成的,不同的原料以及生产方式都会影响到生物炭的性能[6]。
根系作为植物的主要器官之一,具有吸收、分泌和感知等多种重要的生理功能[7]。根系不仅为植物从土壤中吸收水分和矿质营养的主要器官[8],更是多种激素、氨基酸与有机酸合成的重要场所,其形态与生理指标对地上部的生长发育、产量和品质形成均有重要作用[9]。根系的功能受根系的形态和生理指标影响,并且也需要良好的根系来支撑地上部分的正常生长[10]。因此在作物生产中,通过营养调控促进根系发育、提高幼苗质量,将是作物获得高产的重要保证。
甜瓜(CucumismelonL.)是具有高附加值的世界性水果,我国是世界重要的甜瓜种植国和消费国。据FAO数据库显示,2018年全球甜瓜收获面积和产量分别为104.73万hm2和2 734.92万t,分别占世界水果面积的1.54%和3.15%[11];同时根据《2019中国农村统计年鉴》等资料显示,2018年我国甜瓜收获面积和产量分别为35.45万hm2和1 272.73万t,分别占全球的33.85%和46.54%[12]。我国甜瓜产业发展迅速,面积、产量均位居全球第一,人们日益关注甜瓜产量和品质[13]。生物炭在甜瓜生产上也有一定的研究,De Souza Laurentino等[14]通过测定不同剂量生物炭下甜瓜幼苗的生物量(地上、根系)及根长,评价甜瓜幼苗质量,确定甜瓜幼苗发育的最佳剂量为12 t·hm-2;Elbashier等[15]在温室内进行了甜瓜盆栽试验,采用生物炭、沼渣和氮、磷、钾不同配施量,用自来水和NaCl溶液灌溉植株,结果显示,在盐渍灌溉条件下,生物炭与沼渣配施对甜瓜的生长、光合速率、水分利用效率和产量均有显著影响,特别是在盐灌水和不加N、P、K肥的条件下。单用沼气比使用生物炭更有效,可作为无机NPK肥料的替代肥料;张芙蓉等[16]研究了生物炭在盐渍化土壤中的改良作用以及对甜瓜生长的影响,结果表明:与施用有机肥(对照)相比,生物炭处理降低了土壤中可溶性盐分的含量以及土壤的呼吸作用,减少了温室气体CO2的排放,同时提高了植株的净光合速率,但对甜瓜生物量及果实品质没有显著改善效果。而生物炭施用对甜瓜幼苗及其根系生理特性的影响鲜有报道。本研究利用盆栽试验,设置不同生物炭添加剂量,针对生物炭对甜瓜根表面积、根系生理指标以及幼苗质量的影响进行研究,以期为甜瓜壮苗培育提供理论基础和实践依据,为甜瓜高产和优质生产提供技术支持。
1 材料与方法
1.1 材料
供试薄皮甜瓜品种为‘金妃’,供试土壤为蔬菜营养土,均购于大庆市长青种子公司。
供试蔬菜营养土基本理化性质为:有机质含量45.8 g·kg-1,pH 6.86,碱解氮含量96.8 mg·kg-1,速效磷含量31.7 mg·kg-1,速效钾含量189.3 mg·kg-1,含水量13%,电导率0.57 mS·cm-1,容重1.28 g·cm-3。
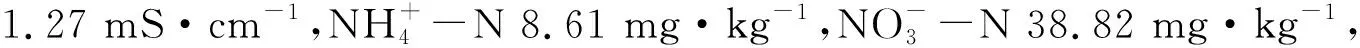
1.2 试验设计
2021年4—7月在黑龙江八一农垦大学教学试验基地的现代化温室和塑料大棚开展试验。
试验设5个处理,即生物炭含量分别占风干蔬菜营养土质量0 g·kg-1(CK)、 10 g·kg-1(T1)、20 g·kg-1(T2)、40 g·kg-1(T3)、80 g·kg-1(T4),每个处理4次重复。
将蔬菜育苗营养土和生物炭全部过2 mm筛,与化肥混匀后做育苗基质备用。化肥使用量计算如下:按照30 cm深土层的重量为3.84×106kg·hm-2计,甜瓜基本施肥量为225 kg·hm-2磷酸二胺、675 kg·hm-2硫酸钾、625 kg·hm-2尿素,相当于每kg营养土中需要施入0.059 g磷酸二胺、0.176 g硫酸钾、0.098 g尿素。
甜瓜苗期试验采用塑料育苗盒(长×宽×高=34.5 cm×24 cm×11 cm),每盒装育苗基质2.5 kg。每盒播种催芽后的甜瓜种子140粒,出苗后均匀保留70株,每个处理播种28盒。
1.3 试验实施
2021年4月20日,将甜瓜种子置于55~60℃温水下浸种15 min,降温后继续浸种12 h。然后将甜瓜种子置于28~30℃条件的恒温培养箱中催芽18 h,甜瓜种子全部发芽。
在育苗盒中装满育苗基质,热水打透底水。将催芽处理后的甜瓜种子均匀播种在育苗盒中。甜瓜出苗后15 d和25 d取样2次,每个处理选取160株(每个重复40株),用于幼苗期甜瓜根系生理指标的测定。出苗后25 d,每个处理选取80株(每个重复20株),用于测定甜瓜幼苗形态指标和物质积累量,计算根冠比和壮苗指数;同时,测定根体积、根系总吸收面积和活跃吸收面积,计算活跃吸收面积百分比和根系比表面积。出苗后25 d,每个处理选取20株(每个重复5株)收集甜瓜根系周围的根区土壤,过2 mm的网筛,将土壤带回实验室,在室温下自然风干,用于物理性质分析。
1.4 试验测定指标与方法
生理指标测定:
根系活力采用α-萘胺氧化法;硝态氮含量采用水杨酸-硫酸法;硝酸还原酶(NR)活性采用活体分光光度法;过氧化氢酶(CAT)活性采用紫外吸收法;过氧化物酶(POD)活性采用愈创木酚法;超氧化物歧化酶(SOD)活性采用氮蓝四唑光化还原法;抗坏血酸过氧化物酶(APX)活性采用抗坏血酸比色法;多酚氧化酶(PPO)活性采用邻苯二酚分光光度法。
根系总吸收面积和活跃吸收面积采用甲烯蓝比色法。计算公式为:
根系活跃吸收面积(%)=活跃吸收面积/总吸收面积×100
根系比表面积(m2·cm-3)=总吸收面积/根体积
形态指标测定:
株高:植株的茎基部到生长点之间的距离,用直尺测定;茎粗:植株子叶节下1 cm处粗度,用游标卡尺测定;根体积:采用排水法;叶面积:采用剪纸称重法。
物质积累量指标测定:
利用清水反复冲洗植株,再用吸水纸吸干,将其地上部与地下部分开后分别测其鲜质量;然后将鲜样在105℃杀青15 min后,于70℃烘至恒重,用北孝感亚光医用电子有限公司TB-4002型分析天平分别测定地上部与地下部干质量。
根冠比计算公式为:根冠比=地下部鲜质量/地上部鲜质量
壮苗指数计算公式为:壮苗指数=(茎粗/株高+地下部干质量/地上部干质量)× 全株干质量
土壤物理性状指标测定:
pH值用上海雷磁台式酸度计PHSJ-5型测定;土壤含水量在80℃烘箱中烘至恒重测定;土壤容重利用环刀法测定。
1.5 数据分析
采用Excel 2007软件进行数据处理,用DPS 7.05软件进行数据统计和方差分析,不同处理间数据的多重比较采用Duncan新复极差法检验(P<0.05);采用Excel 2007软件作图。
2 结果与分析
2.1 生物炭施用对甜瓜幼苗根系生理指标的影响
2.1.1 甜瓜幼苗根系活力 在甜瓜出苗后15 d和25 d,生物炭不同处理下根系活力如图1所示,CK根系活力最低,分别为69.980 μg·g-1·h-1和92.397 μg·g-1·h-1。在甜瓜出苗后15 d和25 d,T3根系活力最高(分别为77.367 μg·g-1·h-1和111.693 μg·g-1·h-1)且显著高于其他处理,分别比CK、T1、T2、T4处理高10.56%、8.35%、2.47%、1.46%和20.88%、17.13%、7.03%、5.71%;T4、T2之间差异不显著但二者均显著高于T1和CK,出苗后15 d分别高6.79%、8.96%和5.74%、7.89%,出苗后25 d分别高10.80%、14.35%和9.44%、12.95%;T1显著高于CK(2.03%和3.21%);CK根系活力最低,分别为69.980 μg·g-1·h-1和92.397 μg·g-1·h-1。说明适量生物炭处理对甜瓜根系活力具有促进作用。

注:图中正负误差线表示标准差大小。不同小写字母表示在同一时期各处理之间差异显著(P<0. 05)。下同。Note:Values in the chart are standard error. Different lowercase letters in the same period indicate that the difference reach a significant level (P<0.05)among different treatments. The same below.
2.1.2 甜瓜幼苗根系硝态氮含量和NR活性 不同处理下甜瓜幼苗根系硝态氮含量如图2A所示,与甜瓜出苗后15 d各处理幼苗根系硝态氮含量相比,在甜瓜出苗后25 d各处理的硝态氮含量均有所下降,CK、T1、T2、T3、T4下降幅度分别为68.19%、67.29%、67.74%、68.40%、68.10%。在甜瓜出苗后15 d,T3与T4、T4与T2之间差异均不显著,T3、T4、T2均显著高于T1和CK,分别高6.38%、4.31%、2.46%和6.39%、4.32%、2.47%;T1与CK之间差异不显著。在甜瓜出苗后25 d,T3与T4之间差异不显著,T3显著高于CK、T1、T2,分别高5.70%、2.77%、1.72%;T4、T2、T1之间差异不显著但三者均显著高于CK,分别高4.61%、3.92%、2.85%;CK根系硝态氮含量最低,为1 158.013 μg·mg-1。说明适量生物炭处理对甜瓜根系硝态氮含量提高具有促进效果。

图2 生物炭对甜瓜幼苗根系硝态氮含量和NR活性的影响Fig.2 Effect of biochar on nitrate nitrogen content and NR activity of melon seedlings root
不同处理下甜瓜幼苗根系NR活性如图2B所示,与甜瓜出苗后15 d各处理幼苗根系NR活性相比,在甜瓜出苗后25 d各处理的NR活性均有所下降,CK、T1、T2、T3、T4下降幅度分别为75.81%、73.01%、65.89%、61.36%、63.41%。在甜瓜出苗后15 d和25 d,T3根系NR活性均最高,分别为0.880 μg·g-1·h-1和0.340 μg·g-1·h-1;T3显著高于T4、T2、T1、CK,分别高16.25%、20.05%、31.93%、41.94%和22.74%、36.00%、88.89%、126.67%;T4、T2、T1、CK之间均存在显著差异,CK根系NR活性最低,分别为0.620 μg·g-1·h-1和0.150 μg·g-1·h-1。说明适量生物炭处理能提高甜瓜根系NR活性,提高氮代谢能力,有利于提高幼苗质量。
2.1.3 甜瓜幼苗根系抗氧化酶系活性 不同处理下甜瓜幼苗根系CAT活性如图3A所示,与甜瓜出苗后15 d各处理幼苗根系CAT活性相比,在甜瓜出苗后25 d的CAT活性均有所上升,CK、T1、T2、T3、T4上升幅度分别为38.24%、33.39%、34.02%、27.67%、26.73%。在甜瓜出苗后15 d,T3与T4之间差异不显著但二者均显著高于CK、T1、T2,分别高19.61%、14.67%、8.18%和17.37%、12.52%、6.15%;T2显著高于CK、T1,分别高10.57%、6.00%;T1显著高于CK(4.31%);CK根系CAT活性最低,为23.223 U·g-1。在甜瓜出苗后25 d,T3处理CAT活性最高,为35.463 U·g-1;T3显著高于CK、T1、T2、T4,增幅分别为10.47%、9.75%、3.05%、2.66%;T4、T2之间差异不显著但二者均显著高于T1、CK,分别高6.90%、7.60%和6.50%、7.20%;T1、CK之间差异不显著。说明适量生物炭处理能提高甜瓜根系CAT活性。
不同处理下甜瓜幼苗根系POD活性如图3B所示,与甜瓜出苗后15 d各处理幼苗根系POD活性相比,在甜瓜出苗后25 d的POD活性均有所上升,CK、T1、T2、T3、T4上升幅度分别为46.45%、33.53%、28.78%、20.98%、24.95%。在甜瓜出苗后15 d,T3处理POD活性最高,为34.927 μmol·g-1·min-1;T3

图3 生物炭对甜瓜幼苗根系抗氧化酶系活性的影响Fig.3 Effect of biochar on the activities of antioxidant enzymes in roots of melon seedlings
显著高于CK、T1、T2、T4,增幅分别为49.41%、18.21%、10.85%、5.68%;T4、T2、T1、CK之间均呈显著性差异,CK根系POD活性最低,为23.377 μmol·g-1·min-1。在甜瓜出苗后25 d,T3与T4、T4与T2之间差异均不显著;T3显著高于CK、T1、T2,分别高23.42%、7.10%、4.13%;T4显著高于CK、T1,(20.63%、4.67%);T2、T1、CK之间均呈现差异性表现,CK根系POD活性最低,为34.235 μmol·g-1·min-1。
不同处理下甜瓜幼苗根系SOD活性如图3C所示,与甜瓜出苗后15 d各处理幼苗根系SOD活性相比,在甜瓜出苗后25 d的SOD活性均有所上升,CK、T1、T2、T3、T4上升幅度分别为33.63%、19.85%、26.97%、21.17%、18.65%。在甜瓜出苗后15 d,T3处理SOD活性最高,为213.463 μmol·g-1·min-1;T3显著高于CK、T1、T2、T4,高45.12%、16.36%、13.94%、4.46%;T4显著高于CK、T1、T2,分别高38.92%、11.39%、9.07%;T1、T2之间差异不显著但二者均显著高于CK,分别高24.71%、27.36%;CK的SOD活性最低,为147.098 μmol·g-1·min-1。在甜瓜出苗后25 d,T3处理SOD活性最高,为258.653 μmol·g-1·min-1;T3显著高于CK、T1、T2、T4,分别高31.58%、17.64%、8.74%、6.68%;T4、T2、T1、CK处理之间差异显著,CK根系SOD活性最低,为196.569 μmol·g-1·min-1。
不同处理下甜瓜幼苗根系APX活性如图3D所示,与甜瓜出苗后15 d各处理幼苗根系APX活性相比,在甜瓜出苗后25 d的APX活性均有所上升,CK、T1、T2、T3、T4上升幅度分别为13.20%、14.35%、20.89%、33.98%、12.65%。在甜瓜出苗后15 d,APX活性以T3最高,为17.919 U·g-1;T3显著高于CK、T1、T2、T4,分别高30.29%、18.39%、4.99%、9.99%;T2显著高于CK、T1、T4,分别高24.10%、12.76%、4.77%;T4显著高于CK、T1,分别高18.45%、7.63%;T1显著高于CK(10.06%);APX活性以CK最低,为13.753 U·g-1。在甜瓜出苗后25 d,APX活性以T3最高,为24.007 U·g-1;T3显著高于CK、T1、T2、T4,分别高54.21%、38.70%、16.35%、30.81%;T2显著高于CK、T1、T4,分别高32.53%、19.21%、12.43%;T4显著高于CK、T1,分别高17.88%和6.03%;T1显著高于CK(11.18%);APX活性以CK最低,为15.568 U·g-1。
不同处理下甜瓜幼苗根系PPO活性如图3E所示,与甜瓜出苗后15 d各处理幼苗根系PPO活性相比,在甜瓜出苗后25 d的PPO活性均有所上升,CK、T1、T2、T3、T4上升幅度分别为49.67%、62.46%、70.78%、41.02%、87.61%。在甜瓜出苗后15 d,T3处理PPO活性最高,为0.529 U·g-1;T3显著高于CK、T1、T2、T4,分别高72.88%、55.13%、41.82%、59.82%;T2显著高于CK、T1、T4,分别高21.90%、0.09%、0.13%;T1、T4之间差异不显著但二者均显著高于CK,分别高11.44%、8.17%;CK的PPO活性最低,为0.306 U·g-1。在甜瓜出苗后25 d,T3处理PPO活性最高,为0.746 U·g-1;T3显著高于CK、T1、T2、T4,分别高62.88%、34.66%、17.11%、20.13%;T2与T4之间差异不显著但二者均显著高于CK、T1,分别高39.08%、14.98%和35.59%、12.09%;T1显著高于CK(20.96%);CK的PPO活性最低,为0.458 U·g-1。
2.2 生物炭施用对甜瓜幼苗根表面积的影响
在甜瓜出苗后25 d,测定了生物炭不同处理下甜瓜幼苗根体积、根系总吸收面积和活跃吸收面积,计算了活跃吸收面积百分比和根比表面,结果如表1所示。表1表明,生物炭不同处理下甜瓜幼苗根体积、根系总吸收面积和活跃吸收面积均显著高于CK,T3处理的根体积、根系总吸收面积和活跃吸收面积均最高,分别为0.293 cm3、0.865 m2、0.622 m2;T3显著高于CK、T1、T2、T4,根体积分别高21.07%、11.41%、6.16%、3.90%,根系总吸收面积分别高40.19%、25.91%、17.85%、13.37%,活跃吸收面积分别高71.82%、43.65%、25.66%、18.70%;T4、T2、T1、CK之间均呈现差异性表现,CK根体积、根系总吸收面积和活跃吸收面积均最低,分别为0.242 cm3、0.617 m2、0.362 m2。T3活跃吸收面积百分比和根比表面均最高,分别为71.908%和2.952 m2·cm-3;T3显著高于T4、T2、T1、CK,活跃吸收面积百分比分别高22.56%、14.09%、6.63%、4.71%,根比表面分别高15.76%、13.02%、11.02%、9.09%;T2、T4活跃吸收面积百分比之间差异不显著但二者均显著高于CK、T1,分别高14.94%、8.96%和17.05%、8.96%;T2、T4根比表面之间差异不显著但二者均显著高于CK、T1,分别高4.27%、1.80%和6.12%、3.60%;T1活跃吸收面积百分比和根比表面均显著高于CK,分别高7.43%、2.43%;CK活跃吸收面积百分比和根比表面均最低,分别为58.671%和2.550 m2·cm-3。说明在苗期,施用适当生物炭可以提高根体积、根系总吸收面积和活跃吸收面积,甜瓜幼苗可以获得更多的养分和水分,增强幼苗根冠比,提高幼苗质量。

表1 生物炭施用对甜瓜幼苗根表面积的影响
2.3 生物炭施用对甜瓜幼苗形态建成的影响
在甜瓜出苗后25 d,测定了不同处理下甜瓜幼苗株高、茎粗、叶面积、地上部鲜质量和干质量、地下部鲜质量和干质量,计算出全株鲜质量、全株干质量、根冠比和壮苗指数,结果如表2所示。表2表明,不同处理下甜瓜幼苗株高、茎粗、叶面积、全株鲜质量、全株干质量、根冠比和壮苗指数均呈现一定差异。上述形态建成指标中均以T3处理最高,与CK、T1、T2、T4相比,其株高分别高35.14%、27.14%、21.09%、15.35%,茎粗分别高31.71%、23.93%、17.76%、8.31%,叶面积分别高33.91%、29.36%、12.58%、24.27%,全株鲜质量分别高31.92%、28.23%、19.85%、18.12%,全株干质量分别高45.10%、37.04%、27.59%、17.46%,壮苗指数分别高43.33%、19.44%、13.16%、10.26%;T3与T4根冠比之间差异不显著但二者均显著高于CK、T1、T2,分别高64.94%、56.79%、47.67%和57.14%、49.38%、40.70%;CK株高、茎粗、叶面积、全株鲜质量、全株干质量、根冠比和壮苗指数均最低。说明在苗期施用适当生物炭对甜瓜幼苗形态建成和物质积累具有促进作用,可增大幼苗根冠比,提高壮苗指数,改善甜瓜幼苗质量。

表2 生物炭施用对甜瓜幼苗形态建成的影响
2.4 生物炭施用对土壤物理性状的影响
在甜瓜出苗后25 d,测定了不同处理下土壤的pH值、含水量和容重,结果如表3所示:T4土壤的pH值最高,为7.11,显著高于CK、T1、T2、T3,分别高1.86%、1.72%、1.28%、0.85%;T3显著高于CK、T1,增幅分别为1.00%和0.86%;T2与T1、CK之间无显著性差异;CK的pH值最低,为6.98。T3、T4土壤的含水量之间差异不显著但二者均显著高于CK、T1、T2,分别高3.51%、2.63%、1.62%和3.16%、2.29%、1.28%;T2含水量显著高于CK、T1,分别高1.85%和0.99%;T1、CK之间无显著性差异;CK含水量最低,为19.95%。T4土壤的容重最低,为1.18 g·cm-3,其显著低于CK、T1、T2、T3,分别低5.93%、5.08%、5.08%、4.24%;CK、T1、T2、T3的土壤容重之间差异不显著。说明在苗期施用生物炭造成土壤pH值和含水量升高,具有降低土壤容重的趋势,对改善土壤物理性质具有积极作用。
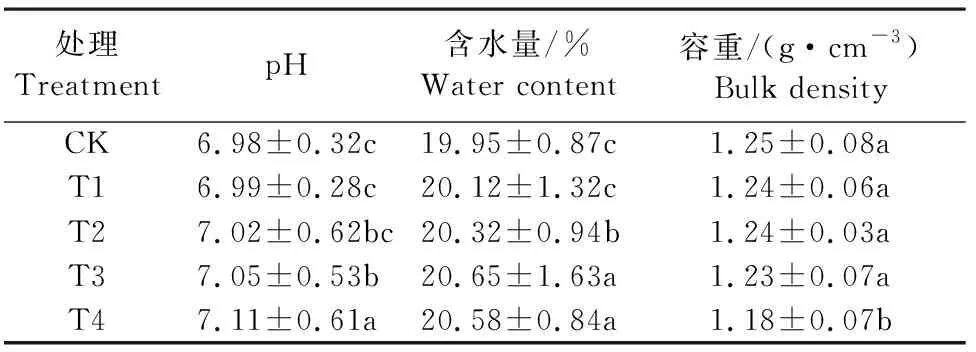
表3 生物炭施用对土壤物理性状的影响
3 讨 论
作物高产稳产的物质基础是获得较高的生物产量,而生物产量高低则在很大程度上取决于根系发育状况[17]。高产作物的根系必须既有一定的数量(根质量),又有较高的质量(生理活性)[18],这样才能高产稳产。研究表明,根系形态和生理特征是根系质量优劣的体现,与作物地上部的生长发育关系非常密切[19],适宜的根系发育状态对植物生长和产量形成具有十分重要的作用[20-21]。
植株根系活力为植株根系生理活性强弱的直接表征,根系活力能够影响植株干物质的累积及植株的光合速率,从而影响植株的生长发育进而影响植株产量[22-23]。根系的活跃吸收面积能够反映出根系活力的强弱,徐春梅等[24]在水培条件下研究通气增氧对水稻苗期根系生长和氮代谢的影响,结果表明,秀水09水稻品种在增氧处理后根系干物质积累量、根长、根体积、根系活力以及吸收面积较对照增加44.64%、119.94%、43.88%、4.15%和14.14%,国稻6号增氧后根系硝态氮含量和可溶性糖含量分别是对照的2.58倍和增加9.43%;肖元松等[25]研究增氧栽培对桃幼树根系构型及根系氮素代谢的影响,结果发现增氧栽培桃幼树根系总长度、总表面积、一级侧根数、二级侧根数、根尖数、总体积、分枝数、交叉数较对照均有不同程度增加,分别比对照增加了50.53%、42.66%、13.64%、18.51%、44.94%、5.48%、37.01%和54.41%;增氧栽培的根系活力、根系硝酸还原酶(NR)、谷草转氨酶(GOT)和谷丙转氨酶(GPT)活性分别比对照提高了19.04%、29.80%、6.56%和19.91%;根系全氮含量较对照提高了18.90%;增氧栽培的桃幼树植株干物质积累量、干茎均高于对照;Voesenek等[26]研究发现当根际氧含量过低时,植株根长变短,根系数目增多,适当增加不同根系径级的根系数目、根长、根系总表面积及根系的活跃吸收面积,有利于植株吸收养分。本研究结果表明,在苗期,施用适当生物炭可以提高甜瓜根系根体积、根系总吸收面积和活跃吸收面积,提高其活跃吸收面积百分比和根比表面积,甜瓜幼苗可以获得更多的养分和水分,促进幼苗质量提高,以T3即生物炭含量占风干土质量40 g·kg-1应用效果最好。这可能是由于生物炭疏松多孔,可以降低基质容重,增加孔隙率,增加基质的通透性[27],因此生物炭可以改善根系的外在环境,对根系周围养分的供应产生增益效果,促进根系生长并增强根系活力。
壮苗指数则是幼苗质量的综合数量化指标,是评价幼苗质量优劣的主要参考[28],幼苗质量的强弱也需辅以若干形态指标、物质积累指标和生理指标的变化才能准确判断。王颖[29]研究发现,叶面积的增加对生长发育、光能利用、干物质积累、产量均有着积极的显著影响。叶面积的增加加强了植株的光合作用能力,使植株同化产物增加、根系同化产物的分配比例增加,根系吸收能力增强从而影响甜瓜的果实重量及品质。作物的干物质积累量是反映作物生殖生长的一项重要指标,可直接反映作物体内代谢能力的强弱;张文哲等[30]研究了不同灌水量和不同生物炭施用量对温室番茄株高、茎粗的影响,结果表明,不同生物炭施用量对番茄株高的影响大致相同,灌水量分别为0.8ET(Evapo-Transpiration,蒸发蒸腾量)、1.0ET、1.2ET时,番茄的株高长势随着生物炭施用量的增加而增加;0.8ET、1.0ET、1.2ET灌水量下,5%的生物炭施加量对番茄茎粗的增幅促进作用最大。说明生物炭作为添加剂可以改善温室番茄株高茎粗的生理特性,提高番茄植株质量;吕伟静等[31]研究结果显示,在土壤中添加生物炭和改性生物炭均可显著提高甜茶幼苗生物量,改性生物炭的效果更加明显。添加改性生物炭分别使土壤硝态氮、铵态氮、速效磷、速效钾、有机质的含量增加了91.9%、78.5%、114.0%、32.5%、159.4%;添加改性生物炭处理的甜茶幼苗株高、地径、鲜质量和干质量与对照组相比分别增加了53.1%、20.4%、78.9%和79.2%。本研究结果表明,施用适当生物炭可以提高甜瓜株高、茎粗、叶面积,提高植株鲜质量和干质量,使根冠比和壮苗指数维持在比较适合的范围,保证了甜瓜幼苗质量,以T3应用效果最好。这可能与生物炭施用后土壤结构的改善有密切关系,本研究发现,添加生物炭可以提高土壤的pH值,降低土壤容重,增加土壤含水量,以T4即生物炭含量占风干土质量80 g·kg-1对土壤物理性状改善效果最好,T3应用效果较好,这可能是因为生物炭是一种具有强吸附性能、高灰分含量、偏碱性的粉末状固态颗粒物质,施于土壤后,提高了土壤酸碱性、增加了孔隙度、减少了容重有关[32],这与Gul等[33]发现生物炭可以改变土壤理化性质、促进养分循环、增加碳固存的研究结果一致。同时,生物炭的孔隙构造发达、比表面积大,并且拥有强大的吸收能力[34],有助于在土壤中保持更多的水分和养分[35],从而改善植物的生长。
植物根系的形态变化也能够影响植物对营养元素的吸收[36]。赵浩波等[37]研究发现,氮含量会响应根系形态,若含氮量过低会抑制根系生长;谭龙涛[38]研究也表明,氮的利用率与根系体积、总吸收面积、活跃吸收面积有关。本研究结果表明,施用适当生物炭可以提高甜瓜幼苗硝态氮含量和硝酸还原酶(NR)活性,促进物质积累和幼苗形态建成,改善了幼苗生理活性,T3应用效果最好。NR 作为植物硝态氮还原的关键酶,在以硝态氮为氮源的植株中,NR 活性可以作为其利用氮素能力的重要指标[39]。硝态氮含量是作物氮素同化和利用的主要指标,NR的活性高低直接影响植物体对氮素营养的利用效果,对作物品质和产量也会产生一定的影响[40]。
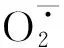
4 结 论
综上所述,生物炭改善了土壤物理性状,以T4即生物炭含量占风干土质量80 g·kg-1应用效果最好;同时提高甜瓜根系生理特性,增强根表面积,促进了甜瓜幼苗形态建成,提高了幼苗质量,以T3即生物炭含量占风干土质量40 g·kg-1应用效果最好。在甜瓜出苗后25 d,生物炭提高了土壤pH值和含水量,T4分别比CK提高1.86%和3.16%;降低土壤容重,比CK即生物炭含量占风干土质量0 g·kg-1降低5.93%。在甜瓜出苗后25 d,T3甜瓜幼苗根系活力、根系硝态氮含量、NR、CAT、POD、SOD、APX、PPO分别比CK高20.88%、5.70%、126.67%、10.47%、23.42%、31.58%、54.21%、62.88%;根体积、根系总吸收面积、活跃吸收面积、活跃吸收面积百分比和根比表面分别比CK高21.07%、40.19%、71.82%、22.56%和15.76%;甜瓜幼苗株高、茎粗、叶面积、全株鲜质量、全株干质量、根冠比和壮苗指数分别比CK高34.87%、31.71%、33.91%、31.92%、45.10%、64.94%、43.33%。

