胃外肝样腺癌的影像学诊断
黄爱娜,陆健,曾蒙苏, 周国锋,张学琴,张涛,顾红梅,冯峰
肝样腺癌(hepatoid adenocarcinomas,HAC)为形态学上类似肝细胞癌的肝外肿瘤,预后较差。由Ishikura等[1]首次报道,病灶位于胃中。HAC是一种特殊类型的腺癌,临床上非常少见,原发于肝外,而形态学及免疫组织化学特征却与肝细胞癌相似。HAC可发生于全身不同组织器官,最常见发病部位是胃(63%)[2],近年来对发生于胃的HAC了解与认知较深[3-5],但因胃外HAC更为罕见,多为个案报道,导致对患者的临床及影像学特征认识不足。本研究回顾性分析9例胃外HAC患者的临床及影像学表现,旨在提高对胃外HAC的认识,减少误诊。
材料与方法
1.病例资料
搜集2014年12月至2021年3月在复旦大学附属中山医院、南通大学附属南通第三医院、南通大学附属医院、南通大学附属肿瘤医院经病理证实的9例胃外肝样腺癌患者,回顾性分析其临床及影像资料。9例患者中男6例,女3例,发病年龄32~69岁,平均年龄(56.2±14.1)岁。
2.检查方法
9例患者中6例行CT平扫及增强检查,2例行MRI平扫及增强检查,1例同时行CT及MRI检查。
3.图像分析
由2位有10年以上工作经验的放射科医师对临床及影像资料进行分析,若意见不一致时共同商量以达成一致。分析内容包括患者的性别、年龄、肝炎病史、治疗前血清甲胎蛋白(alpha fetoprotein,AFP)、免疫组化AFP、病灶部位、大小、形态、强化程度及方式、淋巴结转移、邻近器官侵犯、远处转移等情况,总结其临床及影像学特征。
结 果
1.临床资料
9例胃外肝样腺癌发病部位分别为肺3 例(右肺2例、左肺1例)、胆囊2例(底部1例、体部1例)、胰腺1例、小肠1例、结肠1例、腹腔1例(表1)。9例患者均无肝炎病史。7例治疗前血清AFP不同程度升高,免疫组化AFP 7例阳性表达。
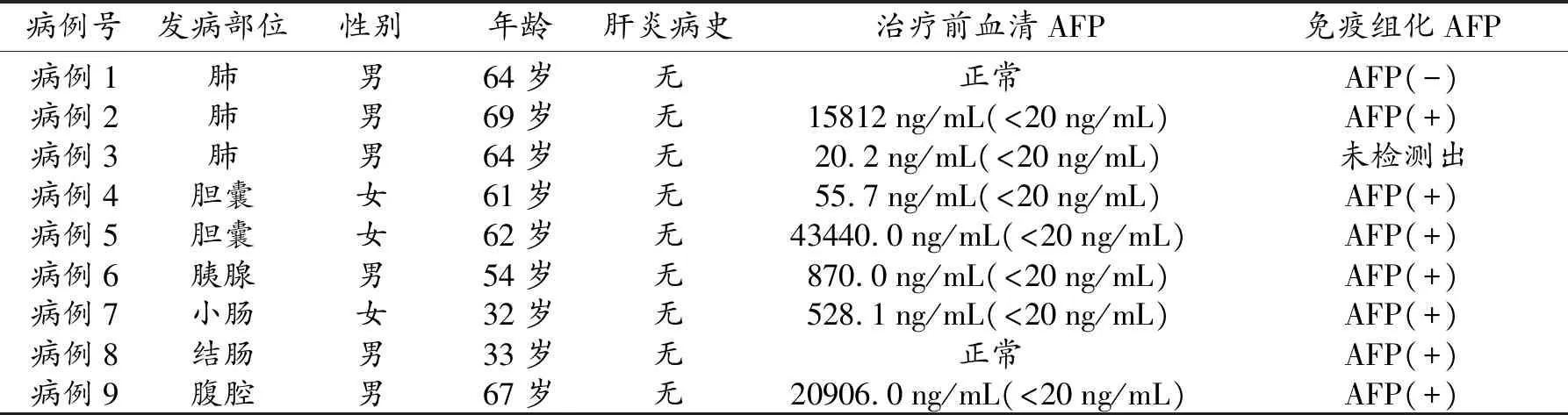
表1 9例胃外HAC患者的临床资料
2.影像学表现
肺肝样腺癌:3例肺HAC发病部位为右肺2例(1例下叶,1例上叶)、左肺1例(下叶),大小范围为5.6 cm×3.2 cm~6.0 cm×4.8 cm,形态为类圆形或不规则形,病灶紧邻胸膜,边缘不光整,1例内见点状钙化,周围肺组织见炎症及不张。3例增强扫描均呈不均匀强化(图1),内见坏死,2例动脉期呈中度强化,其中1例静脉期强化轻度减弱(平扫44.1 HU,动脉期95.2 HU,静脉期74.0 HU),1例为延迟强化(平扫39.6 HU,动脉期60.2 HU,静脉期62.4 HU);另1例未行多期增强检查者表现为中度强化(平扫37 HU,增强后60 HU)。3例均有纵隔淋巴结转移,2例肺门淋巴结转移。3例均无远处转移。
胆囊肝样腺癌:1例胆囊HAC表现为胆囊体部不规则肿块(图2),大小为3.0 cm×2.5 cm,T1WI呈混杂信号,局部见少许高信号,T2WI呈等信号,DWI呈稍高信号,增强扫描呈不均匀中度延迟强化,局部与邻近肝实质境界不清。另1例胆囊HAC表现为胆囊底部不规则肿块(图3),大小为2.0 cm×1.5 cm,呈不均匀中度延迟强化,局部与邻近肝实质境界不清,周围肝组织见范围约15.0 cm×7.0 cm的分叶状肿块,T1WI以低信号为主,内见少许高信号,T2WI呈混杂信号,部分呈高信号,部分呈等信号,增强后不均匀强化,强化方式类似HCC。2例胆囊HAC均无淋巴结及远处转移。
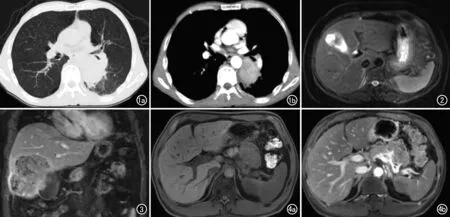
图1 左肺下叶HAC患者。a)CT肺窗横轴面示左肺下叶肿块,边缘不光整;b)CT增强扫描动脉期纵隔窗横轴面示病灶呈不均匀中等强化,紧邻胸膜。 图2 胆囊HAC患者,T2WI横轴面示胆囊腔内不规则等信号。 图3 胆囊HAC患者,T1WI增强扫描冠状面示胆囊底部不规则肿块,呈不均匀强化,与肝实质境界不清,邻近肝实质见不规则肿块。 图4 胰腺HAC患者。a)T1WI平扫横轴面示胰尾类圆形等低信号肿块;b)T1WI增强扫描横轴面示病灶呈不均匀强化,与胰腺境界不清,侵犯脾动脉。
胰腺肝样腺癌:1例胰腺HAC同时行CT平扫+增强及MRI平扫+增强检查(图4)。CT平扫表现为软组织密度类圆形肿块,大小为5.0 cm×4.5 cm,CT值为41.4 HU,动脉期CT值为73.3 HU,门脉期CT值为77.6 HU,延迟期为78.6 HU,脾动脉受侵犯。病灶T1WI呈等低信号,T2WI呈以等信号为主的混杂信号,DWI呈高信号,增强后不均匀延迟强化,并见分隔及包膜延迟强化,病灶局部与胰腺境界不清,脾动脉受侵犯。
小肠肝样腺癌:1例小肠HAC发生于回肠末端(图5),表现为肠壁不均匀增厚,增强后不均匀中度强化,平扫CT值40.0 HU,增强后84.9 HU,浆膜面不光整,邻近腹腔内肠旁见肿大淋巴结,肝脏有多发转移瘤,表现为类圆形低密度灶,增强后环形强化,较大一枚长径约2.4 cm。
结肠肝样腺癌:1例结肠HAC发生于乙状结肠,表现为乙状结肠外生性肿块(图6),表面有溃疡形成,平扫表现为软组织密度,CT值约44.1 HU,内点状钙化,呈不均匀延迟强化,动脉期CT值约72.8 HU,平衡期约73.6 HU,与邻近脂肪组织境界不清。肝脏可见多发类圆形低密度灶,较大一枚长径约7.3 cm,T1WI呈低信号,T2WI呈以等信号为主的混杂信号,增强扫描动脉期呈环形强化,并进一步不均匀延迟强化。
腹腔肝样腺癌:1例腹腔HAC表现为脾胃间隙见大小为7.3 cm×5.5 cm的类圆形分叶状肿块(图7),平扫表现为软组织密度,增强后呈不均匀中度延迟强化,病灶边缘不光整,周围见索条影,腹腔内及肠系膜见多发较小软组织密度影(表2)。
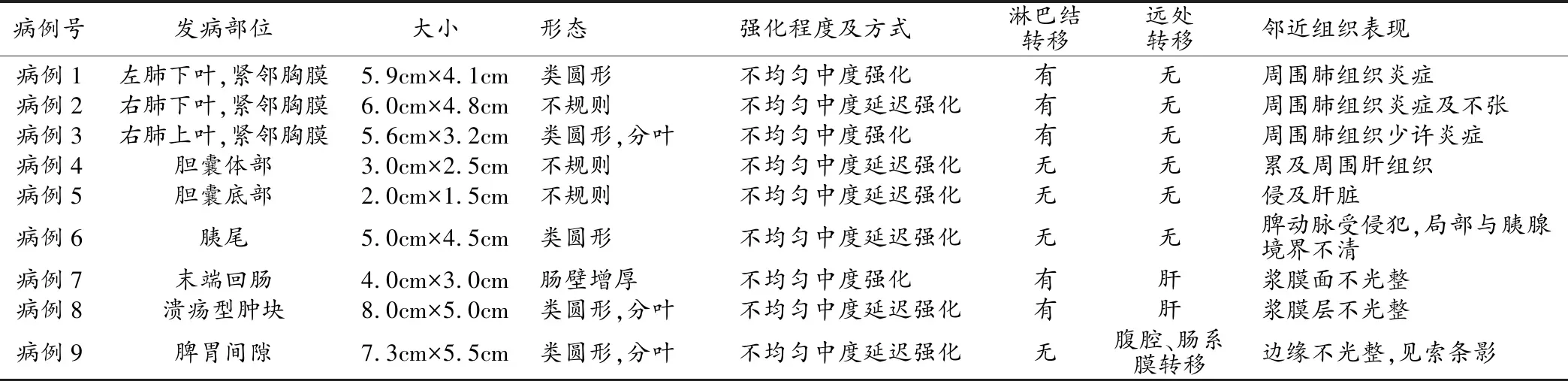
表2 9例胃外HAC的影像学表现
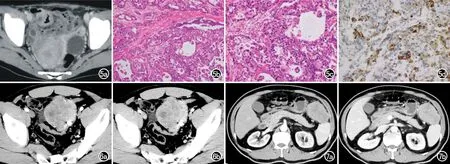
图5 小肠HAC患者。a)CT增强扫描横轴面示回肠末端管壁不均匀增厚,呈不均匀强化;b)镜下示肝细胞样分化区域,血窦丰富,肿瘤组织呈腺样、条索状排列(×100,HE);c)镜下示肿瘤细胞胞质丰富,胞浆嗜酸性或透亮,核大深染,核分裂多见(×200,HE);d)肿瘤细胞AFP阳性表达(×200,AFP免疫组化染色)。图6 结肠HAC患者。a)CT增强扫描动脉期横轴面示乙状结肠旁类圆形肿块,内见钙化,呈不均匀中度强化;b)CT增强扫描门脉期横轴面示病灶呈不均匀延迟强化,内部坏死显示更清晰。 图7 腹腔HAC患者。a)CT增强扫描动脉期横轴面示脾胃间隙类圆形肿块,呈不均匀中度强化;b)CT增强扫描门脉期横轴面示病灶呈不均匀延迟强化,内见不规则坏死。
讨 论
肝样腺癌最常见的发病部位是胃(63%),其次为卵巢(10%)、肺(5%)、胆囊(4%)、胰腺(4%)和子宫(4%)[2],也有报道发生于直肠[6]。Ishikura等1990年首次提出以下诊断标准:①典型的腺泡或乳头状腺癌的存在;②与肝细胞癌相似并产生AFP的癌成分的存在。Haninger等[7]研究了5例肺HAC,发现2例病理上呈纯肝样形态的AFP阴性病例。2013年Haninger等对Ishikura标准做出修订:①肿瘤可以是纯肝样腺癌或伴有典型腺泡或乳头状腺癌、印戒细胞或神经内分泌癌等成分;②AFP及其他肝细胞分化标记物的表达对于诊断肝样腺癌不是必须的;③具有肝细胞癌形态特征但不产生AFP的腺癌称为AFP阴性的肝样腺癌。本研究共纳入9例发生在胃外的肝样腺癌,其中肺3例、胆囊2例以及胰腺、小肠、结肠、腹腔各1例。
肝样腺癌病因不明确,临床症状无特异性,被发现时往往已有转移,最常见的转移部位是淋巴结(57.5%),其次是肝(46.3%)和肺(3.4%)。临床可以同时发现原发灶和转移灶,也可以是以转移灶首诊[8]。本组病例临床表现因发病部位不同而有所不同,患者表现为消瘦、便血伴脐周痛、上腹部不适或腹痛、咳嗽咳痰等。本组1例因体检AFP升高就诊,1例因影像检查偶然发现。
病理组织学是诊断肝样腺癌的“金标准”,主要依据是形态学上存在肝样分化区。HAC可同时存在肝样分化区和普通腺癌区,少数为纯肝样分化区。肝样分化区与典型肝细胞癌类似,肿瘤细胞大、多角形,呈髓样或梁索样,间质富含毛细血管和血窦;普通腺癌区呈不同分化程度的管状腺癌或乳头状腺癌[8]。HAC与肝细胞癌的免疫组化染色也有相似之处,如均可AFP高表达,也可表达其它肝细胞癌特异性标志物,如Heptocyte是相对特异性的肝细胞标志物,在肝样腺癌中较肝细胞癌表达稍低(38.1%)[9]。HAC与组织病理学上AFP阳性表达和/或血清AFP升高有关,但并非所有HAC均产生AFP[10]。本组7例治疗前血清AFP升高,最高AFP为43440.0 ng/mL,其中6例免疫组化AFP阳性表达,1例免疫组化未检测出,可能与该例为穿刺取得病理有关。另外2例治疗前血清AFP为阴性,其中1例AFP免疫组化表达为阴性,另1例未检测出,因而推测治疗前血清AFP水平可能与免疫组化癌细胞表达AFP相关,如免疫组化AFP阳性表达,一般血清AFP水平会增高。
近年来有关胃肝样腺癌的报道逐渐增多,但发生在胃外的肝样腺癌以个案报道居多,影像相关报道更少。本组9例胃外HAC尽管发生部位不同,但影像表现有一定的共同性。HAC通常体积较大,增强后呈不均匀强化,多有坏死,大部分动脉期呈中度强化,并可见延迟强化,这与胃HAC的强化表现相似[3-5],其它影像表现可因发病部位不同而有一定的差异性。国内外文献总结肺HAC的影像学特点如下:肿瘤发生部位以肺上叶占多数,与肋胸膜或纵隔胸膜相邻,前者常附着于胸壁,而旁纵隔HAC易侵犯同侧纵隔结构(包括气管和食管)[10-12];Sun等[10]发现肿块大小从1.0 cm到20.0 cm不等,与原发灶的位置有关,肿块多不均质,内可见坏死区,这与Wu等[13]的报道一致,CT增强后表现为轻度至中度不均匀强化,坏死区域显示更清晰。本组报道3例肺HAC,1例发生于上叶,2例发生于下叶,3例HAC均呈不均匀强化,其中2例为动脉期不均匀中等强化。3例均有纵隔淋巴结转移,2例肺门淋巴结转移,3例均无远处转移。影像学评估对肺HAC的治疗方案选择有一定作用,它能够检测淋巴结或远处转移,并有助于评估临床分期。与产AFP的肺肿瘤的鉴别诊断包括肺内胚窦瘤和乳头状腺癌,但HAC是产AFP的肺癌的主要组织学类型,其他类型发生率较低,另外要与肺转移性肝细胞癌鉴别,由于肝细胞癌的最常见肝外转移部位为肺组织,但影像学检查发现肝脏无占位则可排除肝癌转移[14]。
发生于胆囊、胰腺、小肠、结肠及腹腔的HAC在文献中多为个案报道,临床上对发生于这些部位的HAC的诊断经验有待进一步积累。胆囊HAC可表现为胆囊腔内带蒂肿块[15],或胆囊内实性肿块侵犯肝脏[16],Devi等[17]报道1例发生于43岁男性的胆囊HAC,表现为胆囊区不规则肿块,界限不清,与邻近肝实质境界不清,并有肝转移灶。本组2例胆囊HAC均表现为胆囊体部或底部不规则肿块,其中1例侵犯周围肝组织呈分叶状肿块。本组1例胰尾HAC肿块表现为不均匀延迟强化,侵犯胰腺及脾动脉,与Dogeas等[18]等报道的1例胰头HAC表现类似。肠道HAC是一种非常罕见的肠道恶性肿瘤,Zeng等[19]总结报道肠道HAC的特点如下:大多数患者血清AFP升高,以男性多见,结肠好发,可伴有炎症性肠病;血管侵犯、淋巴结转移和远处转移常见。本组报道的1例小肠及结肠HAC均有肠旁淋巴结及远处肝转移。腹膜及腹腔HAC可表现为孤立性肿块或播散性结节,本组报道1例脾胃间隙HAC,与Lucas等[20]报道1例发生于64岁女性的HAC的肿块部位相同,表现为脾胃间隙间不规则肿块,与脾脏境界不清。目前国内外对HAC影像学特征的认识正在不断发展,并可能在未来提示与预后的关系。目前尚无治疗HAC的标准指南,通常早期进行手术切除,晚期进行姑息性铂类化疗和放疗,近年来靶向治疗和免疫治疗也逐渐应用于HAC。
综上所述,肝样腺癌为罕见的肝外肿瘤,中老年男性好发,除胃为最常见发生部位外,还可发生于胃外器官,如肺、胆囊、胰腺、子宫、卵巢、腹腔等不同部位,肺肝样腺癌的影像学特点为好发于肺内紧邻胸膜的孤立性病灶,呈不均匀强化的肿块,动脉期中度强化并延迟强化。其它胃外部位的肝样腺癌多表现为不均匀强化的孤立性肿块;肿瘤恶性程度高,预后差,有极高的淋巴结转移及肝转移发生率,临床上结合血清AFP升高对诊断有较高价值,最终确诊仍依靠病理组织学检查。

