CT影像组学联合传统影像特征对胃肠道间质瘤Ki-67指数表达的预测价值
杨采薇,刘曦娇,魏毅,张鑫,尹晓南,尹源,宋彬
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是最常见的间叶源性肿瘤,其起源于消化道间质的卡哈尔(Cajal)细胞或起源于具有多分化潜能的卡哈尔细胞的前体细胞(间质干细胞)[1]。GIST可发生于消化道任何部位,发病率约百万分之十到百万分之二十[1]。GIST免疫组化检测通常表达CD117和DOG1阳性[2]。GIST的形成主要是由于编码酪氨酸激酶受体KIT和血小板衍生生长因子受体α(PDGFRA)的基因发生突变,导致相应的酪氨酸激酶受体成为原癌基因的驱动因素[2]。GIST可能发生远处转移,最常见的转移部位是肝和腹膜。评估GIST的生物学行为有助于患者的辅助治疗及对治疗方案做出个体化决策[3]。细胞增殖指数,也被称为Ki-67增殖指数(Ki-67 proliferation index,Ki-67 PI),是指每个细胞群中Ki-67阳性染色细胞的百分比,Ki-67 PI是评估肿瘤异质性和细胞增长的一个重要的免疫组化标志物[4]。
之前的研究表明,CT影像学参数能有效进行Ki-67 PI与GIST风险分层的相关性评估[5],并且CT影像学特征对GIST术后复发风险的预测也具有很高价值[6]。然而,由于肉眼难以正确判断CT图像的所有信息,这些定性的影像征象分析可能会受到不同观察者的影响。影像组学可以将数字图像转化为提取分析的高通量客观数据,来评估肿瘤的病理生理学特征,这在一定程度上解决了肿瘤异质性难以评估和量化的问题[7]。之前研究也表明,影像组学可以应用于评估GIST的生物学行为,包括恶性潜能、有丝分裂计数、预后和基因突变状态等[8,9]。因此,本研究目的为基于GIST的影像组学特征联合增强CT征象对术前Ki-67 PI高表达进行无创性预测,挖掘具有诊断价值的影像组学特征和传统CT征象,以期对临床精准治疗和预后评估提供术前指导。
材料与方法
1.研究对象
回顾性搜集我院2010年9月-2020年9月经手术病理确诊的原发性GIST患者的病例资料。病例纳入标准:有完整术前4周内的腹部增强CT图像且图像满足影像分析与组学分析的要求;无其他肿瘤病史及肿瘤治疗史;病例排除标准:手术标本未进行Ki-67的免疫病理学染色。
2.检查方法
患者于CT检查前一天清淡饮食,检查当天禁食8 h,扫描前40 min~1 h口服温开水600~1000 mL。采用飞利浦Brilliance 64、西门子Somatom Definition AS+ Somatom Definition Flash行CT检查。扫描参数:管电压120 kV,管电流145~200 mA,层厚 2~5 mm,层间距5 mm,视野30~50 cm,矩阵512×512,螺距1.0。患者取仰卧位并双臂伸直置于头侧,扫描范围为膈顶至耻骨联合上缘。先行常规CT平扫,之后行增强扫描。增强扫描采用高压注射器经肘静脉团注对比剂碘普罗胺(拜耳先灵,1.0 mL/kg,3.0~4.5 mL/s),分别于注射对比剂后50 s、80 s采集动脉晚期和实质期图像。
3.传统影像学征象评估
所有图像均传输至图像存储与传输系统(PACS),由两位腹部影像诊断医师(分别有6年和10年工作经验)在Syngo Imaging Workplaces工作站(Version VB35A,Siemens AG,Erlangen,Germany)采用盲法独立分析图像。分析并记录相关的影像特征,包括肿瘤大小(肿瘤横轴面的最大长径)、边界、形状、生长方式(包括外生型、腔内型和混合型)、有无坏死、有无钙化、有无溃疡、有无肿瘤内含气、有无囊变、强化方式(均匀或不均匀)、强化程度、有无增粗的供血或引流静脉、有无直接侵犯邻近脏器、有无增大淋巴结、有无系膜脂肪浸润及有无远处转移。强化程度在实质期图像评估,轻度强化定义为CT值增加小于20 HU,中度强化定义为CT值增加20~40 HU,重度强化定义为CT值增加大于40 HU。当结果不一致时两位医生讨论达成一致意见。
4.影像组学分析
图像分割:在医院PACS 系统中将所有纳入患者的实质期CT图像以DICOM格式导出并导入ITK-Snap 软件(开源软件,www.itk-snap.org)进行感兴趣区(region of interest,ROI)勾画,勾画以手动方式在横轴面图像上进行。ROI应包含病灶所有成分,包括坏死、钙化及血管,避开肠管、气体及周围系膜组织,边缘距离肿瘤边缘1 mm,勾画出肿瘤最大层面的单层ROI图像和肿瘤最大层面及邻近层面(瘤周区域)的双层ROI图像。
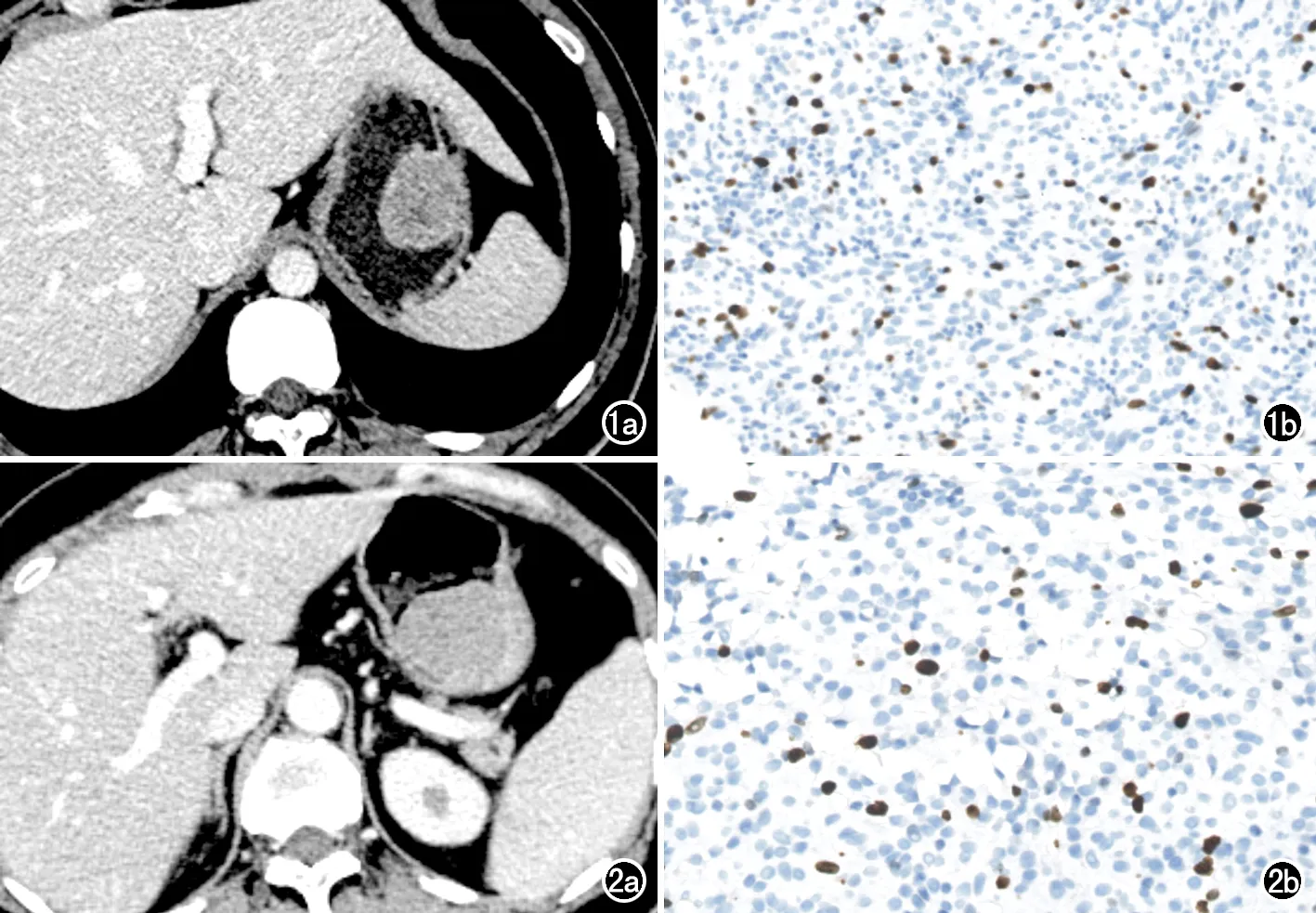
图1 胃间质瘤患者,男,76岁。a)术前轴面增强CT图像示胃大弯内生性黏膜下肿瘤,可见少许坏死,可见黏膜下强化、轻度强化及不均匀强化征象;b)术后病理证实为胃间质瘤,Ki-67增殖指数为7%,为高Ki-67表达。 图2 胃间质瘤患者,男,42岁。a)术前轴面增强CT 图像示胃底内生性黏膜下肿瘤,呈均匀中度强化;b)术后病理证实为胃间质瘤,Ki-67增殖指数为4%,为低Ki-67表达。
特征提取:将勾画完成的ROI图像分别导入IF软件(GE healthcare)提取病灶特征,提取的组学特征包括Original、Ipris、Wavelets、LBP、PLBP、WILBP、CoLIAGe、Shearlets和Gabors。该软件在完成离散化步骤的同时自动提取了组学特征参数。随机筛选出50个肿瘤的ROI中提取的组学参数进行一致性参数评价,用于个体间的比较。在个体内和个体间比较中一致性参数评价值大于0.75的组学参数被纳入组学模型的参数筛选中。
数据处理和模型构建:数据分析、模型建立及各模型的评价:选择70%作为训练集,30%作为验证集,按照随机分层抽样原理得到分配结果。采用重复分层分割法以减少单一验证数据集的偏向选择。采用最适合于高维数据的LASSO算法从主要数据集中选择最具预测性的组学特征和传统影像特征。使用所选组学特征和传统影像特征的线性组合,并以其LASSO系数加权,计算出组学特征和传统影像特征得分,即Rad-score=a1X1+a2X2+...+ anXn+b。由于特征不满足正态性,本研究采用Spearman等级相关系数冗余分析。Spearman相关系数显示值为0.9,也就是说对于所有特征,都进行了两两相关的计算。当系数r≥0.9时,系统会随机删除一个特征,保留另一个特征。在训练集中分别计算组学特征和传统影像特征的得分,利用多变量逻辑回归,结合组学特征及传统影像学特征,建立组合模型。在验证集中评估模型的性能。为了提高性能,考虑到本研究的样本量有限,对模型进行了10倍的交叉验证。在正则化L1逻辑回归中,许多特征得到了效能改善。为了提高综合模型的性能,在交叉验证过程中获得了最佳的λ值。在训练集中划分了10个独立的子队列,其中8个子队列用于模型拟合,剩下的子队列用于验证集。每个子群都被当作一个验证队列,该程序被验证了10次。重复10次后,每个子组都被视为验证集。最后,在交叉验证集中获得了λ值,并用正则化L1逻辑回归显示结果。
5.Ki-67 PI分析
由病理学医师盲法观察肿瘤细胞的形态,记录Ki-67 PI值,以阈值5%将GIST分类为高Ki-67 PI组(Ki-67 PI≥5%)和低Ki-67 PI组(Ki-67 PI<5%)。
6.统计学分析
采用SPSS 24.0软件进行统计学分析。计量资料以均值±标准差表示,两组间计量资料的比较采用t检验或Wilcoxon秩和检验。两组间定性资料的比较采用卡方检验或Fisher确切概率法。将不同Ki-67 PI分组中差异有统计学意义的传统影像征象、CT组学参数及两者结合的参数分别进行模型建立,采用logistic回归分析或多元回归分析。在训练集和验证集中,通过受试者工作特征(receiver operating characteristic,ROC )曲线分析和曲线下面积(area under curve,AUC)评价传统影像特征、影像组学和组合模型的诊断效能。对模型采用拟合度检验来校准ROC曲线,采用临床预测模型的决策曲线分析(decision curve analysis,DCA)评估其性能。以P<0.05为差异有统计学意义。
结 果
1.临床资料、病理学结果和传统影像学征象
本研究最终纳入患者305例,其中男162例,女143例,纳入患者的平均年龄为(54.29±12.00)岁(年龄范围21~83岁)。高Ki-67 PI组患者有138例,低Ki-67 PI组患者有167例(图1、2)。在传统影像征象中,肿瘤大小、强化方式、坏死、肿瘤内含气、增粗的供血或引流静脉、直接侵犯邻近脏器及系膜脂肪浸润在高Ki-67 PI组与低Ki-67 PI组间的差异有统计学意义(P值均<0.05)。两组患者的临床资料、病理学结果和传统影像学征象见表1。

表1 临床资料和传统影像学征象比较 (n,%)
2.影像组学结果及各模型的诊断效能
IF软件共生成5234个原始影像组学特征,通过一致性参数评价检验初步筛选出一致性参数大于0.75的892个组学特征,再经过Lasso-logistic回归(L1正则化),最终筛选出11个影像组学特征,分别为Double_wavelet.LLL_lbp.3D.m2_firstorder_Skewness (cont. var.)、Double_textural_phenotype_level_30.40. (cont.var.)、Single_wavelet.HLH_lbp.3D.k_firstorder_Entropy (cont. var.)、Single_textural_phenotype_level_70.80. (cont. var.)、Double_CoLIAGe2D_WindowSize3_Entropy_firstorder_Minimum (cont.var.)、Double_Normalized_radial_lengths_standard_deviation (cont.var.)、Single_original_glszm_LargeAreaEmphasis (cont.var.)、Single_wavelet.HHL_lbp.3D.m1_firstorder_Median (cont.var.)、Double_CoLIAGe2D_WindowSize9_Difference.Entropy_firstorder_Range (cont.var.)、Single_wavelet.HLH_lbp.3D.m1_firstorder_Median (cont.var.)、Double_wavelet.HHH_lbp.3D.m1_firstorder_Mean (cont. var.);最终建立组学模型(图3)。

图3 a)通过最小标准的10倍交叉验证用于选择LASSO模型中的调整参数(lambda)。绘制了二项式偏差与对数(lambda)的关系图,沿X轴上部的数字表示预测因子的数量。在最佳值处用最小标准和最小标准的标准误画出点状垂直线;b)396个影像组学特征的LASSO系数曲线。Y轴是系数的值,下方X轴表示对数(lambda)。上方X轴为非零系数的数目。垂直线画在使用10倍交叉验证选择的值。 图4 a) 训练集中,传统影像模型、组学模型及组合模型的ROC曲线; b) 验证集中,传统影像模型、组学模型及组合模型的ROC曲线; c) 训练集中,传统影像模型、组学模型及组合模型的DCA曲线; d) 验证集中传统影像模型、组学模型及组合模型的DCA曲线。注:Clinical model为传统影像模;Radiomic model为组学模型;Combined model为多参数组合模型。
在组学模型中,训练集和验证集预测GIST Ki-67 PI表达的效能良好,AUC值分别为0.802(95%CI:0.744~0.860)和0.730(95%CI:0.623~0.836),准确度、敏感度和特异度见表2。
对于传统影像征象,通过单因素差异性分析(Fisher's精确检验或Wilcoxon检验)、多因素逻辑回归和Step AIC 逐步逻辑回归,筛选得出传统征象中的肿瘤大小、含气及系膜脂肪浸润这3个征象,并建立传统影像模型。在该传统影像模型中,训练集和验证集预测GIST Ki-67 PI表达的诊断效能尚可,AUC值分别为0.720(95%CI:0.651~0.788)及0.665(95%CI:0.547~0.784),准确度、敏感度和特异度见表2。
利用上述筛选出来有统计学意义的传统影像征象和组学参数建立组合模型。组合模型在训练集和验证集预测GIST Ki-67 PI表达的AUC值分别为0.823(95%CI:0.768~0.878)及0.731(95%CI:0.626~0.836),准确度、敏感度、特异度值见表2。

表2 传统影像征象模型、组学模型及组合模型的诊断效能
在训练集和验证集中,传统影像模型、组学模型及组合模型的ROC曲线和各模型的DCA决策曲线见图4。组合模型的校准曲线见图5,结果显示训练集和验证集的预测观察值与实际观察值之间具有良好的一致性。
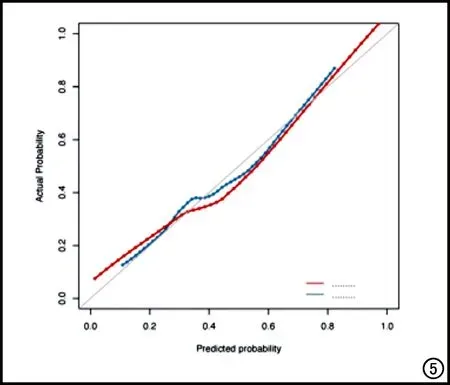
图5 校准曲线。
讨 论
本研究建立并验证了基于增强CT的影像组学模型来预测GIST的Ki-67 PI表达水平,表明了这是一种有效的临床决策和侵袭性评估的影像学方法。GIST具有不同的恶性潜能和生物学行为,侵袭性高的GIST具有高复发和转移率。Ki-67 PI是评估肿瘤异质性和细胞增长的一个重要免疫组化标志物[4]。根据有丝分裂计数,Ki-67核蛋白在G1、S和G2三个期的增殖细胞中高度表达,而在G0期下调,意味着其参与肿瘤细胞增殖、侵袭性和恶性潜能的发生发展[4]。根据以往的研究,Ki-67 PI高表达是GIST侵袭性、恶性潜能和不良生存预后的独立预测指标。高Ki-67 PI的GIST患者生存时间缩短,分子靶向治疗的疗效较差[10-13]。此外,Ki-67 PI与GIST的KIT或PDGFRA基因突变明显相关,这可能有助于基因靶向治疗的个体多学科规划[14]。然而,目前临床上采取活检的方式获得组织标本进行病理学检测。作为有创检查,活检操作存在发生并发症的风险,如引起肿瘤出血、肿瘤破溃并增加肿瘤播散的危险等[15]。创伤相对较小的超声内镜下细针穿刺活检仅限于超声内镜可以达到的消化道管腔范围内。由于穿刺获得组织较少,诊断难度常较大,部分需要反复穿刺才能明确诊断。针对部分多发病灶的GIST存在各个病灶间基因突变类型不一致的情况,目前临床无法实现一一穿刺。因此,术前对GIST的Ki-67 PI的非侵入性预测非常有价值。
相关研究表明,Ki-67 PI的高表达与GIST的恶性潜能显著相关[13,16,17]。然而,Ki-67 PI在GIST患者的临床治疗中并不是一个明确的预后预测因素,Ki-67 PI的最佳临界值仍不清楚。在以往的研究中,对于GIST高Ki-67值的临界值确定说法不一,从2.5%到10%均有采用[13,16,17]。在本研究中,笔者根据以往的研究将 “Ki-67 PI >5%”定义为高Ki-67 PI组。本研究采用5%作为高、低Ki-67值临界值的原因有两个:一个是在病理、临床和预后方面的研究中取得的结果不错,并且与4%、6%的数值相差不大;第二是本研究的Ki-67值范围从1%到50%波动,并且中位数的值为5%,因此选择5%作为临界值将GIST分为了高Ki-67 PI组和低Ki-67 PI组。以前研究发现[5],传统形态学CT特征是GIST Ki-67 PI表达水平的预测因素,这与本研究结果一致。本研究多变量回归分析结果显示,肿瘤大小、含气及系膜脂肪浸润是Ki-67 PI高表达水平的独立预测因素。然而,这些基于形态学的传统影像特征可能会受到不同观察者的影响。影像组学将影像图像转换为高通量的数字化数据,这些数据可以反映肿瘤的内在病理生理学。影像组学已被应用于预测各种肿瘤的Ki-67 PI表达水平。Gu等[18]建立了影像组学模型来预测非小细胞肺癌的Ki-67 PI表达水平,并取得了很好的准确度。Ma等[19]发现从动态增强MRI中提取的定量影像组学特征与乳腺癌的Ki-67 PI表达有关。此外,一项研究还建立了预测肝细胞癌Ki-67 PI状态的影像组学组合模型,该模型具有较高的鉴别能力和良好的校准度[20]。
上述研究表明了影像组学预测Ki-67 PI表达水平的实用性,但目前很少有使用影像组学对GIST的Ki-67 PI状态进行评估。因此,笔者使用基于增强CT的定量影像组学特征来预测GIST 的Ki-67 PI表达水平,结果表明该影像组学特征建立的组学模型在训练集和验证集组中显示出比传统影像学模型更高的诊断效能,AUC值分别为0.802和0.730;于是进一步建立一个包含传统影像特征和影像组学特征的结合模型,在良好的校准下,取得了比传统影像模型和影像组学模型更高、更稳定的预测效能(在验证集中的预测性能更稳定),AUC值分别为0.823(95%CI:0.768~0.878)和0.731。上述结果可能证明了影像组学特征在反映肿瘤内异质性方面比临床传统形态学的影像分析更有优势,可能间接表明GIST的细胞增殖状态。
本研究存在以下局限性:首先,所有的临床病理和影像学数据都是单中心回顾性的,然而生成的影像组学模型经过内部测试集的验证,以减少偏差,并取得了令人满意的性能;其次,与分子靶向药物的治疗效果和进一步预后有关的实验未开展,我们期待建立一个更全面的预测模型来展开更多的研究。本研究结果需要在未来的研究中使用进一步的前瞻性和多中心研究来提高影像组学的预测性能。
综上所述,本研究结果表明,基于增强CT的影像组学联合传统影像特征建立的组合模型具有无创预测GIST患者Ki-67 PI表达状态的价值。

