不同栽培基质对6种侧耳属食用菌风味成分的影响
殷朝敏 李雨鸿 范秀芝 史德芳 姚 芬 程 薇 高 虹,2,3,*
(1 湖北省农业科学院农产品加工与核农技术研究所,湖北 武汉 430064; 2 湖北省林下经济工程研究中心,湖北 武汉 430064; 3 湖北省香菇产业技术研究院,湖北 随州 441309)
平菇是侧耳属(Pleurotus)食用菌的俗称,主要包括糙皮侧耳(P.ostreatus)、刺芹侧耳(P.eryngii)、佛罗里达侧耳(P.florida)、金顶侧耳(P.citrinopileatus)和白黄侧耳(P.cornucopiae)等20多种广泛栽培的侧耳属真菌[1]。平菇不仅肉质脆嫩、风味独特,还含有多糖、凝集素、膳食纤维等多种生物活性物质[2]。此外,平菇适应性广、分解有机质能力强,能在多种工业、农业废弃物上生长[3],因此受到人们的极大关注。据中国食用菌协会公共服务平台(http://bigdata.cefa.org.cn/)的数据,平菇是我国第三大人工栽培的食用菌,从南到北均有分布,其主产区主要在山东、河南、河北和吉林等省份。
食用菌具有独特的香气,且香气因品种而异。现代仪器分析发现,食用菌的香气成分主要包括八碳化合物及其衍生物、萜烯类、含硫化合物以及醛类、酸类、酮类、酯类化合物等,其中八碳化合物和含硫化合物是核心成分[4]。近期研究表明,除遗传特性(品种)、生长阶段等内部因素外,食用菌风味物质还与栽培基质、贮藏及加工方式等外部因素密切相关[5]。李晓贝[6]和余昌霞等[7-8]研究证实,栽培基质不仅影响刺芹侧耳、草菇中的蛋白质、氨基酸等营养成分,还会显著影响其挥发性风味成分和非挥发性滋味成分含量。
为研究不同栽培基质对平菇风味成分的影响以及不同品种间风味成分差异,本试验采用顶空固相微萃取结合气相色谱-质谱联用(headspace solid-phase microextraction/gas chromatography-mass spectrometry,HS-SPME-GC-MS)技术对不同栽培基质上生长的6种平菇挥发性风味成分进行分析,通过相对气味活度值(relative odor activity value,ROAV)分析不同组分对整体风味的贡献;并测定6种平菇中游离氨基酸和核苷酸等滋味物质的含量,解析栽培基质与平菇风味成分之间的关系以及不同品种间风味成分差异,以期为平菇栽培及风味成分的开发利用提供科学依据。
1 材料与方法
1.1 菌株培养与样品收集
平菇菌种包括金顶侧耳PY1(P.citrinopileatus)、红平菇PH1(P.djamor)、佛罗里达侧耳PF6(P.florida)、糙皮侧耳P03和P49(P.ostreatus)、美味侧耳P380(P.cornucopiae),均购自于华中农业大学菌种中心。在PDA平板上将平菇菌种活化后,统一接种等量菌丝体(1/4平板量)至不同栽培基质袋料上(棉籽壳/杂木屑/桑枝屑96%,麸皮3%,石膏0.5%,石灰0.5%),25℃静置培养数天,待白色菌丝长满整个菌袋后,移至出菇房进行出菇管理[9]。收集第一潮和第二潮子实体样品(菌盖直径6~10 cm)低温烘干(50℃)至含水率为8%~10%,粉碎后过80目筛,等比例混合后作为后续测定的样品,4℃保存。
1.2 试剂与仪器
谷氨酸标品(纯度≥98%)和核苷酸标品(腺苷酸、胞苷酸、肌苷酸、鸟苷酸和尿苷酸)(纯度≥98%),均购于上海源叶生物科技有限公司;甲醇,分析纯,购于美国Sigma公司;其他化学试剂,购于上海国药集团化学试剂有限公司。
Agilent 7890A-5975C型气相色谱-质谱联用仪,美国Agilent公司;LC-20AT高效液相色谱仪(SIL-20A自动进样器、SPD-M20A二极管阵列检测器)、UV-1800紫外可见分光光度计,日本Shimadzu公司;50/30 μm二乙基苯/碳分子筛/聚二甲基硅氧烷(divinylbenzene/carboxen/polydimethylsiloxane,DVB/CAR/PDMS)萃取头和手动SPME进样器,美国Supeclo公司。
1.3 试验方法
1.3.1 顶空固相微萃取法 参考殷朝敏等[10]的方法,分别称取3.0 g不同栽培基质上培育的平菇干粉样品于40 mL萃取瓶中,加入3.0 g NaCl和20.0 mL煮沸的蒸馏水,混匀后将装有50/30 μm DVB/CAR/PDMS 萃取头的固相微萃取手持器插入萃取瓶中,在60℃磁力搅拌器水浴中平衡10 min,推出萃取头顶空吸附40 min,完成后将萃取头立即插入气相色谱仪的进样口,解析5 min后启动仪器收集数据。
1.3.2 不同样品挥发性成分的GC-MS分析 参考李小林等[11]和殷朝敏等[12]的试验条件并进行优化。GC条件:采用HP-5 ms非极性毛细管柱(60 m×250 μm×0.25 μm)。进样口温度250℃;载气为高纯氦(He),流速1.0 mL·min-1。柱温程序:初始温度40℃,保持2 min;以3℃·min-1的速率升至180℃,保持2 min;再以10℃·min-1的速率升至260℃,保持1 min。MS条件:电子电离能量70 eV,电压350 V,质量扫描范围 m/z 50~450;传输线温度280℃;离子源温度230℃;四极杆温度150℃。利用NIST 11.L谱库对得到的图谱数据进行串连检索和人工解析;査对相关资料,确认基峰、质荷比和相对峰度等信息,结合保留时间分别对各峰加以确认。
1.3.3 不同样品挥发性成分ROAV值计算 采用ROAV评价各挥发性成分对样品总体风味的贡献[13]。ROAV值计算方法如下:
(1)
定义对样品风味贡献最大的组分的ROAVstan=100,则其他挥发性成分的ROAV小于100。式中,Crstan、Tstan分别为对样品整体风味贡献最大组分的相对含量(%)和气味阈值(μg·kg-1);Cri、Ti分别为挥发性成分的相对含量(%)和气味阈值(μg·kg-1)。
1.3.4 不同样品5′-核苷酸含量测定 采用三氯乙酸-超声波法提取样品中的5′-核苷酸[14]。精确称量菇粉样品10.0 g,加入100 mL煮沸的蒸馏水,沸水浴中加热10 min;然后加入30 mL 5% TCA溶液混匀并超声处理5 min,4 000 r·min-1离心取上清并定容至100 mL。使用前用针管和0.45 μm滤膜过滤到进样瓶中。高效液相色谱(high performance liquid chromatography,HPLC)条件参考Yin等[15]的方法并稍作修改。色谱柱:InertSustain AQ-C18(4.6 mm × 250 mm,5 μm);流动相:甲醇/磷酸二氢钾溶液(0.05 mol·L-1, pH值4.1)比例为5/95(v/v),流速为0.8 mL·min-1; 紫外检测波长:260 nm;柱温:30℃。样品过0.45 μm滤膜,进样量10 μL,测定3次取平均值。
1.3.5 不同样品总游离氨基酸含量测定 总游离氨基酸含量测定采用茚三酮比色法[16]:精密称取100 mg谷氨酸标品配制成标准液(10.0 mg·mL-1)及不同浓度梯度工作液;分别吸取1.0 mL工作液、0.5 mL磷酸缓冲液(pH值8.0)和0.5 mL茚三酮溶液(w/v,2%)于一组30 mL比色管中,沸水浴加热15 min后加水定容至25 mL,室温静置10 min后,在570 nm处测定吸光度并绘制标准曲线。称取3.0 g菇粉,加入50 mL煮沸的蒸馏水,50℃超声辅助提取10 min;离心后取上清并用蒸馏水定容至50 mL,过0.45 μm滤膜后按照上述方法测定总游离氨基酸含量。
1.4 数据分析
采用SPSS 20.0软件进行方差分析、相关性分析,使用Origin Pro 8.5软件作图。样品分别进行3次测定,用平均值作为试验结果。
2 结果与分析
2.1 不同食用菌干品挥发性风味成分测定
采用顶空固相微萃取法对18个样品的挥发性风味物质进行富集,经GC-MS鉴定,剔除硅氧烷类杂峰[10]并选择匹配度大于80%的物质为鉴定的挥发性化合物。18个不同样品中共检出47种挥发性化合物,包括13种醛类化合物、9种醇类化合物、9种酮类化合物、2种呋喃类化合物、2种酯类化合物、2种羧酸类化合物、4 种烯烃类化合物、2种含氮类类化合物、1种含硫化合物和3种苯类化合物(表1)。18个样品中共有成分有17种,分别是正己醛、壬醛、苯乙醛、2-丁基-2-辛烯醛、1-己醇、1-辛烯-3-醇、正辛醇、2-辛烯-1-醇、苯乙醇、3-辛酮、1-辛烯-3-酮、3-辛烯-2-酮、甲基壬基甲酮、二氢-5-戊基-2(3 H)-呋喃酮、2-正戊基呋喃、已酸及甲氧基苯基肟。
由表1可知,同一基质栽培的不同菌株子实体中所含挥发性风味成分及相对含量差别较大。如在棉籽壳基质中,菌株PY1、PH1、PF6、P03、P49和P380分别检出30、26、27、33、26和25种挥发性物质,其中1-辛烯-3-醇相对含量均最高,分别为42.32%、75.69%、21.76%、41.11%、50.01%和72.04%。
栽培在不同基质中的同一菌株子实体中所含挥发性风味成分及相对含量差别也较大。以PY1菌株为例,该菌株在桑枝、杂木屑和棉籽壳基质上生长的子实体中分别检出23、25和30种挥发性物质;其中醛类物质种类分别有5、9和8种,相对含量分别为3.76%、6.41%和3.46%。这表明栽培基质对侧耳属食用菌挥发性风味物质组成和相对含量影响也较大。
2.2 不同食用菌干品挥发性风味成分种类分析
由图1可知,18个不同样品中挥发性化合物的种类和相对含量也有较大差异。18个样品中鉴定出的挥发性化合物总量为48.92%~93.15%,其中棉籽壳基质栽培的全部菌株、杂木屑基质栽培的PY1、PH1和P03菌株以及桑枝基质栽培的PH1、P49和P380菌株鉴定出的挥发性化合物总量都在70%以上。桑枝基质栽培的PF6菌株子实体中鉴定出的挥发性化合物总量最低,只有48.92%;其次是桑枝基质栽培的P03菌株、杂木屑基质栽培的P380菌株和PF6菌株,鉴定出的挥发性化合物总量分别为50.07%、50.61%和52.69%。结果显示这些样品中还有大量的挥发性物质没有被鉴定出来,表明PF6、P03、P380和PF6菌株在桑枝基质和杂木屑基质上生长的子实体可能具有更多样的挥发性化合物。
除此之外,18个不同样品中醇类化合物相对含量远高于其他类化合物,其相对含量为21.19%~86.46%,这可能与样品中1-辛烯-3-醇相对含量较高有关。除了杂木屑基质栽培的P380菌株(21.19%)、桑枝基质栽培的P03菌株(25.24%)和棉籽壳基质栽培的PF6菌株(26.74%),其他菌株子实体中醇类化合物相对含量均高于30%,其中醇类化合物相对含量超过80%的有桑枝基质栽培的PH1菌株(86.46%)、杂木屑基质栽培的PH1菌株(84.15%)和PY1菌株(84.43%)。除了桑枝基质栽培的P03菌株,棉籽壳基质上栽培的6个菌株子实体中均出现了较高含量的酯类化合物,表明棉籽壳基质可能更有利于侧耳属菌株子实体中酯类化合物的生成。

图1 不同基质上栽培的侧耳属食用菌干品挥发性风味组分种类及相对含量Fig.1 Classes and relative contents of volatile compounds in different Pleurotus edible mushrooms
八碳化合物是食用菌中的特征性挥发性物质,主要包括1-辛烯-3醇、2-辛烯-1醇、1-辛醇、3-辛醇、1-辛烯-3酮、3-辛酮、辛烯醛等[15,17]。研究表明,八碳化合物主要来自食用菌中多不饱和脂肪酸的氧化裂解[18]。18个样品中八碳化合物相对含量如图2所示。PH1菌株在3种基质上生长的子实体中八碳化合物相对含量均超过85%,且不同样品间无显著差异(P>0.05);类似的,PF6菌株在3种基质上生长的子实体中八碳化合物相对含量均低于40%,且不同样品间无显著差异(P>0.05),这表明栽培基质对PH1菌株和PF6菌株八碳化合物的生成影响不大。其他菌株在不同培养基上生长的子实体中八碳化合物相对含量差异较大,这可能是由栽培基质种类不同造成的。
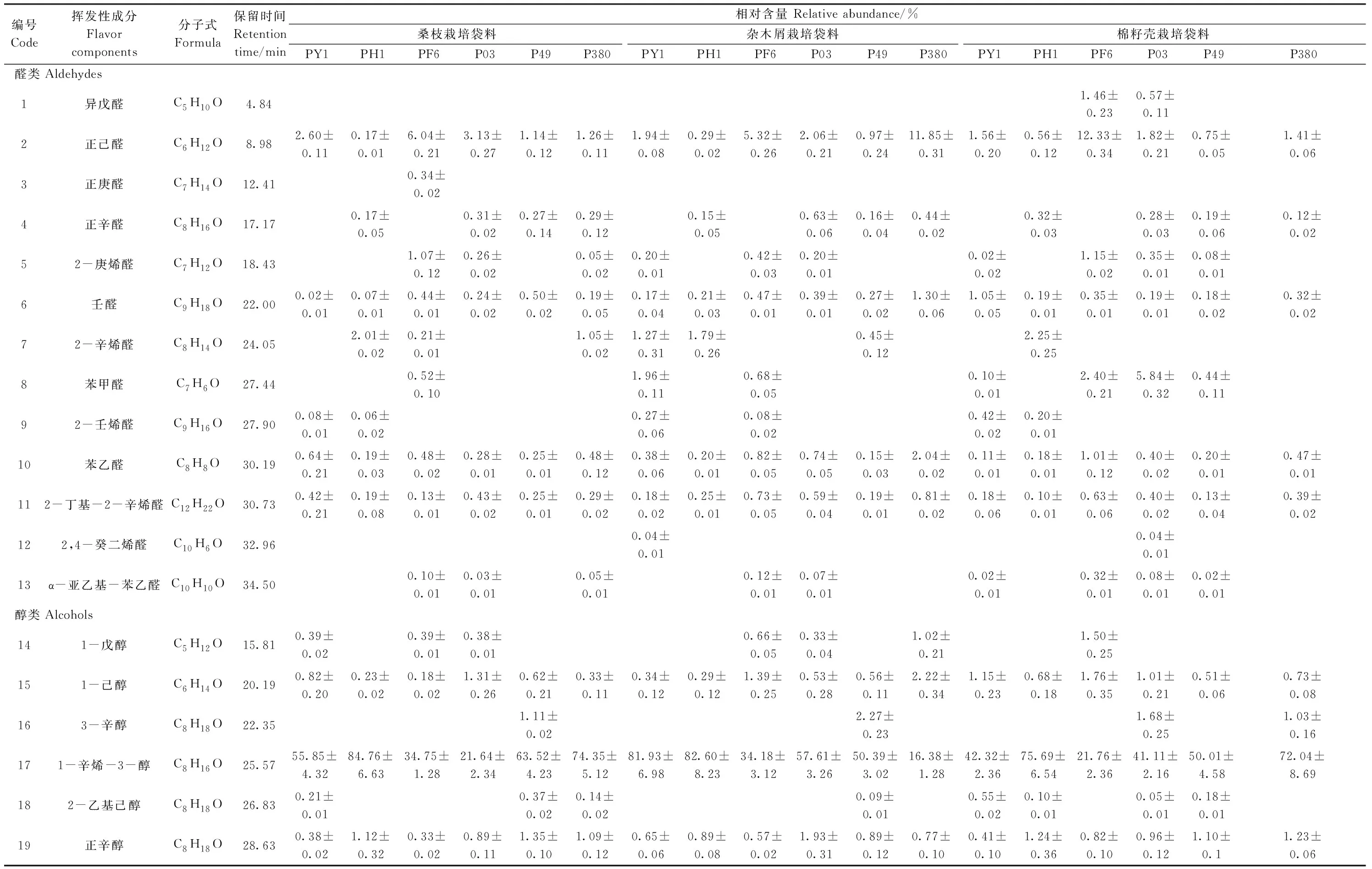
表1 不同基质上栽培的侧耳属食用菌干品挥发性风味组分及相对含量Table 1 Volatile compounds and their relative percentage contents identified in different Pleurotus edible mushrooms

表1(续)
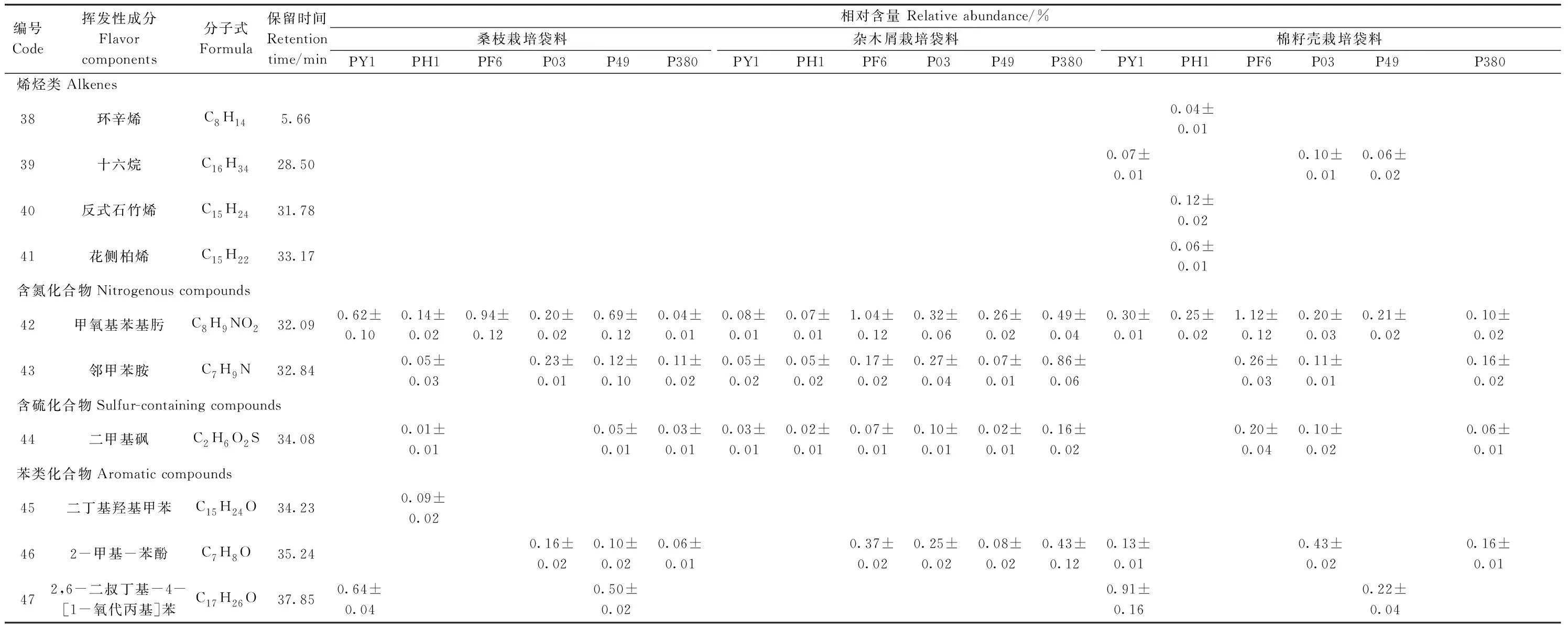
表1(续)
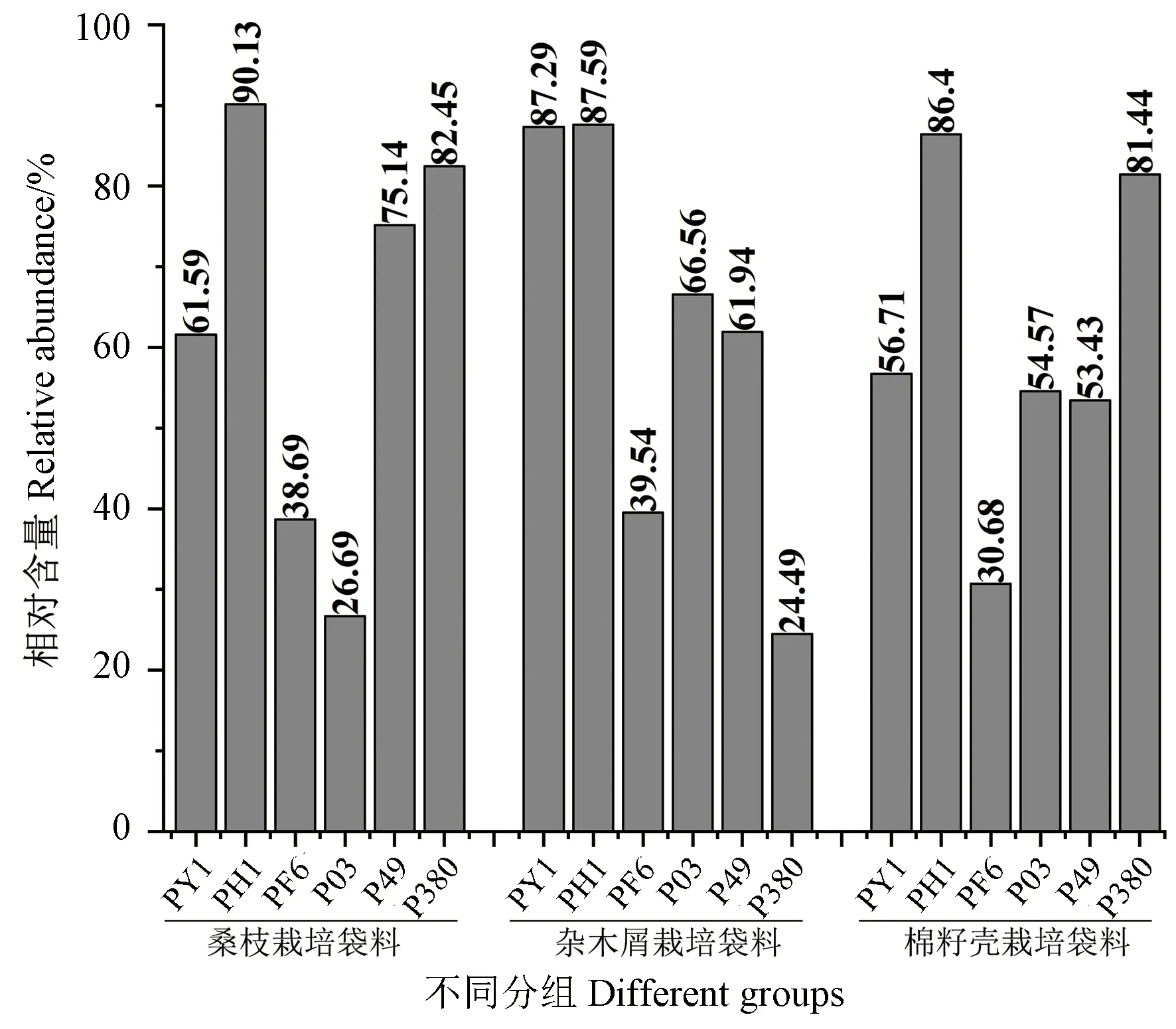
图2 不同基质上栽培的侧耳属食用菌干品中八碳化合物相对含量Fig.2 Contents of C8 volatile compounds in different Pleurotus edible mushrooms
2.3 不同食用菌干品关键挥发性风味成分分析
ROAV值能较好地评价单一风味组分对整体风味的贡献程度。ROAV值越大的组分对样品总体风味的贡献就越大[19]。一般认为ROAV≥1的组分为样品的关键风味化合物,0.1≤ROAV<1的组分对样品的总体风味具有重要的修饰作用[13]。为确定不同侧耳属食用菌干品的关键性风味物质,结合表1中组分的相对含量和感觉阈值,确定各组分的ROAV值,其中ROAV≥0.1的组分如表2所示。
所有样品中ROAV≥1的组分均包含1-辛烯-3-酮和1-辛烯-3-醇,且二者ROAV值较大。此外,桑枝基质栽培的PF6菌株、杂木屑基质栽培的PY1、PF6和P380菌株也出现了ROAV≥1的组分,分别是正己醛、2-壬烯醛、正己醛、正己醛和壬醛。这表明木屑类基质可能比棉籽壳类基质更有利于侧耳属食用菌中关键性风味物质的生成。
起修饰作用的挥发性组分种类与菌株及栽培基质均有一定关系,如PF6菌株在桑枝基质、杂木屑基质和棉籽壳基质生长的子实体中起修饰作用的挥发性组分(0.1≤ROAV<1)分别有5、5和1种,表明棉籽壳基质可能有利于PF6菌株中起修饰作用的挥发性组分的生成;而PH1菌株在3种基质生长的子实体中起修饰作用的挥发性组分分别有3、1和3种,表明杂木屑基质可能不利于PH1菌株中起修饰作用的挥发性组分的生成。
2.4 不同食用菌干品主体挥发性风味成分分析
18个样品中共检出17种共有的挥发性成分,以17种共有的香气成分相对含量构成18×17的矩阵,利用SPSS软件进行主成分分析,提取特征值大于1的主成分,结果如表3和表4所示。第1主成分方差贡献率为39.952%,其中正己醛和壬醛贡献最大,对应的特征向量分别为0.947和0.950;正己醛具有强烈的青香、草香、蔬菜和水果香气,壬醛具有蜡香、柑橘香和花香[20],故第1主成分主要反映侧耳属食用菌中的果香及青香。第2主成分方差贡献率为34.261%,2-壬烯醛和1-辛烯-3-醇贡献最大,对应的特征向量分别为0.690和0.639;2-壬烯醛具有脂肪气息、青香、黄瓜香、甜瓜香,1-辛烯-3-醇具有蘑菇香、青香、蔬菜香以及油腻的气息[21],因此第2主成分主要反映侧耳属食用菌中的油脂味。2个主成分方差累计贡献率达到74.213%,可基本反映总体情况。
2.5 不同食用菌干品非挥发性风味成分分析
挥发性风味物质是食用菌风味的主要组分,而非挥发性风味物质主要影响食用菌的滋味和口感[5],呈味核苷酸是食用菌非挥发性风味物质中的一类重要成分。研究表明,食用菌中核苷酸主要由核酸在特定生物酶降解下产生,常见的核苷酸主要有腺苷酸(5′-adenylic acid,5′-AMP)、胞苷酸(5′-cytidylic acid,5′-CMP)、肌苷酸(5′-inosinic acid,5′-IMP)、鸟苷酸(5′-guanylic acid,5′-GMP)和尿苷酸(5′-uridylic acid,5′-UMP)等[5]。本试验采用HPLC法测定了18个食用菌干品中的5′-核苷酸含量,结果如表5所示。相较于其他菌株,菌株PY1和PH1在3种不同栽培基质上生长的子实体中具有较高的5′-AMP和5′-CMP含量(>9 mg·g-1DW)。在同一栽培基质中,菌株PF6、P03、P49和P380子实体中5′-AMP、5′-CMP和5′-UMP含量差别不大。部分样品中未检测到5′-GMP和5′-IMP。
18个食用菌干品中,总5′-核苷酸含量最高的是杂木屑基质栽培的PY1菌株(43.86 mg·g-1DW),其次是桑枝基质栽培的PY1菌株(33.26 mg·g-1DW)和杂木屑基质栽培的PH1菌株(29.10 mg·g-1DW)。相较其他菌株,菌株PY1和PH1在3种不同栽培基质中具有最高的总5′-核苷酸含量,其中含量最高的是杂木屑基质,其次是桑枝基质和棉籽壳基质。这表明木屑基质可能有助于PY1和PH1菌株中5′-核苷酸的形成。除此之外,杂木屑基质和桑枝基质栽培的PY1和PH1菌株具有较高的风味核苷酸含量,分别为18.28和17.89 mg·g-1DW、15.00和13.23 mg·g-1DW;棉籽壳基质中风味核苷酸含量最高的是P380菌株(18.81 mg·g-1DW),其次是PH1菌株(12.38 mg·g-1DW),而PY1菌株中风味核苷酸含量只有11.55 mg·g-1DW,这表明不同基质对菌株合成风味核苷酸具有较大影响。

表2 不同基质上栽培的侧耳属食用菌干品中主体挥发性物质及对应ROAV值Table 2 ROAV value of key aroma compounds in different Pleurotus edible mushrooms

表3 主成分分析的特征值Table 3 Eigenvalues of principal component analysis

表4 主成分分析的特征向量Table 4 Eigenvectors of principal component analysis
除了核苷酸,游离氨基酸也是食用菌中重要的风味物质[5]。由表5可知,18个食用菌干品中总游离氨基酸含量为8.54 ~ 25.34 mg·g-1DW。总游离氨基酸含量最高的是杂木屑基质栽培的PY1菌株(25.34 mg·g-1DW), 其次是杂木屑基质栽培的P49菌株(19.73 mg·g-1DW)和桑枝基质栽培的PY1菌株(18.87 mg·g-1DW)。 总体来看,杂木屑基质栽培的所有菌株总游离氨基酸含量均高于桑枝基质和棉籽壳基质,这表明杂木屑有利于菌株中游离氨基酸的生成。
3 讨论
食用菌不但味道鲜美,还含有多糖、三萜、黄酮等多种生物活性成分以及特殊的香气,深受消费者喜爱[15]。食用菌风味主要由嗅觉上的香味感受和味觉上的滋味感受组成,其分别是子实体中的挥发性和非挥发性物质作用的效果。研究发现食用菌中的挥发性物质主要包括八碳挥发性化合物、含硫化合物、醛类、酮类、醇类等化合物[12],各类化合物相互修饰、调和,造就了食用菌独特的香气。酮类化合物主要来自于不饱和脂肪酸的氧化反应,一般伴有花香和果香风味,且香味持久;醛类化合物具有特殊的香气,多为花香及果香气味;部分酮类和醛类化合物香味阈值较低,能与其他化合物相互重叠产生较强的风味效应[22-23]。醇类化合物阈值较高,但浓度达到一定程度后会影响食用菌风味,食用菌中特征性醇类物质是1-辛烯-3-醇;呋喃等化合物也都具有特殊的气味,虽然相对含量较低,但香味阈值较低,因此其对食用菌整体香味起着重要调和作用;其他类型化合物因香味阈值较高,对食用菌整体风味起着修饰作用[4,24]。本研究发现,6种侧耳属食用菌主体挥发性物质主要是醛类、酮类、醇类和呋喃类等(表2),与前人研究结果一致[12,19,24]。
影响食用菌风味形成的因素较多,包括品种、遗传特性、生长阶段等内部因素以及栽培基质、贮藏方式、加工方式等外部因素[5]。食用菌品种不同,其特征性风味物质也不相同。殷朝敏等[12]和张宪臣等[24]比较分析了不同食用菌挥发性风味物质成分,发现不同食用菌特征性风味物质及主体挥发性风味物质均存在显著差异。李巧珍等[25]研究了不同杏鲍菇菌株子实体的挥发性风味成分,发现不同菌株子实体的香气差别显著。本试验在同一基质中栽培不同侧耳属菌株,采摘子实体后测定不同菌株的风味成分,在保证试验条件一致的情况下,发现不同菌株子实体中所含挥发性风味成分、5′-核苷酸及总游离氨基酸含量差别较大,证实了品种对侧耳属食用菌风味物质影响较大。
不同栽培基质具有不同的碳氮比,会对食用菌子实体产量[26-27]、基本营养成分[28-30]、酶活性[31]以及次级代谢产物[32]等产生较大影响。从本质上讲,食用菌风味物质是一类次级代谢产物,其成分和含量也会受到栽培基质的影响。如李晓贝[6]发现单一木屑碳源的基质栽培的杏鲍菇蛋白质、游离氨基酸、5′-核苷酸含量较高,而玉米芯与木屑复配基质栽培的杏鲍菇具有较高的氨基酸评分及挥发性风味物质含量。余昌霞等[7-8]发现用金针菇菌渣栽培的草菇香气品质最差;以棉籽壳为基质栽培草菇,其粗蛋白、水解氨基酸含量及组成最优;以稻草为基质栽培草菇,其可溶性糖醇、有机酸含量最高。本研究发现除了桑枝基质栽培的P03菌株,棉籽壳基质上栽培的6个菌株子实体中均出现了较高含量的酯类化合物(图1),这表明棉籽壳基质可能更有利于侧耳属菌株子实体中酯类化合物的生成。
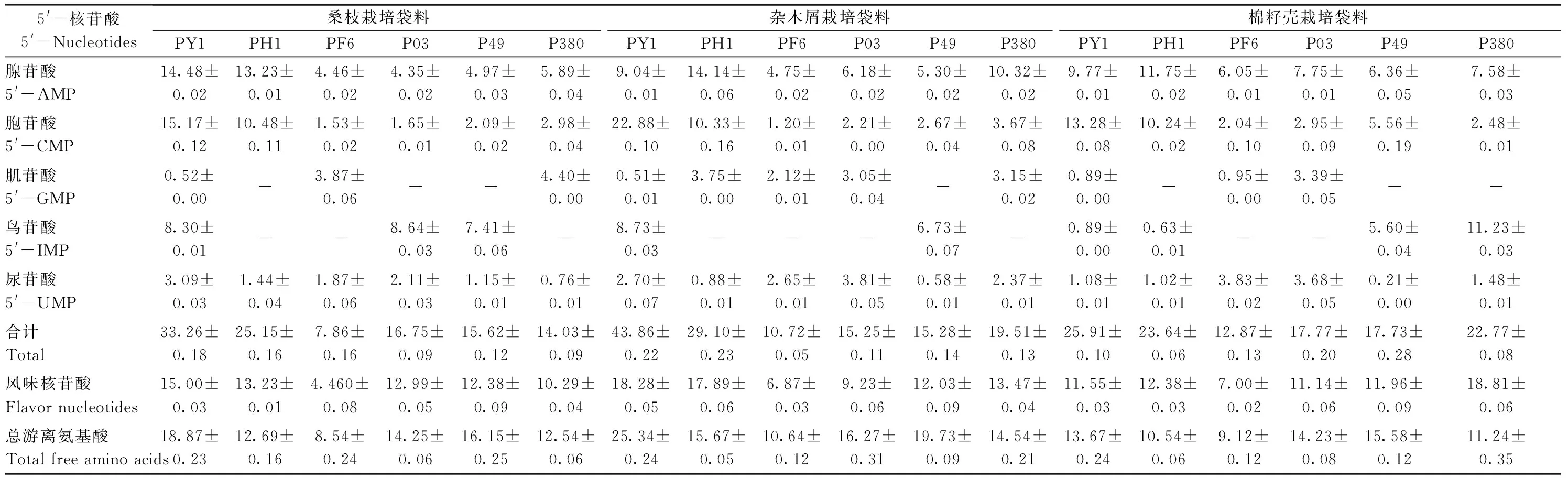
表5 不同基质上栽培的侧耳属食用菌干品中5′-核苷酸和总游离氨基酸含量Table 5 The contents of 5′-nucleotides and total free amino acids in different Pleurotus edible mushrooms /(mg·g-1 DW)
4 结论
本研究采用HS-SPME-GC-MS方法分析桑枝基质、杂木屑基质和棉籽壳基质栽培的6个侧耳属菌株的挥发性风味物质,发现18个样品中共检出47种挥发性化合物,其中共有成分有17种。此外,通过测定18个样品中5′-核苷酸和总游离酸含量,发现杂木屑基质栽培的所有菌株总游离氨基酸含量均高于桑枝基质和棉籽壳基质。结果表明,棉籽壳基质可能有利于侧耳属菌株子实体中酯类化合物的生成,木屑类基质可能比棉籽壳类基质更有利于侧耳属食用菌中关键性风味物质的生成,而杂木屑基质可能比桑枝基质和棉籽壳基质更有利于游离氨基酸的生成。

