蒙古马母体与胎儿胃肠道NF-κB 信号通路相关基因mRNA 相对表达水平研究
蔺雅楠,赵 媛,苏少锋,,赵俊利,李雅静,陶金山,张建强,翁雅娟,武 慧,王秀美,赵一萍
(1.内蒙古农业大学动物科学学院/内蒙古自治区马属动物遗传育种与繁殖重点实验室/农业农村部马属动物遗传育种与繁殖科学观测实验站/内蒙古农业大学马属动物研究中心,内蒙古 呼和浩特 010018;2.内蒙古自治区农牧业科学院,内蒙古 呼和浩特 010031;3.呼和浩特市行政审批和政务服务局综合保障中心,内蒙古 呼和浩特 010020)
肠道作为机体最大和最重要的免疫器官,对维持动物生长发育和机体健康具有重要意义[1]。机体中大多数免疫细胞来自肠道, 约70%的IgA在肠道产生, 超过90%的感染性疾病的产生与肠道有关[2]。 肠上皮细胞在肠道免疫系统中扮演重要角色, 通过产生抗菌化合物和细胞因子等对机体产生免疫作用,保护机体健康[2]。 肠上皮细胞与肠道相关的淋巴组织中的免疫细胞直接接触。 肠道免疫系统主要由肠道菌群、肠上皮细胞、肠上皮内淋巴细胞、 固有层淋巴细胞及派氏淋巴结等构成,通过细胞因子、抗菌肽、代谢产物和众多调节分子的复杂网络紧密相连[3]。 肠上皮细胞表达特异性受体,例如Nod 样受体和Toll 样受体等,这些受体被激活后可诱导细胞信号转导, 进一步激活核因子κB(nuclear factor-κB,NF-κB)途径[4]。NFκB 在大部分细胞中均有表达, 尤其是在小肠部位。当机体受到外界刺激时,NF-κB 可以通过调节细胞因子基因的表达,参与机体免疫应答,此外,NF-κB 在炎症反应和抗病原体过程中也发挥重要作用[5]。 NF-κB 家族包括p65 (RelA)、NF-κB1(p50/p105)、NF-κB2 (p52/p100)、RelB 和c-Rel,这些蛋白之间可以相互作用, 并且结合形成同源或异源二聚体,激活或抑制多种基因的表达[6],来自抗原受体、 模式识别受体、TNF 和IL-1 细胞因子家族成员的受体以及其他多种信号可诱导NFκB 异二聚体的差异激活[7-9]。 NF-κB 信号通路激活因子主要包括TNF-α、IL-1β、IL-8 等[10-12]。
研究表明, 肠道免疫功能在动物胎儿时期就已经开始建立并且逐渐形成[13-14]。 在母马妊娠期间,胎儿的免疫系统就已经产生IgM[15]和IgG[16]。成年马的免疫成分似乎都存在于马驹身上[17],成年马有60%以上基因的表达水平高于新生马驹[18]。马胎儿的免疫系统从开始建立到趋于完善是一个复杂的过程, 更好地了解其形成过程对于解析马多种疾病的发病机制是必要的。目前,关于母马和新生马驹的免疫研究较多[15-17],几乎没有关于妊娠母马与胎儿免疫的研究, 围绕马胎儿时期肠道免疫功能的研究更少。 蒙古马作为我国优良的地方马品种,具有耐粗饲、抗性强等特点[19]。 鉴于肠道在机体免疫功能中的重要作用, 该研究采用实时荧光定量PCR 方法(qPCR)检测蒙古马母体及胎儿胃肠道不同区段组织中NF-κB 信号通路6个相关基因的mRNA 相对表达水平, 分析这些基因在母体及胎儿胃肠道组织中的表达谱, 比较其在母体及胎儿胃肠道组织中表达水平的差异,以期为丰富蒙古马母体及胎儿免疫系统的研究提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 试验动物
从内蒙古包头市达尔罕茂明安联合旗某养殖场随机选取3 匹怀孕的健康蒙古马, 母马平均年龄(8.17±2.75)岁,胎儿平均日龄(165±30)d。
1.1.2 主要试剂
Trizol 试剂,购自宝生物工程(大连)有限公司;硼酸,北京市新光化学试剂厂产品;琼脂糖,Life Technologies Corporation 公 司 分 装; 核 酸 染料,Bioteke Gorporation 公司分装;DNA Marker DL 2 000、PrimeScriptTMRT Master Mix (Perfect Real Time) 试剂盒、TB Green®Premix ExTaqTMⅡ(Tli RNaseH Plus)试剂盒等分子生物学试剂,购自宝生物工程(大连)有限公司。
1.1.3 主要仪器
实时荧光定量PCR 仪(型号:CFX96 Touch)、凝胶成像系统(型号:Gel Doc XR+),美国Bio-Rad公司产品;琼脂糖凝胶电泳仪(型号:DYY-11),北京六一仪器厂产品; 酶标仪 (型号:NanoDrop 2000C),美国Thermo 公司产品。
1.2 试验方法
1.2.1 样品采集
将3 匹怀孕蒙古马屠宰, 屠宰过程中取出胎儿,分别采集母体及胎儿的胃、十二指肠、空肠、回肠、盲肠、结肠(大结肠、小结肠)和直肠组织,于超低温冰箱(-80 ℃)中保存。
1.2.2 总RNA 提取及质量检测
采用Trizol 法提取蒙古马母体及胎儿胃肠道不同区段组织的总RNA。 称取0.1 g 组织样品研磨成粉末状态,加入1 mL Trizol 裂解,涡旋混匀,室温静置10 min,加入0.2 mL 氯仿混匀,室温静置15 min,4 ℃12 000 r/min 离心15 min, 留上清液加入0.5 mL 异丙醇混匀,室温静置10 min,4 ℃12 000 r/min 离心10 min, 弃上清液, 加入1 mL 75%乙醇, 涡旋振荡,4 ℃7 500 r/min 离心5 min,干燥10 min,使用无RNA 酶水100 滋L 反复吹打几次。 检测提取的样本总RNA 质量和浓度,样品的OD260nm/OD280nm值在1.8~2.0 时可用于后续试验。
1.2.3 cDNA 的合成
按照PrimeScriptTMRT Master Mix(Perfect Real Time) 试剂盒说明书进行cDNA 的合成, 合成方法、反应体系和条件参照参考文献[20]中报道的方法。 总反应体系为10 滋L, 制备后立即进行反应,反转录条件为:37 ℃15 min,85 ℃5 s,温度降至4 ℃终止反应,cDNA 合成后于-80 ℃保存。
1.2.4 qPCR 引物设计
以β-actin 基因作为内参基因, 选取NF-κB信号通路上的6 个相关基因NF-κB p50、NF-κB p65、NFKBIA、IL-1β、TNF-琢 和IL-8 作为目的基因。 根据NCBI 的GenBank 数据库中收录的基因序列,使用Primer Premier 3.0 软件进行引物设计,利用NCBI 的Primer-BLAST 功能验证设计引物的特异性。引物序列、参考序列及目的片段长度如表1 所示。该研究所用引物均由生工生物工程(上海)股份有限公司合成。

表1 qPCR 引物信息
1.2.5 qPCR 检测基因mRNA 相对表达量
使用实时荧光定量PCR 仪对不同组织各基因的mRNA 相对表达量进行分析。 按照TB Green®Premix ExTaqTMⅡ(Tli RNaseH Plus)试 剂盒说明书操作, 反应体系总计20 滋L:TB Green Premix ExTaqⅡ(Tli RNaseH Plus)(2×conc.)10 滋L,正向引物(10 滋mol/L)0.8 滋L,反向引物(10 滋mol/L)0.8 滋L,cDNA 模板1.0 滋L,DNase/RNase-Free 去离子水7.4 滋L。qPCR 反应条件:95 ℃预变性5 min;95 ℃变 性60 s,60 ℃退火30 s,72 ℃延伸1 min,40 个循环。最终在4 ℃下保存备用,每个样品的各基因均进行3 次扩增, 分别得出各样品各基因的Ct 值。
1.2.6 数据处理
以β-actin 基因为内参基因,采用2-△Ct(△Ct=目的基因的Ct 值-内参基因Ct 值) 定量分析方法,对NF-κB 信号通路上目的基因的mRNA 相对表达量进行定量分析。采用SPSS 9.0 统计学软件,应用单因素方差分析法对单个基因的mRNA 相对表达量在不同组织间的差异进行显著性检验,利用LSD 法进行多重比较; 采用t 检验法分析母体和胎儿相同组织中单个基因的mRNA 相对表达量差异。P<0.05 表示差异显著,P<0.01 表示差异极显著,P≥0.05 表示差异不显著。
2 结果与分析
2.1 蒙古马母体胃肠道NF-κB 信号通路相关基因mRNA 相对表达量
检测的6 个基因 (NF-κB p50、NF-κB p65、NFKBIA、IL-1β、TNF-琢 和IL-8) 在蒙古马母体胃肠道不同区段(胃、十二指肠、空肠、回肠、盲肠、大结肠、小结肠和直肠)组织中均有表达(见图1A)。8 个组织中NF-κB p65、NF-κB p50 和NFKBIA 基因的mRNA 相对表达量均较高, 而其他3 个基因的mRNA 相对表达量普遍较低。 各基因的mRNA相对表达量在不同组织之间存在差异, 但均未达到显著(P≥0.05)水平(见图1B)。NF-κB p50 基因在胃中表达量最高, 其次是盲肠和直肠;NF-κB p65 基因在胃中表达量最高, 其次是盲肠;NFKBIA 基因在胃中表达量最高,其次是盲肠和回肠;IL-1β 基因在直肠中表达量最高;TNF-琢基因在胃中表达量最高,其次是盲肠;IL-8 基因在盲肠中表达量最高。

图1 NF-κB 信号通路相关基因在蒙古马母体胃肠道不同区段组织中的mRNA 相对表达量
2.2 蒙古马胎儿胃肠道NF-κB 信号通路相关基因mRNA 相对表达量
NF-κB 信号通路的6 个基因 (NF-κB p50、NF-κB p65、NFKBIA、IL-1β、TNF-琢 和IL-8)在蒙古马胎儿胃肠道的8 个组织(胃、十二指肠、空肠、回肠、盲肠、大结肠、小结肠和直肠)样品中均有表达(见图2A)。 总体来看,在8 个组织中,NF-κB p50、NF-κB p65 和NFKBIA 基因的mRNA 相对表达量均较高, 而IL-1β、TNF-琢 和IL-8 基因的mRNA 相对表达量均较低。 各基因的mRNA 相对表达量在不同组织之间存在差异, 但均未达到显著(P≥0.05)水平(见图2B)。NF-κB p50 基因在直肠中表达量最高, 在回肠中表达量最低;NF-κB p65 基因在胃中表达量最高, 在大结肠中表达量最低;NFKBIA 基因在小结肠中表达量最高,在空肠中表达量最低;IL-1β 基因在直肠中表达量最高,在小结肠中表达量最低;TNF-琢基因在空肠中表达量最高,在盲肠中表达量最低;IL-8 基因在空肠中表达量最高,在小结肠中表达量最低。
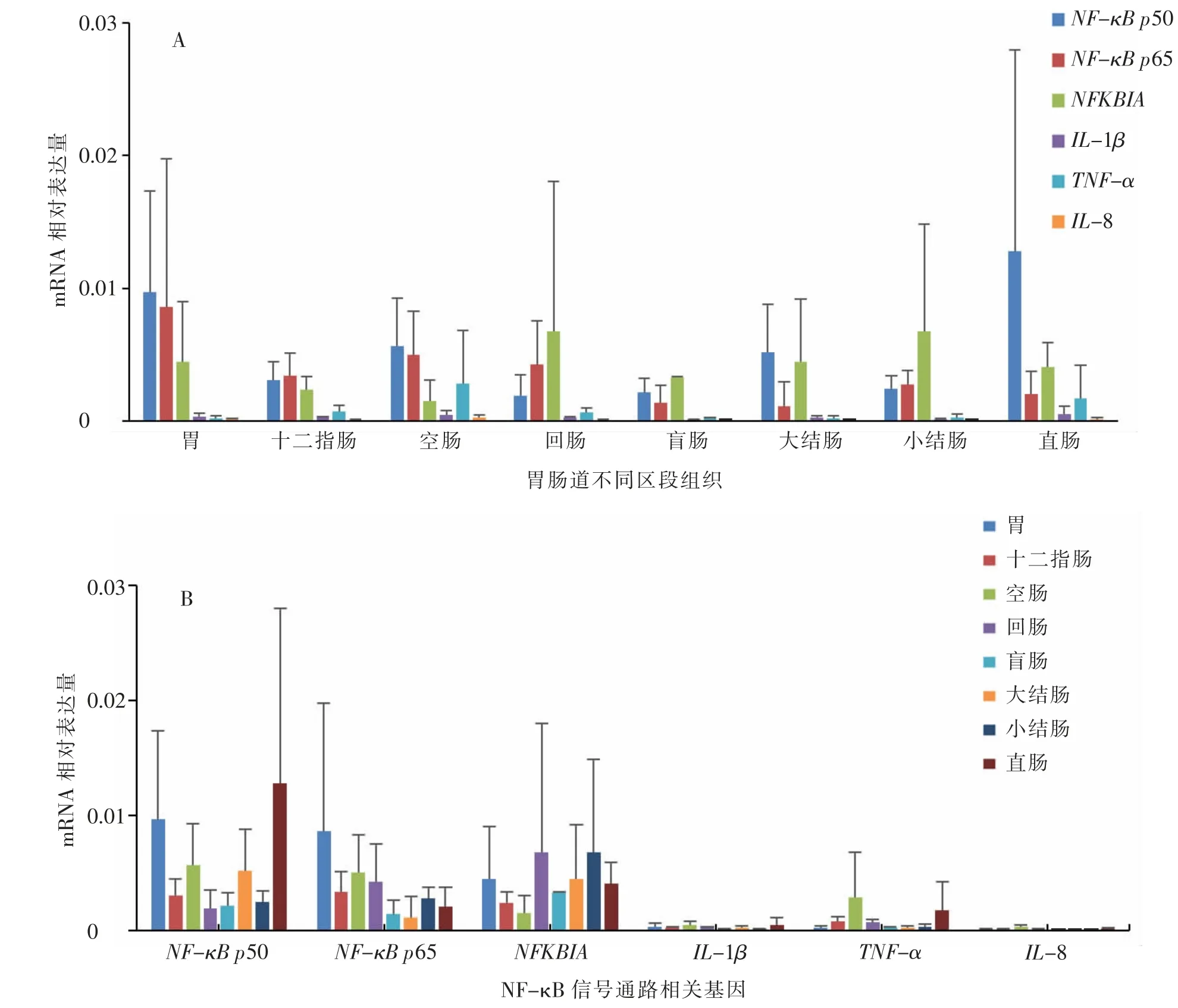
图2 NF-κB 信号通路相关基因在蒙古马胎儿胃肠道不同区段组织中的mRNA 相对表达量
2.3 母体与胎儿胃肠道NF-κB 信号通路相关基因mRNA 相对表达量差异分析
由图3 可知, 检测的6 个基因在不同胃肠道组织的mRNA 相对表达量大部分是母体高于胎儿。 除直肠外,NF-κB p50 基因在母体胃肠道不同区段组织中的mRNA 相对表达量均高于胎儿,在回肠和盲肠中的表达量差异达到显著(P<0.05)水平。 除空肠和回肠外,NF-κB p65 基因在母体胃肠道不同区段组织中的mRNA 相对表达量均高于胎儿,在大结肠中的表达量差异达到显著(P<0.05)水平。 NFKBIA 基因在母体胃肠道不同区段组织中的mRNA 相对表达量均高于胎儿, 在大结肠中的表达量差异达到显著(P<0.05)水平。 除空肠外,IL-1β 基因在母体胃肠道不同区段组织中的mRNA 相对表达量均高于胎儿,但表达量差异均未达到显著(P≥0.05)水平。 除空肠和直肠外,TNF-琢基因在母体胃肠道不同区段组织中的mRNA 相对表达量均高于胎儿, 但表达量差异均未达到显著(P≥0.05)水平。IL-8 基因在母体胃肠道不同区段组织中的mRNA 相对表达量均高于胎儿, 在大结肠中的表达量差异达到显著(P<0.05)水平。
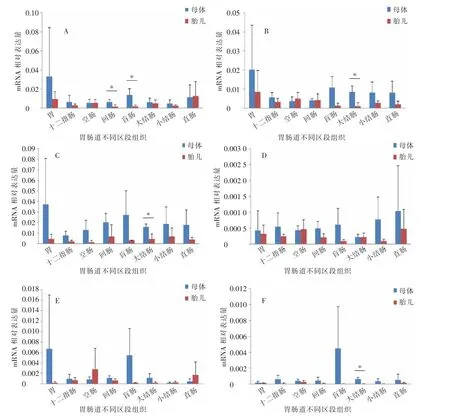
图3 蒙古马母体与胎儿胃肠道不同区段组织中NF-κB 信号通路相关基因mRNA 相对表达量
3 讨论
NF-κB 家族转录因子在调节细胞分化、增殖、存活、凋亡、免疫应答和炎症反应等多种生物学过程中起着重要作用[21]。 典型的NF-κB 被激活后可调节靶基因的转录,以应对各种外部刺激,导致相应生理病理变化[22]。 NF-κB p50 异源二聚体主要受IκBα 蛋白调控, 该蛋白的基因表达形式是NFKBIA 基因[9]。 赵一萍等[23]采用qPCR 技术分析了蒙古马肝脏、脾脏、肺和血液中的NF-κB 信号通路上7 个基因的表达情况, 发现NF-κB p50、NF-κB p65 和NFKBIA 基因在4 个部位有较高表达, 而IL-1β、TNF-α 和IL-8 基因的mRNA 相对表达量均较低。 该研究对蒙古马母体及胎儿胃肠道组织中NF-κB 信号通路的6 个基因mRNA 相对表达量的测定结果与赵一萍等的研究结果基本一致,即NF-κB p50、NF-κB p65 和NFKBIA 基因在胃肠道8 个部位有较高表达, 而IL-1β、TNF-α和IL-8 基因的mRNA 相对表达量均较低,这可以说明NF-κB p50、NF-κB p65 和NFKBIA 基因在蒙古马免疫调控中发挥重要作用。Collado-Romero等[24]和Li 等[25]使用qPCR 技术对猪不同部位免疫系统中相关基因的mRNA 相对表达水平进行定量分析,分别发现NF-κB p50 基因的表达量为回肠>空肠>结肠和NF-κB p65 基因的表达主要集中在小肠部位。 该研究对蒙古马母体肠道组织中NFκB p50 和NF-κB p65 基因mRNA 相对表达量的测定结果与Collado-Romero 等和Li 等的研究结果基本一致, 即NF-κB p50 基因在回肠中的表达量最高,其次为空肠和结肠,而NF-κB p65 基因基因在母体和胎儿的小肠部位有较高的表达量,说明NF-κB p50 和NF-κB p65 基因在蒙古马肠道免疫调节中占据不可忽视的地位。 NF-κB 被激活后会诱导产生大量的促炎细胞因子,例如IL-1β、TNF-α、IL-8 等,进而诱导炎症发生[26]。Lindenberg等[27]通 过qPCR 测 量 编 码IL-6,IL-10 和TNF-α等基因在24 匹健康马的回肠、盲肠和结肠均有表达。 该研究对蒙古马母体及胎儿胃肠道组织中NF-κB 信号通路的TNF-α 基因mRNA 相对表达量定量分析, 发现其在回肠、 盲肠和结肠均有表达,与Lindenberg 等研究结果基本一致,但表达量很低,这与选取的试验动物体况健康,没有发生肠道感染性疾病有关。研究表明IL-1β[28]、TNF-α[24]、IL-8[24]基因在不同组织中的表达量存在差异。 该研究检测到IL-1β、IL-8 和TNF-α 基因在蒙古马母体及胎儿胃肠道不同区段组织中的mRNA 相对表达量均较低,这可能与选取的马匹体况健康、没有发生炎症有关,也可能说明肠道作为免疫器官,在蒙古马母体和胎儿的生长发育中扮演重要角色,胎儿和母体的肠道免疫可能存在潜在联系。该研究检测的6 个基因在不同胃肠道区段组织中的mRNA 相对表达量基本表现为母体高于胎儿,这可能是由于母体的胃肠道发育比较完善, 而胎儿的肠道免疫正在建立, 并且母体肠道可能受到外源刺激,进而触发机体肠道免疫系统,产生连锁反应, 导致母体的基因表达量高于胎儿。 在该研究中, 对比母体和胎儿不同部位相关基因mRNA 相对表达量的差异发现,NF-κB p50 基因在母体和胎儿的盲肠及回肠中的表达量差异显著 (P<0.05),NF-κB p65 基因和NFKBIA 基因在大结肠中的表达量差异显著(P<0.05),并且3 个基因的表达量均为母体高于胎儿,充分说明NF-κB p50、NF-κB p65 和NFKBIA 基因在肠道免疫调节中的重要性。
4 结论
NF-κB 信号通路上6 个基因在蒙古马母体和胎儿胃肠道8 个组织中均有表达, 且存在一定差异; 母体部分肠道区段组织中的NF-κB p50、NFκB p65、NFKBIA 基因mRNA 相对表达量显著高于胎儿。

