毛细管微反应器降解亚甲基蓝废水试验研究
王 栋夏晓露刘汇洋石 赛俞俊楠俞建峰
(江南大学机械工程学院,江苏省食品先进制造装备技术重点实验室,江苏 无锡 214122)
随着化工、医药、染料工业的发展,有机废水排放量已位于工业废水总排放量前列,具有色度高、毒性强、成分复杂、降解困难等特点[1]。 常用的有机废水降解处理技术主要有物理法[2]、生物法[3]与化学法[4]等。 由于化学法中的高级氧化法具有高效、廉价、适应性强等特点而广泛应用于有机废水降解中[5]。
过硫酸盐高级氧化法是近几年来发展起来的一种新型的高级氧化技术[6]。 过硫酸盐在光、热和过渡金属离子等条件下,分子中的S2O2-8 可活化产生硫酸根自由基(SO-4·),氧化还原电位可达2.5~3.1 V,对废水中的难降解有机物具有极强的氧化能力[7]。 过渡金属活化过硫酸盐产生硫酸根自由基的方法,因其反应体系简单、反应条件温和、能耗较低,在有机物氧化降解领域得到广泛应用。 赵子叶等[8]分析比较了6 种金属离子活化过硫酸钠降解靛蓝胭脂红的效果,结果表明Fe2+活化效果最佳。刘小佳等[9]证明了溶液初始pH 值、Fe2+浓度、过硫酸钠浓度、溶液初始温度等对亚甲基蓝降解率有着重要影响。
微反应器是指内部结构的特征尺寸在亚毫米尺度的流体设备。 与传统反应器或反应技术相比,微反应器技术具有传质效率高、反应速率快、安全可控等优点[10]。
本论文探究了亚甲基蓝与硫酸亚铁混合液pH值、硫酸亚铁浓度、过硫酸钠浓度、进料流量、毛细管长度等对亚甲基蓝降解率的影响。 在微反应器中进行氧化降解有机物能强化氧化降解反应过程,提高氧化降解率。
1 实验材料与方法
1.1 实验试剂与仪器
试剂:亚甲基蓝[C16H18CIN3S·3H2O, methylene blue(MB)]购于天津市北联精细化学品开发有限公司, 过硫酸钠 [Na2S2O8, sodium persulfate(SPS)]、硫酸亚铁(FeSO4·7H2O)、甲醇(CH3OH,MeOH)、氢氧化钠(NaOH)和浓硫酸(H2SO4)均从国药集团化学试剂有限公司采购。 实验所用药剂均为分析纯。 实验用水为去离子水。
仪器:毛细管微反应器装置(江南大学机械工程学院自制)、精密电子天平(宁波市鄞州华丰电子仪器厂)、双通道注射泵(苏州汶颢微流控技术股份有限公司)、紫外可见分光光度计(日本岛津公司)、集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司)、实验室pH 计(梅特勒-托利多仪器(上海)有限公司)。
1.2 实验方法
1.2.1 反应液母液的配制
称取0.748 g(2 mmol)MB 粉末,加入去离子水定容至1 000 mL,配制成2 mmol·L-1的MB 母液并避光冷藏。 称取2.38 g(10 mmol)的SPS 粉末,加入去离子水定容至1 000 mL,配制成10 mmol·L-1的SPS 母液并避光冷藏。 硫酸亚铁(FeSO4)溶液在使用时现配。 量取300 mL 甲醇(MeOH),加入去离子水定容至1 000 mL,配制成30% MeOH 溶液并避光冷藏。
1.2.2 亚甲基蓝降解原理及方法
本实验采用FeSO4活化SPS 获得具有强氧化性的SO-4·,反应如式(1)所示。
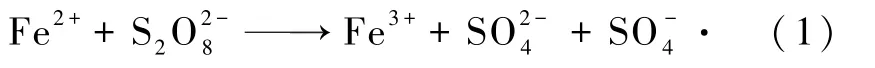
通过比较静置反应系统、磁力搅拌反应系统、毛细管微反应系统对MB 的降解效率确定最适宜MB与FeSO4混合液pH、FeSO4浓度和SPS 浓度,并在微混合方式下研究进料流量和毛细管长度对MB 降解率的影响。 以静置和磁力搅拌进行的研究均在磁力搅拌器中进行。 本研究中溶液浓度均为溶液混合之前的浓度且反应开始后溶液pH 值不再调整。
静置反应:先将10 mL 体积比为1 ∶1的MB 与FeSO4混合液倒入烧杯中,然后将10 mL 的SPS 溶液倒入烧杯,反应时间从开始倒入SPS 的瞬间开始计算。 在一定时间后倒入20 mL MeOH 溶液并同时开启磁力搅拌器加速终止氧化反应[11]。
磁力搅拌反应:先将10 mL 体积比为1 ∶1的MB与 FeSO4混合液倒入烧杯中并开启磁力搅拌器,搅拌转速为300 r·min-1。 然后将10 mL 的SPS 溶液倒入烧杯,反应时间从开始倒入SPS 的瞬间开始计算。 在一定时间后倒入20 mL MeOH 溶液以终止氧化反应。
毛细管微反应:使用注射器1 吸取10 mL SPS溶液使用注射器2 吸取10 mL MB 与 FeSO4的混合液。 打开注射泵,注射泵以一定的进料流量进行注射。 2 股液体汇入三通管道并进入内径为0.9 mm毛细管, 氧化降解反应开始。 当进料流量为1.13 mL·min-1(毛细管中流量为2.26 mL·min-1),毛细管长度(三通接头到毛细管出口的长度)为3.41 m 时,反应时间为1 min。 毛细管出口插入盛有20 mL MeOH 溶液的集液瓶底部以保证第一时间终止氧化反应。

图1 毛细管微反应器装置示意图Fig.1 Schematic of capillary microreactor
1.2.3 分析方法
亚甲基蓝浓度通过分光光度法测定。 使用胶头滴管吸取3.5 mL 降解后的液体于比色皿中,使用紫外可见分光光度计于最大吸收波长664 nm 处测定溶液吸光度,并根据MB 溶液标准曲线方程计算出MB 浓度。 由于降解前后溶液总体积发生了变化,所以本研究根据降解前后溶液中MB 含量计算降解率,并按式(2)计算MB 降解率η。

式(2)中:n0为降解前MB 的物质的量,mmol;n为降解后MB 的物质的量,mmol。
2 结果与讨论
2.1 亚甲基蓝标准曲线绘制
配制0.25 mmol·L-1的MB 标准溶液,分别在8只50 mL 容量瓶中加入1、2、3、4、5、6、8、10 mL 的标准溶液,然后加入去离子水稀释定容。 选择去离子水作为参比溶液,在最大波长664 nm 处测量其吸光度并绘制MB 溶液标准曲线如图2 所示。
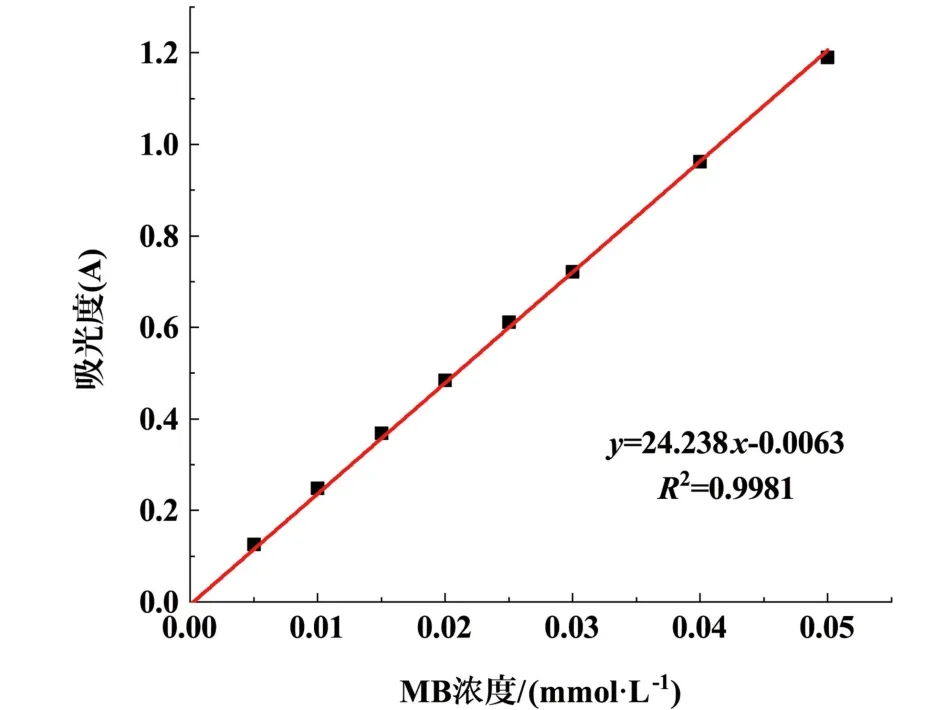
图2 MB 溶液标准曲线Fig.2 Standard curve of MB solution
2.2 MB 与FeSO4 混合液pH 值对MB 降解率的影响
MB 与FeSO4混合液的pH 值对MB 降解率的影响如图3 所示。 设定MB 的浓度为0.2 mmol·L-1,SPS 的浓度为1.0 mmol·L-1,FeSO4的初始浓度为1.0 mmol·L-1,反应温度为25 ℃,反应时间为1 min。毛细管微反应器中进料流量为1.13 mL·min-1,毛细管长度为3.41 m。 在静置反应系统、磁力搅拌反应系统和毛细管微反应系统中研究MB 与FeSO4混合液的pH 值对MB 降解率的影响。 由于Fe2+在碱性条件下易生成沉淀,消耗用于活化S2O2-8的部分Fe2+,所以调节溶液初始pH 值为 1、2、3、4、5、6和7。
从图3 可以看出MB 降解率随着pH 值的升高先增加后减少,当MB 与FeSO4混合液pH 值为3 时降解效果最好。 这是由于在pH 值过低的条件下,Fe2+以 [Fe(H2O)6]2+、 [Fe(H2O)6]3+、[Fe(H2O)5]2+等形水合物形式存在,可溶性Fe2+减少,不利于S2O28-活化生成SO-4·,而过高的H+浓度会加速SO-4·的产生,导致瞬时SO-4·质量分数过高而相互反应猝灭[如式(3)~(5)]。 当pH 值大于4时,溶液中的Fe2+易水解形成沉淀,阻碍Fe2+活化。 在MB 与FeS O4混合液pH 值为3 时,毛细管微反应系统相较于静置和磁力搅拌反应系统降解率分别高出5.14%和2.98%,原因在于毛细管微反应系统具有更快更强的传质效果,SO-4·更易氧化降解MB。
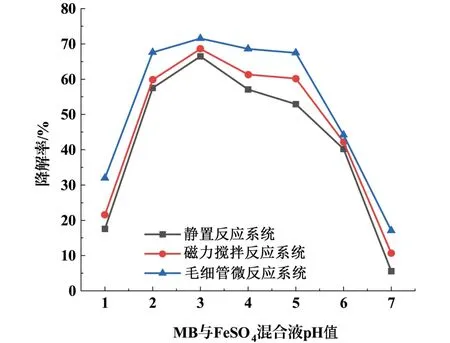
图3 MB 与FeSO4 混合液的pH 对MB 降解率的影响Fig.3 Influence of pH of the mixture of MB and FeSO4 on MB degradation rate

2.3 FeSO4 浓度对亚甲基蓝降解率的影响
FeSO4浓度对MB 降解率的影响如图4 所示。设定MB 的浓度为0.2 mmol·L-1,SPS 的浓度为1.0 mmol·L-1,调整FeSO4的浓度为0.2、0.6、1.0、1.4、1.8、3.0、5.0 mmol·L-1,调节MB 与FeSO4混合液的pH 值为3,反应温度为25 ℃,反应时间为1 min。毛细管微反应器中进料流量为1.13 mL·min-1,毛细管长度为3.41 m。 在静置反应系统、磁力搅拌反应系统和毛细管微反应系统中研究FeSO4浓度对MB降解率的影响。 如图4 所示,随着Fe2+浓度的增加,MB 降解率先升后降。 当Fe2+浓度为1.4 mmol·L-1时,在毛细管微反应系统中MB 降解效果最好,降解率相较于静置和磁力搅拌反应系统高出8.42%和5.28%。当Fe2+浓度过低时,SO-4·产率低。随着Fe-SO4浓度从0.2mmol·L-1增加到1.4mmol·L-1,活化产生的SO-4·数量不断增加,从而使得MB 降解率也不断升高。 随着Fe2+浓度从1.4 mmol·L-1进一步增加到5.0 mmol·L-1,多余的Fe2+将消耗SO-4·[如式(6)],因此MB 降解率也明显降低[12]。 随着Fe2+浓度的增加,毛细管微反应系统中MB 降解率与其他两种反应系统相差越来越小,这是因为在更快更强的传质反应系统中,Fe2+对SO-4·的消耗也更快。
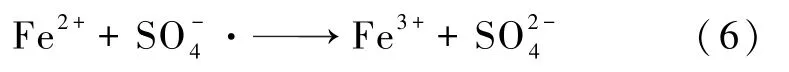
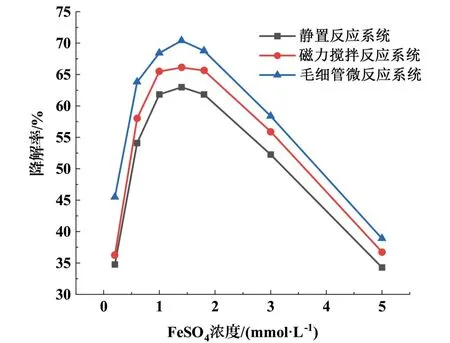
图4 FeSO4 浓度对MB 降解率的影响Fig.4 Influence of FeSO4 on MB degradation rate
2.4 SPS 浓度对MB 降解率的影响
SPS 浓度对MB 降解率的影响如图5 所示。 设定MB 的浓度为0.2 mmol·L-1,调整SPS 的浓度为0.2、0.6、1.0、1.4、1.8、3.0、5.0、10.0 mmol·L-1,Fe-SO4的浓度为1.4 mmol·L-1,调节MB 与FeSO4混合液的pH 值为3,反应温度为25 ℃,反应时间为1 min。 毛细管微反应器中进料流量为1.13 mL·min-1,毛细管长度为3.41 m。 在静置反应系统、磁力搅拌反应系统和毛细管微反应系统中研究SPS 浓度对MB 降解率的影响。 如图5 所示,当SPS 浓度从0.2 mmol·L-1增加到1.8 mmol·L-1时,Fe2+活化产生的SO-4·也逐渐增加,使得MB 降解率显著升高;当SPS 浓度从1.8 mmol·L-1增加到10.0 mmol·L-1时,由于S2O28-具有一定的氧化能力且Fe2+不足以活化过量的SPS,所以MB 降解率缓慢上升[13]。 当浓度从1.4 mL·min-1增加到2.2 mL·min-1时,由于毛细管微反应系统具有更高的传质效率,相较于静置和磁力搅拌反应系统更早达到平衡饱和趋势且当SPS浓度为1.8 mmol·L-1时,降解率分别高出3.30%和4.45%。 为了更加有效地利用SPS,确定其后续试验浓度为1.8 mmol·L-1。

图5 SPS 浓度对MB 降解率的影响Fig.5 Influence of SPS on MB degradation rate
2.5 进料流量对MB 降解率的影响
进料流量对MB 降解率的影响如图6 所示。 设定MB 的浓度为0.2 mmol·L-1,SPS 的浓度为1.8 mmol·L-1,FeSO4的浓度为1.4 mmol·L-1,调节MB 与FeSO4混合液的pH 值为3,反应温度为0、25、40 ℃,调整进料流量为1、2、3、4、5、6 mL·min-1,毛细管长度为3.41 m。 研究毛细管微反应器中进料流量对MB 降解率的影响。 如图6 所示,随着进料流量的不断增加,MB 降解率呈下降趋势。 当毛细管微反应器的水浴温度为0 ℃时,Fe2+与S2O2-8活性低,SO-4·产率较低,导致MB 降解率较低;当水浴温度为25 ℃时,Fe2+与S2O28-活性升高,MB 降解率有了明显的提升;当水浴温度升高至40 ℃时,不仅Fe2+与S2O28-活性升高,且S2O28-热解促进了MB 降解率的升高。 当进料流量为1 mL·min-1,反应温度为40 ℃时,MB 降解率为84.77%,比反应温度为0和25 ℃时,分别高了21.62%和7.26%;当进料流量为6 mL·min-1,反应温度为40 ℃时,MB 降解率为74.54%,比反应温度为0 ℃和25 ℃时,分别高了49.84%和29.87%。 从不同温度下MB 降解率下降的趋势可以看出,进料流量越大,温度对降解率的影响越大。
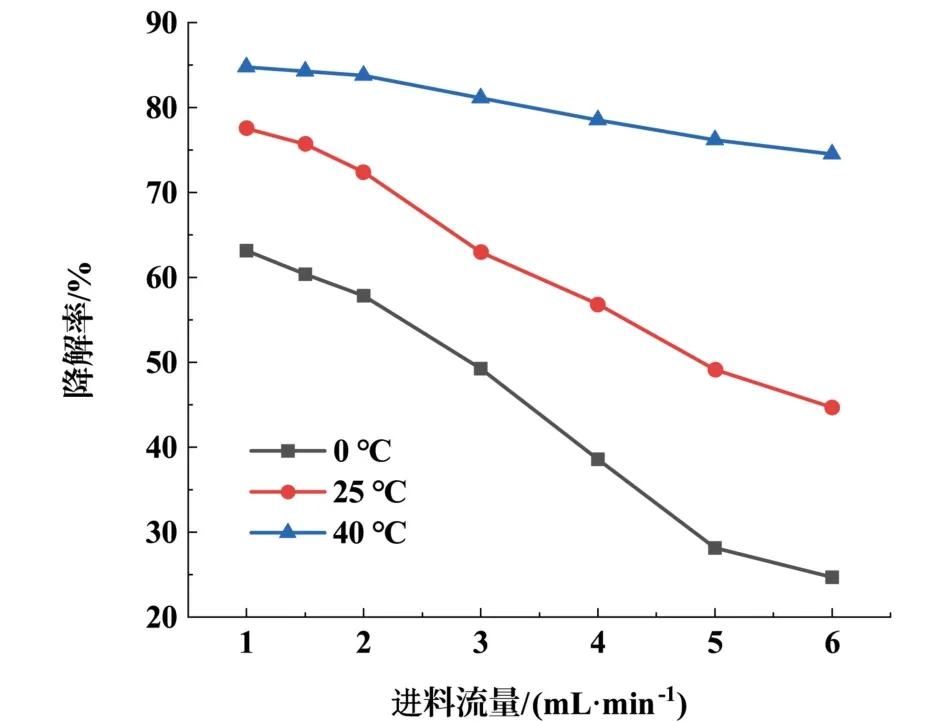
图6 进料流量对MB 降解率的影响Fig.6 Influence of feed flow rate on MB degradation rate
2.6 毛细管长度对MB 降解率的影响
毛细管长度对MB 降解率的影响如图7 所示。设定MB 的浓度为0.2 mmol·L-1,SPS 浓度的为1.8 mmol·L-1,FeSO4的浓度为1.4 mmol·L-1,调节MB 与FeSO4混合液的pH 值为3,反应温度为25 ℃,调整进料流量为1、3、6 mL·min-1,改变毛细管长度为1.47、2.44、3.41、4.38、5.35、6.32 m。 研究毛细管微反应器中毛细管长度对MB 解率的影响。 如图7 所示,随着毛细管长度的增加,在不同的进料流量下,MB 降解率均呈线性上升的趋势。 当进料流量为1 mL·min-1时,毛细管长度从1.47 m 增加到6.32 m 之后,MB 降解率从72.06%增加到85.92%,增幅为13.86%;当进料流量为3 mL·min-1时,MB降解率从54.07%增加到76.52%,增幅为22.45%。当进料流量为6 mL·min-1时,MB 降解率从33.44%增加到63.15%,增幅为29.71%。 从不同流量下MB 降解率上升的趋势可以看出,毛细管长度越长,流量对降解率的影响越突出。

图7 毛细管长度对MB 降解率的影响Fig.7 Influence of capillary length on MB degradation rate
3 结论
1)在各反应系统中,当MB 与FeSO4混合液的pH 值为3,MB 浓度为0.2 mmol·L-1,FeSO4浓度为1.4 mmol·L-1,SPS 浓度为1.8 mmol·L-1时,MB 降解效果最好。
2)在相同降解条件下,毛细管微反应系统的降解效果优于磁力搅拌反应系统和静置反应系统。
3)在毛细管微反应器中,进料流量越小,反应温度越高,毛细管长度越长,MB 降解率则越高。 在不同温度下,流量越大,温度对降解率的影响越大;在不同流量下,毛细管长度越长,流量对降解率的影响越小。

