用于分离酸性废液中铯的连续性循环系统
吕惠芸赵景宇焦 晗那 平
(天津大学化工学院,天津 300350)
核能的应用极大地缓解了化石燃料短缺的压力,但同时核电站产生的废弃物也带来了许多环境问题[1,2]。 铀、钚核裂变反应形成的放射性134Cs和137Cs 是核废料中主要的辐射和热源,其中137Cs 的半衰期较长,约为30 年[3]。 核事故释放出的这些放射性铯同位素会造成巨大的灾难,如1986 年的切尔诺贝利事件释放85 PBq137Cs、2011 年的福岛第一核电站泄漏释放1.2×1016Bq137Cs,严重危害着人类的生命安全[4]。 与60Co 和90Sr 等其他放射性元素相比,137Cs 是核废料中特别危险的污染物, 一方面137Cs 属于β 放射源,危害性较大,另一方面铯作为一种典型的碱金属元素,几乎所有的化合物都很容易溶于水[5,6],使137Cs 随地表水和地下水大面积传播,容易进入生物地球化学循环,威胁动物和人类。 然而,从另一个方面考虑,铯是制造真空部件、光电池和航天飞行器的重要材料之一。 因此,开发一种从放射性废液中回收铯的分离技术具有重要的技术和经济价值。
迄今报道了许多关于从水体中分离Cs+的材料及工艺,最常见的Cs+分离方法则是以蒙脱土、膨润土、亚铁氰化物和普鲁士蓝等作为Cs+吸附剂[7,8]的吸附法,该方法对Cs+具有良好的分离能力,但存在平衡时间长,且在Na+、K+和Mg2+等竞争离子存在时选择性差的问题,限制了其应用[9]。 此外,大部分高性能的Cs+吸附剂或多或少存在稳定性差或在酸性介质中的吸附能力降低[10,11]的问题,如层状金属硫化物吸附剂(KMS-1 和KMS-2)虽表现出极高的Cs+吸附能力(500 mg·g-1),但该材料在高酸性条件下几乎无Cs+吸附能力。 而在实际应用的回收钚铀的工艺中,Cs+被溶解在4~5 mol·L-1HNO3溶液中进行处理[12,13],这对Cs+分离剂提出了更高的要求。 因此,我们设计了一种在高酸环境下用于Cs+分离的工艺。
目前,多金属氧酸盐(POM)已表现出良好的酸稳定性,并已应用于核废料的Cs+分离,其中磷钼酸铵(AMP)[14]和磷钨酸盐(PTA)[15]的应用最为突出。 AMP 和PTA 是Keggin 结构,它们由1 个中心四面体(XO4:X 通常为P、Si 或Ge),被12 个MO6八面体包围(M 通常为Mo、W 或V),排列在4 组3边共享的M3O13中。 在Na+、K+和Mg2+存在的高酸性介质中,Cs+可以与PTA 等POM 分子结合形成稳定的不溶性物质从而实现铯的分离[16]。 然而,具有完整Keggin 结构的POM 分子,如12-磷钨酸分子只有3 个结合位点[PW12O40]3-,导致其对Cs+的分离能力较差[17,18]。 因此需要开发能够应用于高酸性体系中且具有更多Cs+结合位点的POM 材料以用于Cs+的分离富集。
电渗析技术具有高效、易操作、连续性好[19-21]等优点,被广泛应用于金属离子的富集分离领域[22]。 因此,为进一步提高Cs+分离富集的选择性和效率,本研究旨在将POM 材料与电渗析技术相结合,开发出一种可用于分离酸性废液中铯的连续性循环系统。
本研究主要针对回收U、Pu 过程中产生的放射性废液。 以秦山三期2 台重水堆计划利用回收铀替代天然铀作为反应堆燃料过程中产生的放射性废液为例,废液主要成分如表1 所示。 在该放射性废液中,因β 放射源放射性强、易进入皮肤,危害较大,因此,该类核素(37Cs、90Sr 和99Tc)为主要目标分离物和主要干扰物质。 由于Cs+为1 价阳离子、Sr2+为2 价阳离子、而Tc 的主要存在形式为TcO-4阴离子,因此,实现阴、阳离子及1 和2 价阳离子的分离能够有效地从该废液中分离出目标核素。 本研究通过水热法合成了具有不完全Keggin 结构POM 单元组成的POM 团簇,即Na[Co9-POM]材料,并将其作为Cs+捕获材料,与电渗析技术相结合,开发了一种连续电渗析富集分离技术(CEEST),以探究其Cs+分离和回收的能力。 该技术能够高效地降低核废水中放射性离子的浓度,并且能够将Cs+进行有效地分离与富集,无论是后期Cs+再次的提取利用还是经过固化后进行地质储存,该过程均具有较大的应用潜力。

表1 废液中核素组成与主要化学成分Table 1 Composition of nuclides and main chemical composition in waste liquid
1 实验部分
1.1 实验试剂
本研究使用的试剂主要包括:钨酸钠二水合物、冰醋酸(上海阿拉丁生化科技有限公司);无水磷酸氢二钠、醋酸钴、醋酸钠、硝酸铯(天津市科密欧化学试剂有限公司);以上试剂均为分析纯,无需进一步纯化。 1 价阳离子选择性渗透膜(日本ASTOM 公司),膜的主要特性如表2 所示。

表2 膜的特性Table 2 Characteristics of membranes
1.2 Na[Co9-POM]的制备
1.3 实验主要仪器及设备
X 射线衍射仪(XRD),D8 Advance 型 ,德国布鲁克AXS;场发射扫描电子显微镜-含能谱仪(SEMEDS),Su8010 型 ,日本日立公司;傅里叶变换红外光谱仪(FTIR),Bruker Tensor Ⅱ型,德国布鲁克AXS;X射线光子能谱仪(XPS),ESCALAB 250 XI,美国Thermo Fischer;电感耦合等离子体原子发射光谱仪(ICPOES),ICP 8000 型,美国Perkin Elmer;高精度直流稳压电源,TD1365 型,苏州特安斯电子有限公司;电热恒温干燥箱,UNE500 型,德国Memmert 公司。
1.4 铯离子的分离实验
电渗析分离系统的装置由H 型电解池(阳极室和阴极室)、铂电极和1 价阳离子选择性渗透膜(MCPM)组成,如图1 所示。 该电渗析分离体系下Cs+的分离过程步骤如下。 首先,在阳极室中加入50 mL 50 mg·L-1的硝酸铯(CsNO3)溶液,并加入0.75 mL 的饱和氯化钠(NaCl)溶液,以提高离子浓度。将所制备的Na[Co9-POM]材料溶解于水中获得浓度为2.5g·L-1的Na[Co9-OM]溶液,并取25mL 加入阴极室中。 其次,打开直流稳压电源,在电场力的作用下,Cs+从阳极室发生定向移动,通过MCPM 膜进入阴极室中,并与[Co9-POM]16-阴离子结合产生沉淀,Cs+在溶液中得到分离。 在实验过程中,按一定的时间间隔从阳极室中取2 mL 溶液。 在实验结束后,从阴极室底部收集沉淀(Cs[Co9-POM]),溶解于1 mol·L-1的NaOH 溶液中。 采用电感耦合等离子体原子发射光谱仪(ICP-OES)测定样品中Cs+的浓度。

图1 铯离子分离系统过程示意图Fig.1 Diagram of the separation process of Cs+
1.5 铯离子分离率和回收率的计算方法
该体系中Cs+的分离率按公式(1)计算:

式(1)中:Rs为分离率,C0为阳极室内Cs+的初始浓度,Ce为阳极室内Cs+的平衡浓度。
该系统中Cs+的回收率按公式(2)计算:

式(2)中:Rr为回收率,m0为Cs+的初始质量,mp为阴极室内沉淀中Cs+的质量。
1.6 影响因素实验
首先,对不同Na[Co9-POM]材料的分离及回收能力进行了比较。 其次,探究了不同恒流条件(0.01、0.03 和0.05 A)的影响,以确定合适的电源供应。 再次,为探索该体系的工业应用潜力,通过HNO3和NaOH 调节pH 值,研究pH=6~1 及1 mol·L-1HNO3的高酸环境,以及K+、Na+、Mg2+、Ca2+、Sr2+和Ba2+的存在对分离过程的影响。 最后,对该分离过程的连续操作能力进行了研究。 以上所有实验都基于1.4 节中提到的步骤进行。
我累得满头大汗,敲门后,开门的是她妈,我气喘吁吁地叫了句:“阿姨好!”紧接着双腿不听使唤,一下就跪在她妈面前……
2 结果与讨论
2.1 表征结果
2.1.1 SEM-EDS 及ICP-OES 分析
图2(a)~ 图2(d)是不同温度下的Na[Co9-POM]及分离Cs+过程中阴极室中所产生的沉淀物(Cs[Co9-POM])的扫描电镜图像。 图3(a)~图3(h)为Na[Co9-POM]-120 和Cs[Co9-POM]的mapping 元素分布及EDS 图。 2 种材料的ICP-OES 测试结果及EDS 分析结果的质量占比如表3 所示。

图2 SEM 图像Fig.2 SEM images
如图2(a)~图2(c)所示,随着水热温度的增加,材料结构由严重的团聚现象到呈现片状堆叠结构再到结构破碎团聚。 将结构较好的Na[Co9-POM]-120 材料进行mapping 元素分布及EDS 分析,如图3(a)~图3(f)所示,通过mapping 元素分布图可以看出材料结构的基本组成分为Na、Co、O、P 和W 5 种元素,且这5 种元素表现出相同的区域,图3 中点的密度较密集。 如表3,其EDS 结果中,Na、Co、P 和W 其质量比分别为6.17%、8.81%、2.79%和82.23%,之前的研究表明,其分子式为Na16[Co9(OH)3(H2O)6(HPO4)2(PW9O34)3],Na ∶Co ∶P ∶W 理论原子比例为16 ∶9 ∶5 ∶27[24]。 为了进一步确定合成Na[Co9-POM]材料的原子比,将材料溶解于0.1 mol·L-1HNO3并用电感耦合等离子体原子发射光谱仪(ICP-OES)测定其含量,通过结果分析得出其原子比约为16.2、9.1、4.9 和27.0,与理论分子式中的原子比例基本一致。 扫描电子显微镜、 EDS 能谱及ICP-OES 的分析结果说明实验成功地合成了Na[Co9-POM]。

表3 理论材料及实验材料的ICP-OES 和EDS 元素分析Table 3 Elemental analyses of ICP-OES and EDS for the theoretical and experimental materials

图3 (a)~(f)(Na[Co9-POM]的元素分布图;(g)Cs[Co9-POM]的元素分布图;(h)[Co9-POM]的EDS 图谱Fig.3 Elements mapping of(a)Na[Co9-POM];(b)O;(c)W;(d)Co;(e)Na,(f)P;(g)Cs in Cs[Co9-POM];(h)EDS pattern in Cs[Co9-POM] Elements mapping
如图2(d)所示,分离过程所产生的沉淀物颗粒变小,堆叠在一起产生团簇,因此后续从液体中分离该沉淀物以进行后处理是较为容易的。 此外,如图3(g)所示,mapping 元素分布图可以看出材料结构中Cs 分布的较为均匀且密集,与此同时,如图3(h)所示,通过EDS 图谱可以看出材料结构的基本组成分为Cs、Co、O、P 和W 5 种元素,其中出现了Cs 的峰,这说明了经电场力作用下Cs+发生了定向移动,成功的在阴极室内与阴离子[Co9-POM]16-作用产生沉淀物质,Cs+得到了分离。 此外,如表3,其EDS 结果中,Cs、 Co、 P 和 W 其质量比分别为 27.31%、6.79%、2.25%和63.65%。 为了进一步确定沉淀物Cs[Co9-POM]的原子比,通过ICP-OES 测定其含量,通过结果分析得出其原子比约为16.1、9.2、5.1和27.0。 值得注意的是,虽然阳离子由铯取代钠,但其阴离子原子种类和原子比并未发生变化,即POM 结构稳定存在于Cs+分离体系中。 以上的分析结果可以证实沉淀物为Cs[Co9-POM]。
2.1.2 XRD 分析
Na[Co9-POM]及Cs[Co9-POM]的XRD 图如图4 所示。 从图4 可以看出,随着水热温度从100 ℃到150 ℃不断升高,Na[Co9-POM]材料的特征峰强度不断加强,结晶程度加强。 同时,XRD 衍射图谱中Na[Co9-POM]-100、Na[Co9-POM]-120、Na[Co9-POM]-150 和Cs[Co9-POM] 的4 组衍射峰在2θ=6°~12°、17°~20°和26°~35°这几个范围内均有明显吸收,这与已报道的文献中POM 材料的XRD 图谱相符。 此外,Cs[Co9-POM] 样品在2θ=8° 左右出现了强度增大的衍射峰,这可能是因为Cs 取代Na后生成了新物质有关,与文献[24]报道的Cs[Co9-POM]的XRD 衍射峰位置相一致。

图4 XRD 图谱Fig.4 XRD patterns
2.1.3 FTIR 分析
Na[Co9-POM]及Cs[Co9-POM]的FTIR 图如图5 所示。 从图5 可以看出,对于Na[Co9-POM]-100、Na[Co9-POM]-120 及 Na[Co9-POM]-150,主要有以下几个吸收峰:3 429 cm-1为吸附水分子—OH 的伸缩振动[25],1 630 cm-1为水分子的羟基H—O—H的弯曲振动[26]。 此外,Na[Co9-POM]-100、Na[Co9-POM]-120 及 Na[Co9-POM]-150 在1 078、985、890和803 cm-1处均出现了4 个明显的吸收峰,这些吸收峰分别为样品的Oa—P、OdW、W—Ob—W 和W—Oc—W 特征峰[27]。 其中Oa、Od、Ob和Oc的位置分别标注在图6 的结构示意图中。 这些相同的特征峰表明了不同温度下合成的Na[Co9-POM]具有相同的POM 结构。

图5 FTIR 图谱Fig.5 FTIR spectra
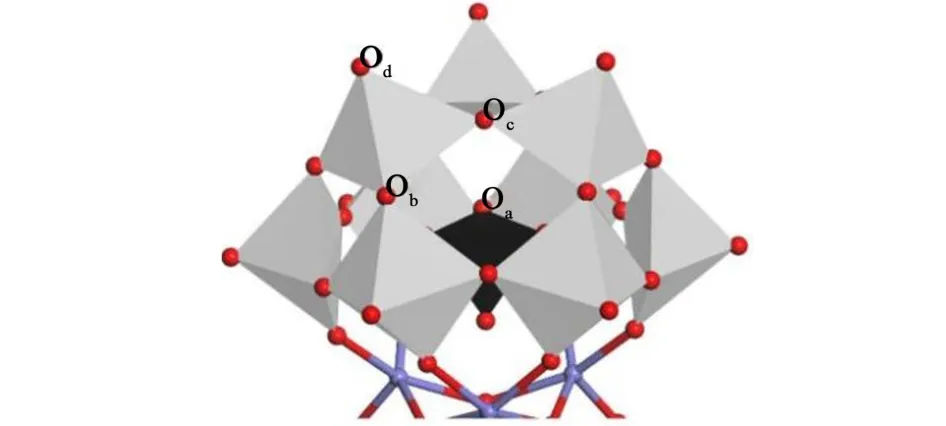
图6 Na[Co9-POM]的结构Fig.6 The structure of the Na[Co9-POM]
此外,对于Cs[Co9-POM],同样的3 429 cm-1位置为吸附水分子—OH 的伸缩振动,1 630 cm-1关于水分子的羟基H—O—H 的吸收峰发生了左移,说明其表面羟基的结构与Na[Co9-POM] 有所不同。1 413 cm-1处的吸收峰消失了,这进一步说明Na 被Cs 取代后样品的化学组成发生了变化。 但在1 078、985、890 和803 cm-1处均出现了4 个明显的吸收峰,并未发生变化,这些一致位置的吸收峰表明了Na[Co9-POM]和Cs[Co9-POM]中的POM 结构相同,在图5 红外吸收光谱图中所有样品均出现相同位置的Keggin 结构的特征峰,说明了Na[Co9-POM] 和Cs[Co9-POM]都存在Keggin 结构。
2.1.4 XPS 分析
Na[Co9-POM]的XPS 谱图如图7 所示。 图7(a)为合成材料Na[Co9-POM] 的全扫能量谱图,该图表明了Na[Co9-POM] 材料包括Na、Co、O、P 和W 元素,与 EDS 能谱分析结果相一致。 图7(b)为Co 2p 的XPS 能谱分析图。 如图7(b)所示,在781.1 eV 和797.6 eV 处出现了2 个主峰,其分别属于Co 2p3/2和Co 2p1/2。 与此同时,在786.1 和803.2 eV 处还观测到明显的低于主峰强度的卫星峰,即为Co 2p3/2和Co 2p1/2,这可以归因于原子中未配对的电子之间的耦合即多态分裂或者多电子的激发即振激峰[28]。 图7(b)结果说明了合成的材料中存在Co(Ⅱ)。 图7(c)为P 2p 的XPS 能谱分析图,从图7(c)中可以看出P 2p 的主要能量峰出现在133.7 eV。 此外,图7(d)为W 4f 的XPS 能谱分析图,其2 个能量峰分别出现在结合能为37.2 和35.1 eV 的位置,代表W 4f5/2和W 4f7/2,这2 处峰的出现证明了W(Ⅵ)的存在[29]。 这些元素特征峰的出现,进一步证实了材料Na[Co9-POM]的合成,与之前分析结果是一致的。 图7(e)为O 1s 的XPS 能谱分析图,可见O 1s 峰的结合能值均在781 eV 以上,未在位置529.8 eV 处出现特征峰,该结果与Co 2p 图谱共同证实了Na[Co9-POM] 不存在CoOx杂质。

图7 Na[Co9-POM]的XPS 谱图Fig.7 XPS survey spectra of Na[Co9-POM]
2.2 不同因素对铯离子分离实验的影响
2.2.1 不同材料的铯离子分离实验
在图8 中可以看出,在相同的分离电压下,3 种材料在150 min 左右的Cs+最大分离率均可达到99%以上,这说明在本研究所设计的电渗析分离系统中,能够成功地实现Cs+的高效分离。 此外,在图8 的3 条曲线中,Na[Co9-POM]-120 材料的Cs+分离率曲线上升速率最快,即在分离系统中阳极室内Cs+浓度下降最快,可以推断出Na[Co9-POM]-120材料对Cs+的捕获能力较强,该材料的Cs+分离能力最佳。

图8 Na[Co9-POM]-100、Na[Co9-POM]-120和Na[Co9-POM]-150 的铯离子分离率Fig.8 Separation ratio of Cs+with Na[Co9-POM]-100,Na[Co9-POM]-120, and Na[Co9-POM]-150
对于Cs+分离过程,我们不仅要关注阳极室内Cs+浓度的下降,同时也要关注阴极室内Cs+的回收。 为此我们探究了阴极室在300 min 后产生沉淀中Cs+的质量,并计算其回收率。 结果如图9 所示,3 种材料中Na[Co9-POM]-120 的回收率最高,达到95.5%。 由此结果可以看出Na[Co9-POM]-120 材料对于阴极室中的Cs+能够更快更多地捕捉固定,将体系中的Cs+大程度的分离回收,证明Na[Co9-POM]-120 材料是最适宜的Cs+捕获材料。 通过以上实验结果以及SEM 表征结果可知,较Na[Co9-POM]-100 和Na[Co9-POM]-150 的团聚结构,Na[Co9-POM]-120 呈现有缝隙的片状结构有利于Cs+的分离和回收。 综上所述,Na[Co9-POM]-120 表现出最佳的Cs+分离及回收能力,故我们选取Na[Co9-POM]-120 材料用于后续实验。

图9 铯离子回收率Fig.9 Recovery ratio of Cs+
2.2.2 电流的大小对分离过程的影响
为了探究不同的电流条件下Na[Co9-POM]-120 的Cs+分离率影响,在电渗析分离实验系统下,施加恒定电流0.01、0.03 和0.05 A 进行实验,对比其Cs+分离率的变化,以确定最适宜电流强度,其实验结果如图10 所示。 在图10 可以看出,随着电流强度的增加,Cs+的分离率逐渐增大。 当外加电流为0.01 A 时,Cs+分离率在150 min 后达到了最大值,约为86.2%。 当电流为0.03 和0.05 A 时,150 min后Cs+的平衡分离率分别达到96.5%和97.1%。 虽然0.05 A 的分离效率要略高于0.03 A,但考虑成本及节能的原则,我们最终选择最佳适宜电流保持在0.03 A 进行Cs+分离实验。

图10 Na[Co9-POM]-120 材料在不同恒流下铯离子的分离率Fig.10 Separation ratio of Cs+at different constant current with Na[Co9-POM]-120
2.2.3 pH 值对分离过程的影响
在实际工艺中,回收U、Pu 过程中产生的放射性废液均在HNO3介质中,且在该流程的后处理液中提取铯十分必要。 为探究本研究所获得的材料Na[Co9-POM]-120 在实际的放射性废液中提取铯的应用前景,故调节溶液pH 值范围为 6~1,以及1 mol·L-1HNO3的高酸环境,探究溶液pH 值对Na[Co9-POM]-120 的分离能力的影响,其实验结果如图11 所示。 我们可以看出,当pH 值从6 到1 的变化中,Cs+分离率从21.21%逐渐地提高到37.7%。当pH=1,以及在高酸性条件(1 mol·L-1HNO3)下,Cs+的分离率显著提高到96%以上。 Na[Co9-POM]-120 的分子结构为由3 个3/4 磷钨酸分子通过Co离子连接构成的杂多酸盐。 其分子的表面性质与磷钨酸分子较为接近,磷钨酸分子表面的H 位点相较于其他位点具有较高的活性[30,31],当溶液中的H+浓度升高时,材料表面会形成更多的H 位点,因此与Cs+的结合能力更强,其Cs+的分离率越高。 此外,相关文献表明,Na[Co9-POM]-120 材料在高酸性条件下具有较强的结构和电化学稳定性[24,32]。因此,Na[Co9-POM]-120 是一种稳定的具有良好耐酸性的Cs+分离材料,该分离系统有潜力应用于实际核工业中Cs+的分离和回收。
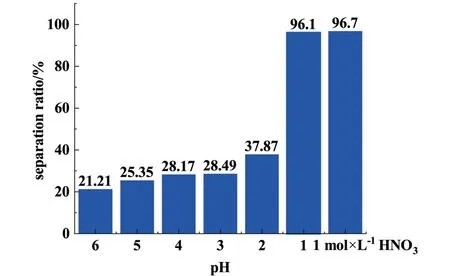
图11 Na[Co9-POM]-120 材料在不同pH 值下铯离子的分离率Fig.11 Separation ratio of Cs+at different pH with Na[Co9-POM]-120
2.2.4 共存离子对分离过程的影响
考虑到放射性废液中存在多种不同的离子,如K+,Na+,Mg2+,Ca2+,Sr2+和 Ba2+等,会影响Cs+的分离[33-35]。 故本实验将K+,Na+,Mg2+,Ca2+,Sr2+和Ba2+加入体系中,从而考察共存离子对Na[Co9-POM]-120 材料Cs+分离率的影响。 将其实验结果与空白组对比,以判断共存离子的影响程度。 其实验结果如图12 所示。 首先,当K+引入分离体系的溶液中时,Cs+的分离率从97%降低到72.02%,这是因为K+与Cs+同为1 价阳离子,其非常相似,所以少量的K+也会在阴极室中被Na[Co9-POM]-120 材料捕获,导致Na[Co9-POM]-120 材料被少量消耗,故Cs+分离率有所降低。 其次,由于所用的分离材料Na[Co9-POM]-120 中本身具备Na+,所以在体系中加入Na+对分离效果影响很小。 最后,因为电渗析分离系统采用的是1 价阳离子选择性渗透膜,可以排除大部分2 价金属阳离子Mg2+,Ca2+,Sr2+和Ba2+通过膜进入阴极室,故这些2 价离子的影响较小,分离率可达到87%以上。

图12 共存离子对Na[Co9-POM]-120 材料铯离子的分离率的影响Fig.12 Influence of coexisting ions on separation ratio of Cs+with Na[Co9-POM]-120
2.3 连续循环的铯分离系统
针对以上的Cs+电渗析分离体系的探究,为了提高系统的实际应用,我们提出了连续性的循环Cs+分离体系。 该体系的组成如图13,系统可分为废水循环系统、电渗析系统和固液分离系统3 个部分。 该综合系统有很多优势:1)连续循环Cs+分离系统开始运行时,废水可以形成稳定的循环系统,更多的废水可以通过该循环系统一起处理,Cs+不断迁移以达到分离。 2)电渗析系统与1 价阳离子选择性渗透膜相结合,可以在电场力作用下实现Cs+的选择性分离。 3)阴极室内固液分离能有效降低Cs+浓度,不断维持浓度差,从而增强分离反应的进行。 4)沉淀所产生的铯盐更容易被收集并利用少量碱性溶液(NaOH 溶液)再溶解,从而实现铯的富集。 总体而言,该连续循环的铯分离系统对放射性废液中的低浓度Cs+进行了富集和分离,在核工业中具有很大的应用潜力。

图13 连续循环的铯分离系统Fig.13 Continuous circulation cesium separation system
3 结论
通过水热法成功地制备了Na[Co9-POM]材料。通过SEM、XRD、FTIR 及XPS 表征分析其多金属氧酸盐分子式为Na16[Co9(OH)3(H2O)6(HPO4)2(PW9O34)3],证明了Na[Co9-POM]材料具备Keggin 结构,且其阴离子[Co9-POM]16-与Cs+相结合产生沉淀物Cs[Co9-POM]进而实现分离。 当水热温度为120 ℃所制备的Na[Co9-POM]-120 材料体现出最佳的Cs+分离和回收能力,在电流为0.03 A 时150 min 可达到96.5%左右的Cs+分离率。 在pH<1的高酸环境下,Cs+分离率仍可以达到96%以上;共存离子存在时,Na[Co9-POM]-120 表现出较好的分离能力。 该材料具有较好的耐酸性及选择性,可用于核工业回收U、Pu 过程所产生的放射性废液中铯的处理。 通过连续循环分离系统对放射性废液中Cs+进行处理,可以实现Cs+的分离和富集,在核工业中具有良好应用前景。

