TNFRSF10D在胶质瘤中的表达及其与免疫细胞浸润的关系
任秀芳,刘佳妹,亢野,关晓娇,杨向红
(中国医科大学附属盛京医院病理科,沈阳 110004)
胶质瘤是最常见的颅内原发性恶性肿瘤,来源于神经系统胶质细胞和神经元细胞,约占颅内肿瘤的50%~60%,侵袭和复发率明显高于其他颅内肿瘤[1]。目前针对胶质瘤的治疗方式以最大安全范围的手术为主,术后联合放疗和化疗,但患者的预后很差[2],中位生存期仅14.6个月[3],5年生存率不足10%[4]。根据癌症基因组图谱(The Cancer Genome Atlas,TCGA)基因表达数据,将胶质瘤分为前神经元亚型、神经元亚型、经典型和间质亚型[5]。目前,胶质瘤的发生与发展机制尚未明确,进一步挖掘极具预后价值的关键基因将为胶质瘤的预后评估与治疗提供潜在靶点。
肿瘤坏死因子受体超家族(tumor necrosis factor receptor superfamily,TNFRSF)10D,又称肿瘤坏死因子相关凋亡诱导配体受体4(tumor necrosis factorrelated apoptosis inducing ligand-receptor 4,TRAIL-R4)或诱饵受体2(decoy receptor2,DcR2),作为TNFRSF的一员,通过与肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor-related apoptosis inducing ligand,TRAIL)的结合和(或)与TRAIL-R1/-R2 的相互作用,负向调节TRAIL诱导的细胞凋亡[6-7]。作为诱饵受体,TNFRSF10D可在细胞内、外自主发挥作用,影响肿瘤微环境中其他细胞对TRAIL诱导的细胞凋亡的敏感性[8]。目前,尚未见有关TNFRSF10D与胶质瘤临床病理特征及免疫微环境细胞之间的关系的报道。本研究拟利用生物信息学及免疫组织化学法探讨TNFRSF10D基因表达与胶质瘤组织病理特征和患者预后的关系,及其在胶质瘤微环境中的作用。
1 材料与方法
1.1 数据收集
通过TCGA(https://portal.gdc.cancer.gov/)和中国脑胶质瘤基因组图谱(Chinese Glioma Genome Atlas,CGGA,http://www.cgga.org.cn/)下载RNA-Seq表达谱数据及相关临床信息。去除数据不完整的样本,最终纳入分析病例共 946例,其中CGGA 310例,TCGA 636例。
1.2 方法
1.2.1 评估不同胶质瘤组织中TNFRSF10D的表达情况:在数据库中收集数据,按世界卫生组织(World Health Organization,WHO)分级、病理分型、TCGA分型及分子分型不同,比较TNFRSF10D的表达情况。
1.2.2 评估TNFRSF10D基因表达对胶质瘤预后的影响:以中位数为界限,按照TNFRSF10D基因表达水平进行分组,其中,≥TNFRSF10D中位表达水平者为高表达组,<TNFRSF10D中位表达水平者为低表达组。用Kaplan-Meier 生存分析曲线及log-rank检验方法,比较2组的预后。通过Cox回归分析进一步检测TNFRSF10D不同表达水平患者的预后情况。
1.2.3 基因本体(gene ontology,GO)分析和基因集富集分析(gene set enrichment analysis,GSEA):通过Metascape(http://metascape.org/)进行GO分析,选择在CGGA数据库中与TNFRSFI0D基因表达相关性>0.4 的基因进行GO分析。使用GSEA(http://www.broadinstitute.org/gsea/index.jsp)确定TNFRSF10D不同表达水平患者间的差异表达基因是否有统计学意义,使用标准化富集得分(normalized enrichment score,NES)和错误发现率(false discovery rate,FDR)确定统计显著性。
1.2.4 评估TNFRSF10D在不同级别、免疫评分、基质评分和肿瘤纯度胶质瘤中的表达情况:在CGGA和TCGA数据库中,分析不同级别胶质瘤中TNFRSF10D表达水平与免疫评分、基质评分和肿瘤纯度的关系。
1.2.5 CIBERSORT算法分析免疫细胞构成:将欲分析的胶质瘤mRNA数据上传至CIBERSORT(https://cibersort.stanford.edu/),利用网页分析工具进行分析,获得22种免疫细胞数据,过滤去除不符合要求的样本后做可视化。进而比较TNFRSF10D高表达组与低表达组免疫细胞的差异。
1.2.6 TNFRSF10D在不同级别胶质瘤中的表达情况:收集中国医科大学附属盛京医院病理科手术切除的胶质瘤石蜡标本共60例,其中30例为低级别胶质瘤,30例为胶质母细胞瘤。采用免疫组化SP法染色,比较TNFRSF10D在胶质母细胞瘤和低级别胶质瘤中的表达情况。石蜡标本切片(厚度5 μm),烤片后经二甲苯脱蜡,梯度乙醇脱水,PBS反复冲洗,抗原修复,加入TNFRSF10D抗体(稀释1 ∶400,中国Proteintech公司,货号16781-1-AP)孵育,DAB显色。显微镜下每张切片随机选取5个高倍视野(×400),TNFRSF10D的表达水平依据其在细胞膜及细胞质的染色情况判定。本研究获得我院医学伦理委员会审查批准(伦理编号:2022PS001K)。
1.3 统计学分析
采用R语言4.0.1版本进行统计分析并作图。采用Pearson相关分析评估不同指标与TNFRSF10D表达的相关性。采用Student’st检验行组间连续变量的比较,采用χ2检验行组间率的比较。检验水准α=0.05。
2 结果
2.1 TNFRSF10D表达与胶质瘤恶性程度正相关关系
对CGGA及TCGA数据库收集的946例胶质瘤数据进行分析,发现TNFRSF10D表达水平随着胶质瘤级别的增高而增高(图1)。在不同WHO分型及病理分型胶质瘤中,WHO Ⅳ级胶质母细胞瘤中TNFRSF10D表达水平最高。在不同TCGA分型胶质瘤中,间质型胶质瘤TNFRSF10D表达明显高于其他分型。在不同分子分型胶质瘤中,胶质母细胞瘤IDH野生型TNFRSF10D表达水平较高。说明TNFRSF10D的表达与胶质瘤的恶性程度相关(图2)。
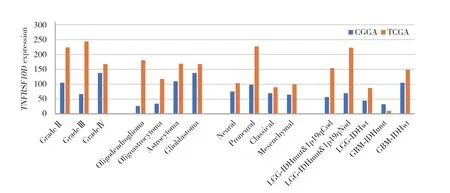
图1 数据库资料收集结果Fig.1 Database data collection
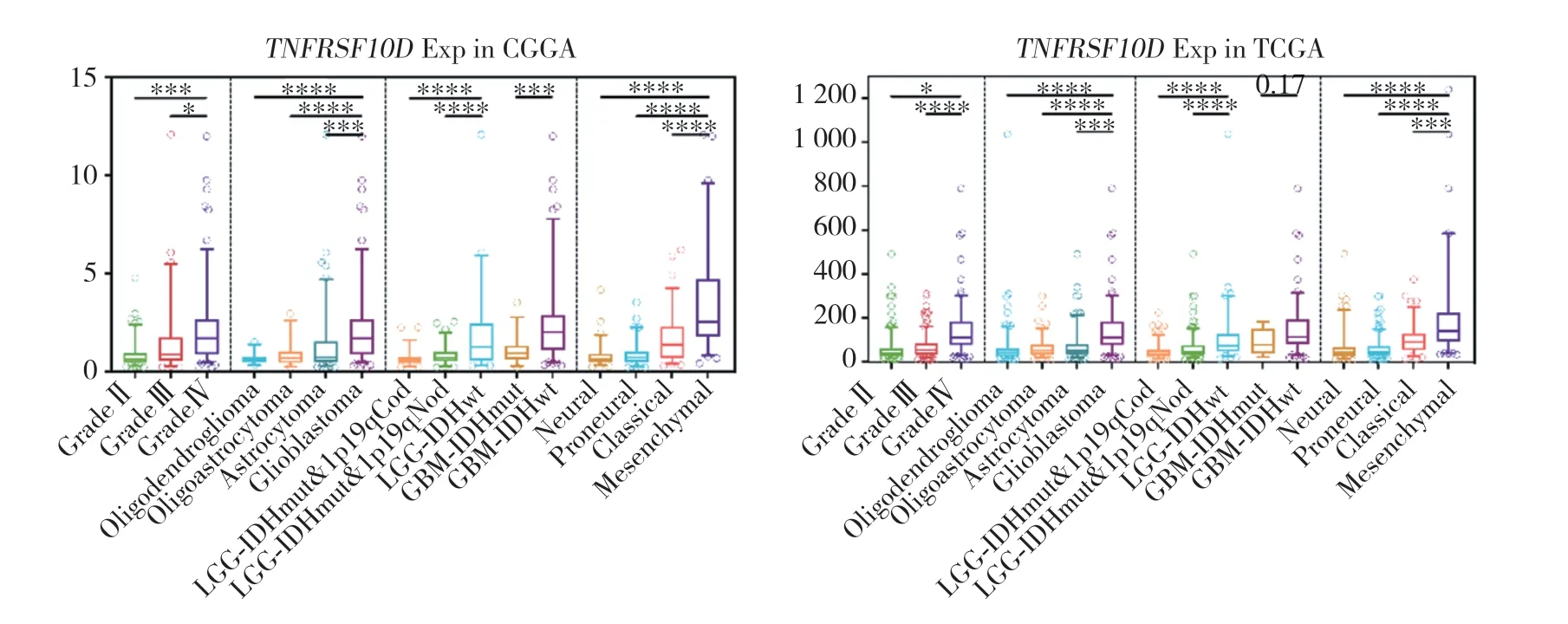
图2 TNFRSF10D的表达与胶质瘤患者临床病理特征的关系Fig.2 The relationship between the expression of TNFRSF10D and the clinicopathological characteristics of glioma patients
2.2 TNFRSF10D的表达水平与胶质瘤患者预后的
Kaplan-Meier生存分析结果提示,在全级别胶质瘤中,TNFRSF10D高表达的患者预后较差,这种差异在低级别胶质瘤和胶质母细胞瘤中均存在(图3)。单因素Cox回归分析结果提示,TNFRSF10D可能是胶质瘤的预后因素(表1)。以上结果提示TNFRSF10D高表达可导致胶质瘤患者的不良预后。

表1 胶质瘤患者临床特征和TNFRSF10D基因表达水平对预后影响的 Cox 回归分析Tab.1 Cox regression analysis of clinical characteristics and TNFRSF10D gene expression level on prognosis of glioma patients
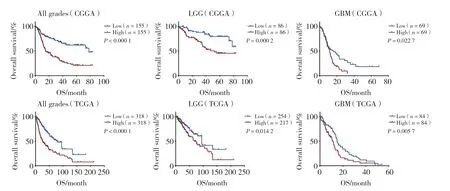
图3 TNFRSF10D的表达与胶质瘤患者预后的关系Fig.3 The relationship between the expression of TNFRSF10D and the prognosis of glioma patients
2.3 TNFRSF10D相关的GSEA富集分析
选择在CGGA数据库中与TNFRSF10D基因表达相关性0.4以上的基因进行功能富集分析,发现TNFRSF10D与多种免疫相关通路关系密切(图4)。GSEA进一步证实,CGGA和TCGA数据库中TNFRSF10D高表达患者的免疫相关基因呈高活化状态(图5)。说明TNFRSF10D可影响胶质瘤发生发展中的免疫过程。

图4 TNFRSF10D与多种免疫相关通路关系密切Fig.4 TNFRSF10D is closely related to multiple immune-related pathways
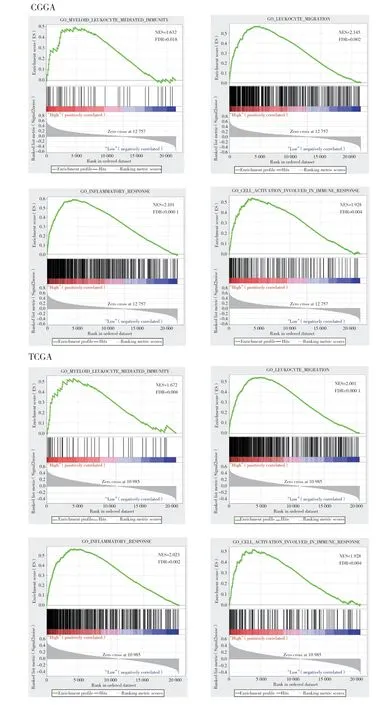
图5 高表达TNFRSF10D的患者中高活化状态的免疫相关基因Fig.5 Immune-related genes with high activation status in patients with high TNFRSF10D expression
2.4 不同级别胶质瘤中TNFRSF10D表达水平与免疫评分、基质评分和肿瘤纯度的关系
为了进一步探究TNFRSF10D表达对胶质瘤免疫微环境内细胞构成的影响,本研究对比分析了不同级别胶质瘤中TNFRSF10D高、低表达组的免疫评分、基质评分及肿瘤纯度。结果发现,TNFRSF10D高表达组免疫评分及基质评分均升高,而肿瘤纯度降低,且这种趋势在不同级别内均存在。说明TNFRSF10D的表达水平可影响胶质瘤免疫微环境中免疫细胞的构成。
2.5 肿瘤内免疫细胞构成分析
用CIBERSORT算法对胶质瘤肿瘤内22种免疫细胞构成进行分析,发现TNFRSF10D的表达与巨噬细胞的富集具有较强的相关性,说明其可能对巨噬细胞的影响最多。
2.6 免疫组化结果
免疫组化染色结果显示,TNFRSF10D定位于细胞质或细胞膜。与低级别胶质瘤相比,TNFRSF10D在胶质母细胞瘤中呈高表达(图6)。

图6 TNFRSF10D在低级别胶质瘤及胶质母细胞瘤中的表达情况 SP法×200Fig.6 Expression of TNFRSF10D in low-grade gliomas and glioblastoma SP ×200
3 讨论
TRAIL/Apo2L是肿瘤坏死因子超家族(tumor necrosis factor superfamily,TNFSF)的成员之一。TNFSF的成员通过其相应的TNFRSF发出信号[9]。TRAIL可以选择性地诱导癌细胞死亡,因此成为一种潜在的癌症治疗方法。TNFRSF10D作为TRAIL的一种诱饵受体,参与致癌作用信号级联反应,促进肿瘤细胞增殖与分化[10]。目前,TNFRSF10D已被认为是癌症中TRAIL抗性的一种机制,如在结直肠癌细胞株、宫颈癌及淋巴瘤组织中TNFRSF10D高表达与对靶向TRAIL通路治疗的抗性有关[11-12]。TNFRSF10D除能抑制TRAIL介导的细胞凋亡,还可诱导非凋亡信号通路,如核因子κB(nuclear factor kappa-B,NF-κB)和蛋白激酶(protein kinase,AKT),从而发挥其促肿瘤功能[13-14]。因此,本研究对TNFRSF10D在胶质瘤中产生的影响进行了探讨。
由于大脑独特的结构特征和免疫微环境,为脑肿瘤的治疗带来巨大挑战。脑肿瘤免疫微环境(tumor immune microenvironment,TME)由不同细胞组成,包括成纤维细胞、内皮细胞和免疫细胞等。而在众多免疫细胞中,巨噬细胞最为丰富[15]。肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)在肿瘤刺激下可产生免疫抑制,从而维持基因不稳定性,支持癌症干细胞,促进上皮向间充质转化,并通过免疫检查点配体的表达抑制适应性免疫,促进肿瘤细胞生长和T细胞凋亡,且癌症干细胞可为TAMs促进肿瘤发生提供关键促肿瘤信号[16-17]。由于TAMs主要来源于骨髓单核细胞,小鼠的原发性和转移性肿瘤模型研究[18]发现肿瘤细胞可募集单核细胞释放的炎症信号,并分化为TAMs,促进肿瘤进展。然而,在胰腺癌和胶质瘤中,TAMs也可源自胚胎阶段卵黄囊发育的红细胞-髓样祖细胞,TME会促进这些祖细胞分化为新的肿瘤相关表型,但通常是促肿瘤表型[19-20]。在胶质母细胞瘤中,胶质瘤干细胞通过TAMs分泌的骨膜蛋白,从外周血募集单核细胞衍生的巨噬细胞诱导M2型TAM极化,进而促进胶质母细胞瘤恶性生物学行为的发生[21-22]。
本研究首次在胶质瘤患者队列中分析了TNFRSF10D基因的表达,利用临床信息和 RNA测序数据研究了TNFRSF10D基因表达与胶质瘤分级预后的关系,并分析了TNFRSF10D基因表达水平与免疫细胞浸润的相关性,及其对胶质瘤免疫微环境细胞构成的影响。
本研究结果显示,TNFRSR10D基因的表达水平随胶质瘤级别增高而增高(P<0.000 1),在胶质母细胞瘤中表达水平最高。生存分析结果表明,TNFRSF10D基因的表达水平与胶质瘤患者的预后有关,TNFRSF10D高表达患者的预后不良。单因素Cox回归分析显示,TNFRSF10D基因表达水平是胶质瘤患者预后的独立危险因素(HR=1.214/1.001,P<0.000 1)。
本研究还发现,胶质瘤组织中TNFRSF10D基因表达水平与胶质瘤的肿瘤纯度呈负相关,与免疫评分及基质评分呈正相关。胶质瘤的特点是高度的肿瘤间和肿瘤内异质性,精准的免疫治疗至关重要,寻找合适的靶标非常关键。TAMs是TME中最丰富的免疫细胞,可占肿瘤实体的50%[23],参与恶性肿瘤进展和转移的肿瘤微环境的重要组成部分。TAMs作为TME中最关键的先天性免疫细胞,通过分泌多种细胞因子、生长因子、炎症底物和蛋白水解酶,在调节肿瘤生长、转移、复发、血管形成、细胞外基质重塑、抗肿瘤适应性免疫等方面发挥重要作用[24]。本研究还发现TNFRSF10D的表达与巨噬细胞的富集呈较强的相关性,说明其有可能成为肿瘤免疫治疗潜在的生物标志物。
综上所述,TNFRSF10D表达水平是胶质瘤患者预后的潜在分子标志物。TNFRSF10D表达与胶质瘤的恶性程度密切相关,是胶质瘤患者预后不良的指标,可影响胶质瘤的免疫过程及免疫微环境内的细胞构成,尤其是巨噬细胞。TNFRSF10D作为胶质瘤患者的独立预后因素,有可能成为未来胶质瘤免疫治疗的一个新方向。

