3.0T MR小视野扩散加权成像联合68Ga-PSMA-11 PET-CT对前列腺癌的诊断价值
杜 红 张 勇 马铭婕
前列腺癌发生在上皮细胞,多发于中年老男性人群。由于近年来前列腺癌患者逐渐增多,对男性身体健康造成严重危害。故早期发现前列腺癌并准确分期对提高患者预后具有重要价值[1]。MRI为前列腺有效检查方法,常规MRI对鉴别前列腺癌良恶性有一定困扰。基于常规DWI发展的扩散加权成像(diffusion-weighted imaging,DWI)不仅可反映组织水分子扩散情况,还能反映其灌注信息,为诊断鉴别疾病提供更多参考依据而广泛应用于临床[2-3]。前列腺常规视野DWI具有严重磁敏感伪影、易变形且分辨率低等不足,干扰疾病诊断结果;小视野(reduced field-of-view,rROV)DWI通过二维选择激励射频对兴趣区小范围激发,序列图像变形程度较小,伪影更少,能提高病灶清晰度,将其应用于DWI中能提高诊断效能,但该方式缺乏统一诊断阈值[4]。前列腺特异膜抗原(prostate specific membrane antigen,PSMA)为一种靶分子,在前列腺癌诊断中受到较多关注。68Ga为靶向PSMA良好的PET/CT显像剂,具生物分布良好,对前列腺癌的亲和性较高,具有广泛应用前景[5]。68Ga-PSMA-11 PET/CT对前列腺癌复发、转移有良好探测价值,广泛用于前列腺癌诊断与分期[6]。本研究将3.0T MR FOCUS技术与68Ga-PSMA-11 PET/CT方式联合对前列腺癌进行诊断,观察其诊断效能以为临床疾病诊断治疗提供参考依据。
1 资料与方法
1.1 一般资料
选取2019年7月至2021年2月收治的246例在我院行检查疑似前列腺癌患者。纳入标准:接受DWI与PET-CT检查,且无禁忌症;两项检查间隔在15 d内;检查后经手术或穿刺活检进行病理检查;签署知情同意书。排除标准:确诊前列腺癌患者;两项检查时间间隔过长;无法获得病理结果患者。研究最终纳入90例患者,年龄为48~76岁,平均(65.18±9.06)岁。
1.2 仪器与方法
DWI检查方法[7]:采用3.0 T MR扫描仪(美国GE公司,型号 SIGNA Pioneer)及多通道AA线圈。检查前清洁肠道,嘱咐患者适度充盈膀胱,躺于扫描床上取仰卧位,盆腔位于线圈中,将线圈中心与耻骨联合上方对准,扫描序列:横断为脂肪抑制T2WI参数:TE、TR、FOV分别为81 ms、6942 ms、260×260 mm;大范围横断位T1WI参数:TE、TR、FOV分别为8.9 ms、641 ms、400×400 mm;横断位rFOV DWI(FOCUS)参数:层厚及层间隔分别为3 mm、1 mm,FOV和矩阵分别为240×120 mm、160×80,b值800 s/mm2,激励次数为16,采集时间3 m 58 s。
PET/CT检查方法[8]:PSMA-11来源于德国ABX公司,通过自动化标记模板(德国ITG公司)自行合成68Ga-PSMA-11,制作过程参考Ⅳ类实验室标准,合成流程详见实验研究。产物放化纯>99%,为患者静脉注射80~343MBq68Ga-PSMA-11,并嘱咐其多饮水、排尿,1 h后行PET/CT显像(来源于上海联影,型号uMI780),由患者颅顶向大腿根部进行扫描,PET每3 min采集1个床位,共采集4个;CT扫描参数(电压、电流、层厚分别为130 kV、80 mA、3 mm)。校正CT数据后迭代重建图像数据,于工作站将PET与CT图像进行融合。
1.3 影像学分析
将DWI扫描的数据传入工作站,完成数据和图像重建;由2名磁共振医师对图像进行分析,癌灶区确定以病理结果作为依据,结合T2WI、ADC图像,于DWI图中勾画感兴趣区(region of interest,ROI),避开血管、尿道、精囊腺等区域选取,防止常出现偏差,记录不同部位ADC值,重复测量2次取其平均值,确保数据准确性[9]。2名医师盲审PET显像结果,分析面积最大显像剂浓聚灶,ROI测定最大标准摄取值(maximum standardized uptake value,SUVmax)[10]。4名医师对比MRI与PET病灶,当出现不一致意见时共同商讨达成一致,确定纳入研究病灶区域,计算SUVmax/ADC比值,可减少两种方法检测结果误差出现的误诊率。
1.4 统计学方法
2 结果
2.1 病理结果
患者两项检查后经病理检查确诊49例前列腺癌,41例前列腺增生。
2.2 两种检查的图像显示
典型前列腺癌MRI表现为T2WI中央腺体或外周带区低信号变化,ADC图的信号降低,见图1;68Ga-PSMA-11 PET/CT显像为中高程度放射性浓聚,见图2。前列腺增生显示中央带、移行带的体积变大,前纤维肌质与外周带区受压变薄,T2WI与ADC图见高低混杂信号影,见图3;68Ga-PSMA-11 PET/CT显像轻度不均匀或无放射性浓聚,见图4。

图1 前列腺癌T2WI与ADC图像
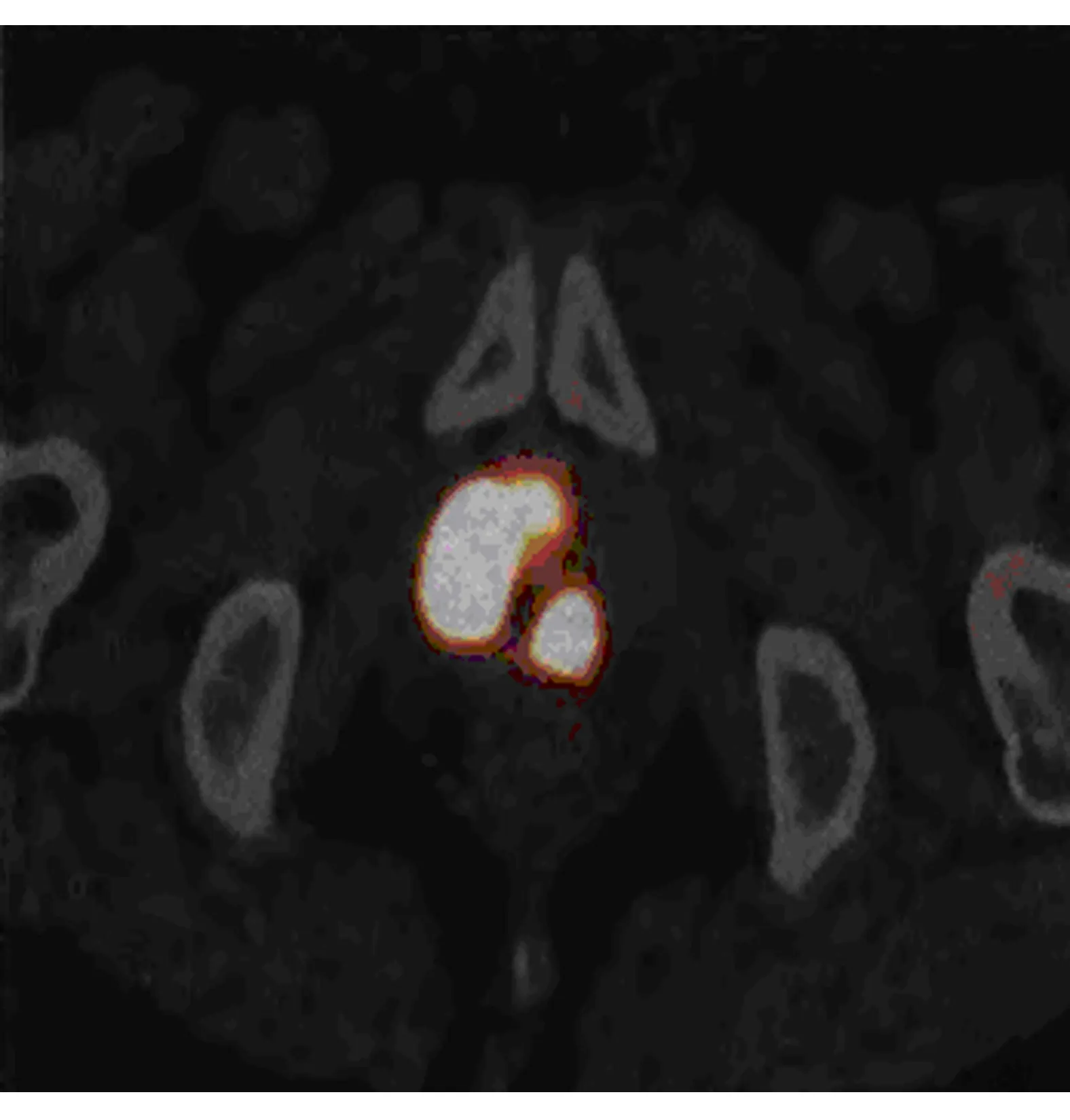
图2 前列腺癌PET显像
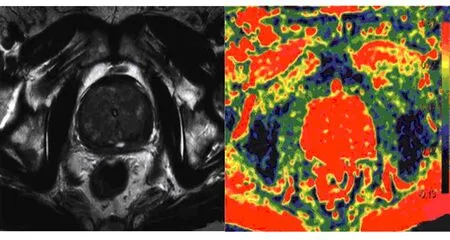
图3 前列腺增生T2WI与ADC图像

图4 前列腺增生PET显像
2.3 两种检查对前列腺良恶性检查指标比较
前列腺增生的ADC值、SUVmax、SUVmax/ADC分别为(1.24±0.28)×10-3mm2/s、5.86±2.71、5.41±3.80,前列腺癌分别为(0.88±0.23)×10-3mm2/s、16.63±9.67、22.73±18.21,前列腺癌的ADC值低于前列腺增生,SUVmax、SUVmax/ADC高于前列腺增生(P<0.05)。见表1。

表1 前列腺良恶性ADC值、SUVmax、SUVmax/ADC比较
2.4 ADC值、SUVmax、SUVmax/ADC诊断效能
经ROC曲线分析,ADC值的AUC为0.809,SUVmax为0.841,SUVmax/ADC为0.883;ADC值诊断灵敏度为83.7%、特异度为75.6%,SUVmax为85.7%、82.9%,SUVmax/ADC为77.6%、92.7%,SUVmax/ADC比值诊断效能优于两者单独诊断,见表2,图5。

表2 诊断效能

图5 ROC曲线分析
3 讨论
前列腺癌发生过程复杂,目前认为该肿瘤是遗传与表观遗传机制共同作用,其中干细胞、非编码RNA等表观遗传修饰、肿瘤免疫在肿瘤发生发展中发挥作用。前列腺癌发病率在不同地区有差异,欧美国家的发病率最高。随着近年来生活水平与诊断能力显著提高,前列腺癌在我国发病逐渐上升。前列腺癌早期诊断筛查对患者及时治疗病提高预后具有重要价值[11]。DWI是基于组织细胞间水分子布朗运动理论发展的成像技术,能检测组织含水量及生理学变化。观察水分子扩散运动以判断组织中微观结构而企业这边,水分子活动受限可显示出信号增强,反之信号减弱。不同组织、病变程度的水分子扩散情况不一,T2WI、b值、设备和场强均能影响DWI图像质量。ADC图是由≥2个b值DWI信号获取的图像,对应ADC值以灰度形式表示。MRI为目前临床诊断与评估前列腺癌最准确且常用的影像方法,DWI对机体无创伤性,为前列腺癌诊断重要技术,广泛应用于临床[12]。传统单次扩散加权成像为常用扩散加权成像序列,但对运动伪影较为敏感,以产生严重变形与图像模糊,图像质量不佳。传统成像序列对ADC值测量不精确,故减少DWI图像伪影对定性评估肿瘤组织极为重要。FOCUS一定程度能减少磁敏感、化学移位伪影,使病变部位的图像显示更清晰。 FOCUS序列联合射频脉冲高选择激发扫描视野中的组织信号,扫描视野外的组织信号可不被激发,但该方式的缺点为ROI边缘周围相邻层面组织信号下降[13]。ADC值可反映血管生成与组织细胞密度,有助于鉴别癌症良恶性,但并不是对所有疾病都适用。由于人体组织水分子的扩散运动较为复杂,单纯用ADC值表示扩散程度可能存在误差。本研究中前列腺癌组织ADC值比前列腺增生组织低,该结果可能是前列腺组织取代正常腺管与腺上皮,体积变小、细胞核增大、细胞间排列紧密缺少说分,使水分子扩散受限。
PET可定量对肿瘤生物学进展进行评估,目前有一些前景较好的示踪剂用于评估前列腺癌,常用有18F-FDG、11C-choline及给予PSMA的示踪剂。18F-FDG能反映肿瘤代谢情况,对诊断鉴别良恶性肿瘤有良好作用[14-15]。由于多数前列腺原发病灶较小、生长慢且分化好,对18F-FDG摄取类似于正常或增生组织,水平较低,故诊断价值有限。11C-choline为诊断前列腺癌较成熟的显像药,对评估前列腺癌诊断、分期与预后有一定价值,但胆碱代谢显像较难分辨前列腺癌病灶与良性结节区别,可能发生误诊或漏诊。PSMA是Ⅱ型跨膜糖蛋白,存在于前列腺上皮细胞膜中,在多数前列腺癌中呈特异性表达[16-17]。肿瘤分化差、侵袭性高,导致PSMA高水平表达。PSMA的底物有叶酸、氨甲蝶呤、N-乙酰基-谷氨酸-天冬氨酸,为新开发的小分子理想靶点。PSMA 结构包括胞外端、跨膜段与胞内段,该结构有助于开发选择性高的抗肿瘤药和靶向显像剂[18]。68Ga标记的小分子PSMA阻滞剂对前列腺癌转移诊断有良好应用前景,后续的研究也证实了该示踪剂对前列腺癌的高准确性。68Ga-PSMA-11 PET/CT应用于前列腺癌诊断方面在国外有较多报道[19],但主要集中于生化复发探测,缺乏对早期前列腺癌诊断敏感性与特异性数据结构,国内该开始研究关于68Ga-PSMA-11在前列腺癌的诊断。ADC与SUVmax表示肿瘤细胞不同生物学特性,两者比值可反映组织中PSMA表达信息与水分子扩散程度。本研究SUVmax/ADC诊断前列腺癌的特异性较高,说明该诊断效能比两者单独检查高[20-21]。
综上所述,3.0MR FOCUS技术获得的ADC值为鉴别前列腺癌的标志之一,68Ga-PSMA-11 PET/CT为前景良好的前列腺癌靶向显像方式,两种检查联合能显著提高前列腺癌诊断特异性,其中SUVmax/ADC可作为特异诊断指标,能在术前或穿刺精确判断前列腺良恶性程度。

