牛磺酸对人宫颈癌细胞侵袭转移的抑制作用及机制研究
梁笑倾 万慧芳 刘卓琦 万福生
宫颈癌(cervical cancer)是女性常见的妇科恶性肿瘤,且近年来发病率呈明显上升和年轻化趋势[1]。目前治疗宫颈癌的主要有效方法是手术、放疗及手术联合放化疗的综合治疗,然对于复发转移、晚期宫颈癌患者疗效较差[2]。宫颈癌的侵袭转移过程极其复杂,具体机制仍不甚明确[3]。最近有研究显示[4]一些药物及抑癌基因对人宫颈癌HeLa细胞可能通过调控代表上皮特征的E-cadherin、代表间质特征的N-cadherin 及基质金属蛋白酶2/9(MMP2、MMP9)表达,进而逆转上皮-间质转化(EMT)的发生,发挥抑制宫颈癌侵袭转移的作用。
牛磺酸(Taurine,Tau)化学名为2-氨基乙磺酸,是一种内源性细胞保护物质,具有抗氧化、抗炎、抗肿瘤、调节胞内钙平衡及免疫调节等多种生物学功能[5]。近年发现[6-7]Tau可诱导宫颈癌等多种癌细胞凋亡,抑制结直肠癌与乳腺癌的生长及侵袭迁移,但Tau对宫颈癌细胞侵袭转移的影响如何尚未见报道。本文利用宫颈癌Hela细胞探讨了Tau对人宫颈癌细胞侵袭转移的影响及其分子机制,旨在为宫颈癌的防治提供新的思路和手段。
1 材料与方法
1.1 细胞及主要试剂
人宫颈癌细胞Hela细胞株购于中国科学院典型培养物保藏委员会细胞库。牛磺酸(SLBP8056V,Sigma公司),胰蛋白酶、RPMI-1640 培养基、细胞裂解液均购自于Solarbio 公司,CCK8试剂(上海东仁化学科技有限公司)。GSK-3β单克隆抗体(Cat.Ab32391) ,pho-GSK-3β(Ser9)单克隆抗体(Cat.ab75814) ,E-cadherin单克隆抗体(Cat.Ab1416,Abcam公司),N-cadherin多克隆抗体(Cat.Ab18203),Vimentin单克隆抗体(Cat.Ab92547),MMP2多克隆抗体(Cat.Ab37150),MMP7多克隆抗体(Cat.Ab5706),MMP9多克隆抗体(Cat.Ab38898),辣根酶标记山羊抗兔IgG(ZB-2301)北京中杉金桥公司。
1.2 CCK8检测细胞增殖活性
用0.25%胰酶在含10%胎牛血清的RPMI1640培养基中进行消化及37 ℃、5% CO2培养箱内常规传代培养,取对数生长期细胞进行后续实验。实验分组如下:空白对照组(Control,不含Tau)、Tau 20 mmol/L 组、Tau 40 mmol/L组、Tau 80 mmol/L组和Tau 160 mmol/L组。
取经胰酶消化制成密度约3×104个/mL单细胞悬液,以100 μL每孔接种于96孔板中,共接种3块96孔板(每组设3个复孔)。经培养过夜后,弃去旧的培养基,换成含不同溶度Tau(0、20、40、80、160 mmol/L)的完全培养基,分别作用24 h、48 h、72 h。从第二天开始,每隔12 h取1块96孔板,更换并加入100 μL新培养基(其中含有10 μL CCK8),孵育3 h。在波长450 nm处测定其吸光度值。实验重复3次。
1.3 Transwell小室检测细胞迁移能力
将生长良好的人宫颈癌Hela细胞用不含血清的培养基饥饿处理12 h,然后用含0.25% EDTA的胰酶消化,并用完全培养基终止消化,无血清培养基制成单细胞悬液,调整细胞浓度为1×105个/mL。在Transwell小室的上室内加入200 μL上述细胞悬液,24孔板中的下室加入600 μL含不同浓度Tau的10%血清的培养基,小室置于24孔板中,处理48 h。然后用棉签擦去上室细胞,PBS清洗3次后用4%细胞组织固定液固定细胞20 min,晾干后用1%结晶紫染色20 min,PBS洗涤3次。小室干燥后在倒置显微镜下观察并使用图像采集系统选取上、中、下、左、右5个视野于100倍镜下进行观察并拍照,计数并求其平均穿膜细胞数。实验重复3次。
1.4 Transwell小室检测宫颈癌Hela细胞侵袭能力
先将Matrigel胶分别与不含血清的H-DMEM和RPMI-1640基础培养基按1∶8的比例混合均匀(在冰上进行)。取该混合物60 μL铺于已预冷的小室中,将小室置于24孔板中,在37 ℃恒温培养箱中过夜凝固成胶状。然后接种细胞于小室中,接种于小室的细胞数为2×105个/孔,其余步骤与Transwell小室迁移实验一致,计算细胞侵袭能力。实验重复了3次。
1.5 用Western blot检测宫颈癌细胞中蛋白水平
收集经Tau处理48 h的宫颈癌细胞,在冰上用 RIPA 细胞裂解液进行裂解,12000 r/min离心(4 ℃)10 min,取上清液。采用 PierceBCA ProteinAssayKit试剂盒检测蛋白浓度,按20 μg蛋白上样量将蛋白样品与上样缓冲液(5×) 按 4∶1 的体积比例混合,沸水中煮5 min使蛋白变性。冷却后,经10%SDS-PAGE并半干电泳转至 PVDF膜上,5%脱脂奶粉封闭2 h后,分别加入PTEN、AKT、GSK-3β、p-GSK-3β、E-cadherin、N-cadherin、Vimentin、 β-catenin等一抗抗体,4 ℃ 孵育过夜。次日在室温下加入二抗再孵育2 h,以ECL化学发光法显色,X线胶片曝光成像,扫描仪扫描蛋白条带。
1.6 统计学处理
应用SPSS 20.0软件统计分析,组间进行单因素方差(one-way ANOVA),假若方差齐性,则使用LSD (L)法进行两两比较,若方差不齐性时,使用Dunnett,s (T3)法分析,以P<0.05为差异有显著性意义。
2 结果
2.1 Tau对宫颈癌Hela细胞的增殖抑制作用
用不同浓度Tau(0、20、40、80和160 mmol/L)分别处理宫颈癌Hela细胞不同时间段(24 h、48 h和72 h),利用CCK8检测Tau在不同浓度和时间对Hela细胞增殖的影响。结果如下图所示(图1)。结果显示,浓度为20~160 mmol/L的Tau分别作用细胞24 h、48 h和72 h后,对Hela细胞增殖均有不同程度的抑制作用(P<0.05),且呈一定的量效关系和时效关系。

图1 Tau对人宫颈癌Hela细胞增殖的影响
2.2 Tau对宫颈癌Hela细胞侵袭和迁移的影响
利用Transwell小室观察不同浓度Tau对Hela细胞侵袭与迁移的影响,以证实Tau处理浓度及时间效应关系。结果见图2。结果显示,经Tau处理细胞48 h后,Hela细胞的迁移和侵袭能力,随着Tau浓度的升高,穿膜细胞的数量逐渐减少,表明Hela细胞的迁移和侵袭能力明显逐渐下降。

图2 Tau对人宫颈癌Hele细胞的侵袭和迁移的影响
2.3 Tau对宫颈癌Hela细胞中上皮-间质转化(EMT)相关蛋白和MMPS蛋白表达的影响
采用Western blot检测Hela细胞中EMT相关标志蛋白的表达变化及MMPS蛋白表达的影响。结果显示,经Tau处理细胞48 h后,随着Tau浓度的增加,Hela细胞中代表上皮特征的E-Cadherin蛋白表达呈显著上调;相反代表间质特征的N-Cadherin和Vimen-tin则出现表达下降(图3),此结果表明Tau可以阻碍EMT的发生发展进程。同样,细胞中MMP2、MMP7、MMP9的蛋白表达也随着Tau浓度的增加有明显逐渐降低(图4),表明Tau可抑制Hela细胞中MMP2、MMP7、MMP9的表达,且呈剂量依赖性。

图3 Tau对人宫颈癌细胞中EMT相关蛋白表达的影响

图4 Tau对人宫颈癌Hele细胞中 MMPs蛋白表达的影响
2.4 Tau对宫颈癌Hele细胞中AKT/GSK-3β/β-Catenin通路的影响
通过免疫印迹分析细胞中PTEN、GSK-3β、AKT和β-catenin 的蛋白水平变化,结果发现(图5),经Tau处理48 h后,Hele细胞中PTEN、GSK-3β蛋白水平随着Tau浓度的增高而逐渐升高,且p-AKT水平也逐渐增高;相反,AKT和β-catenin表达则随着Tau浓度的增大而逐渐减弱,p-GSK-3β水平也逐渐下降。这些结果表明,Tau可促进PTEN、GSK-3β的表达,并通过调控 AKT/GSK-3β/β-catenin信号通路,调控宫颈癌细胞的侵袭转移。
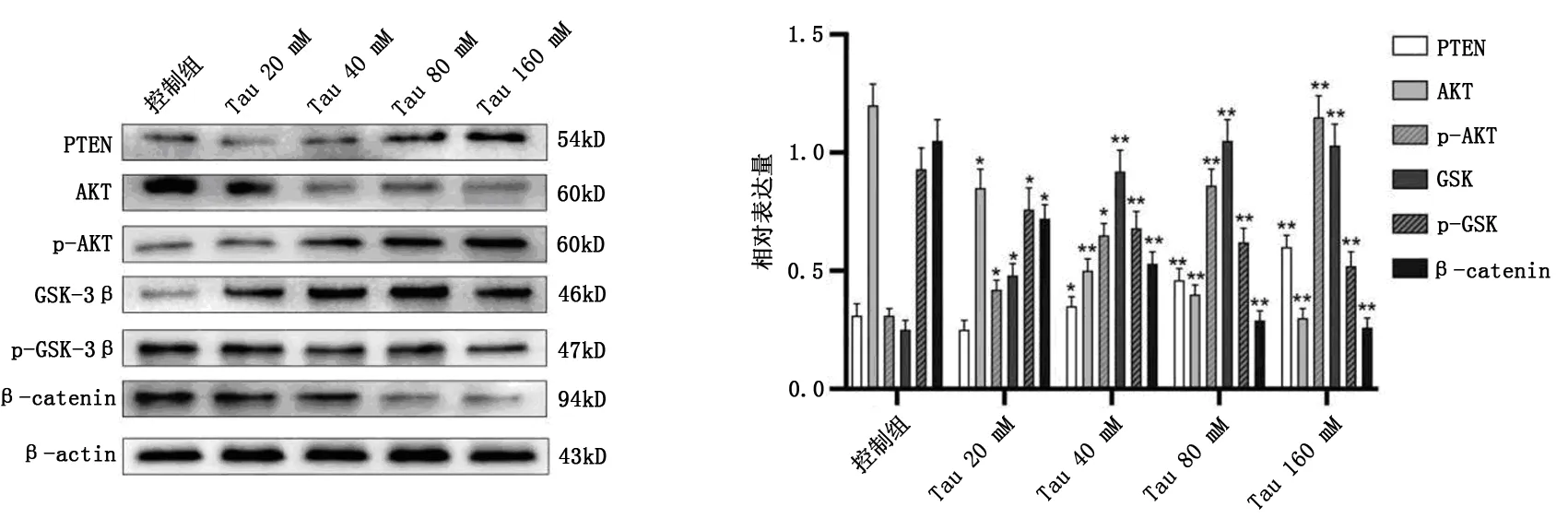
图5 AKT/GSK-3β/β-Catenin通路相关蛋白表达的变化
3 讨论
宫颈癌易于深浸宫颈间质、血管淋巴间隙,较早出现转移,这也是宫颈癌预后较差的原因。宫颈癌的发生及其侵袭转移是由一系列基因调控、多种机制共同作用的动态生物学过程,多种癌基因和抑癌基因通过参与癌细胞自噬及凋亡途径而发挥促进或抑制肿瘤生长的效应,如PI3K、AKT、Bax、BcL-2等[8]。Tau对宫颈癌Hela细胞侵袭转移与PI3K/AKT/GSK-3β/β-Catenin通路的影响如何尚未见报道。有研究表明,宫颈癌患者体内有Akt基因突变[9],宫颈癌的致癌基因与p53相互作用可调控宫颈癌细胞中的PI3K/Akt信号通路[10]。PI3K位于Ras信号通路的下游,PI3K/Akt/GSK-3β是最重要的信号转导途径之一,在调节细胞增殖、存活和侵袭中起主要作用。PI3K不仅是癌细胞形成的主因之一,还导致癌细胞的大量繁殖。PI3K激活AKT、GSK-3等下游分子,将多种生长因子及细胞因子的信号传递到细胞内,从而对细胞增殖、分化、凋亡、葡萄糖转运起重要的调节作用。故PI3K/Akt信号通路的激活是实体瘤细胞生长和生存的主要决定因素[11]。糖原合酶激酶-3β(GSK-3β)是AKT/GSK-3β信号通路调控上皮-间充质转化(EMT)的关键分子,与肿瘤侵袭转移密切相关[12]。最近许多研究认为GSK-3β可作为多种不同类型癌症的一个潜在的治疗靶点[13],在控制癌细胞侵袭和迁移方面发挥重要作用。PTEN(肿瘤抑制因子)是PI3K/Akt信号通路的重要负调节因子。PTEN通过降低AKT的磷酸化水平,从而阻断PI3K/Akt信号通路激活,使PI3K/Akt蛋白水平降低,促进癌细胞凋亡。故PTEN增多,抑制PI3K/Akt信号通路,进而抑制细胞的增殖、存活。本研究中发现Hele细胞中随着Tau浓度增加,PTEN 蛋白水平升高,AKT降低,GSK-3β浓度升高,细胞增殖抑制。
橙皮素可通过调控TGF-β1/Smad信号通路干预宫颈癌EMT过程和抑制宫颈癌细胞侵袭转移[14]。有研究发现Tau可协同顺铂发挥抑制宫颈癌生长[15],与其他化疗药物合用,对肿瘤治疗具有增效减毒作用[16]。我们前期研究发现牛磺酸可通过上调人哺乳动物不育系20样激酶1(MST1)蛋白表达诱导宫颈癌细胞凋亡[6,17],但Tau对宫颈癌侵袭转移的治疗效果如何尚未完全清楚。上皮-间充质转化(EMT)的激活是癌细胞转移的关键过程,典型特征是上皮分子标志物(E-Cadherin)的丢失和间质细胞标志物(Vim-enin/N-Cadherin)的表达上调,即E-Cadherin与上皮癌的进展、局部浸润和转移呈负相关。本文以宫颈癌Hela细胞为对象,通过Transwell小室和Western blot方法,探讨了Tau对宫颈癌细胞迁移和侵袭能力的影响及其可能机制。结果显示,Tau能显著性降低宫颈癌Hela细胞的迁移和侵袭能力,且呈剂量依赖性;同时,Tau能显著性降低Hela细胞中代表间质细胞特征的N-Cadherin和Vimentin的表达,提高代表上皮细胞特征的E-Cadherin的表达。此结果提示Tau不仅有抑制宫颈癌Hela细胞迁移和侵袭的作用,还可能具有阻止或逆转Hela细胞的EMT作用,类似报道是Tau对乳腺癌细胞EMT有较好的抑制作用[7]。
肿瘤的浸润和远处转移,还与血管快速生长密切相关。基质金属蛋白酶(MMP)是血管快速生长影响因素之一。本研究中发现,MMP浓度随Tau浓度的增大而降低,细胞凋亡增加。表明Tau抑制肿瘤细胞远处转移,可通过抑制MMP浓度,且呈剂量负相关。
Wnt/β-Catenin信号通路中的β-Catenin是一种多功能蛋白质,在细胞连接处与代表上皮细胞特征的E-Cadherixn相互作用,参与黏合带形成。过多的游离β-Catenin进入细胞核,引起肿瘤发生。本研究中发现,试验组随着Tau浓度增加,β-Catenin浓度减少,细胞凋亡增多。
本文实验结果显示,Tau能剂量依赖性地提高Hele细胞中GSK-3β、PTEN蛋白水平,并使AKT蛋白磷酸化水平增强,AKT水平降低;另一方面,β-catenin表达则随着Tau浓度的增大而逐渐减弱。结果表明Tau促进宫颈癌Hela细胞凋亡,抑制EMT转化,并通过调控PI3K/AKT/GSK-3β/β-catenin信号通路,最终达到抑制宫颈癌细胞侵袭转移。

