转谷氨酰胺酶交联时间对玉米胚芽蛋白功能性质的影响
王韵仪,任 健,宋春丽,孙天颖,宋 俊,曹 智
(齐齐哈尔大学 食品与生物工程学院,黑龙江 齐齐哈尔 161006)
玉米胚芽蛋白由玉米胚芽榨油后的副产物玉米胚芽粕中提取而来,主要由水溶性白蛋白和盐溶性球蛋白组成[1],含有8种人体必需氨基酸[2],还具备婴幼儿所必需的组氨酸,氨基酸含量均衡,营养价值较高。玉米胚芽蛋白具有良好的起泡、增稠和乳化能力,被广泛用于食品和非食品领域[3-4]。此外,玉米胚芽蛋白还可作为食物补充剂,应用于烘焙制品、肉制品中以补充营养[5]。由于制油过程中的高温高压环境导致玉米胚芽蛋白严重变性,通常具有低溶解度和难闻气味两种缺陷,限制了玉米胚芽蛋白进一步应用的潜力[6],因此有必要对玉米胚芽蛋白进行改性研究。目前,对于玉米胚芽蛋白提取的研究较多,而对于玉米胚芽蛋白改性的研究还有所缺乏。
酶法改性是利用酶催化蛋白质水解或交联,从而改变蛋白质的结构和特性。酶法交联是改造蛋白质组成及结构、易于调控其功能性质的高效方法,也是近年来相关研究的焦点。转谷氨酰胺酶(TGase)是一种可以催化蛋白质(或多肽)分子之间发生共价交联的酰基转移酶,可使蛋白质分子间和分子内生成ε-(γ-谷氨酰基)赖氨酸异肽键[7]。转谷氨酰胺酶促交联可以改善蛋白质稳定性、溶解性、持水能力、流变学特性、起泡性和乳化性[8-12]。利用转谷氨酰胺酶对玉米胚芽蛋白进行交联改性,以期解决玉米胚芽蛋白溶解性低的问题,提高其在食品工业领域的实际应用。为此,本文以玉米胚芽蛋白为原料,利用转谷氨酰胺酶进行交联处理,通过对不同交联时间的玉米胚芽蛋白功能性质及结构表征分析,深入研究结构变化对其性质的影响,分析其可能的作用机制,以期为玉米胚芽蛋白改性提供参考。
1 材料与方法
1.1 实验材料
玉米胚芽饼,市售;转谷氨酰胺酶(酶活100 U/g),江苏一鸣精细化工有限公司;碱性蛋白酶(酶活2万 U/g),诺维信有限公司;石油醚,天津市天力化学试剂有限公司;磷酸二氢钠,天津市科密欧化学试剂有限公司;所有分离用有机溶剂均为国产分析纯。
ZNCL-GS型酸度计,赛多利斯科学仪器(北京)有限公司;TU-1810紫外可见分光光度计,北京普析通用仪器有限责任公司;Spectrum One傅里叶变换红外光谱仪,美国PE公司;Nano-ZS90型粒度分析仪,英国Malvern公司;FW80型万能粉碎机,天津泰斯特仪器有限公司。
1.2 实验方法
1.2.1 玉米胚芽蛋白的提取
参考文献[13-15]采用碱溶酸沉法提取玉米胚芽蛋白。将玉米胚芽饼用磨粉机磨粉6~7次,然后与石油醚按1∶5比例混合浸提3次(每次2 h)进行脱脂,烘干后过0.15 mm(100目)筛,得到脱脂玉米胚芽粕粉。按料液比1∶20向脱脂玉米胚芽粕粉中加入蒸馏水,水浴加热至50℃后加0.08 mol/L NaOH溶液调pH至8.5,磁力搅拌2 h,于4 000 r/min离心10 min,取上清液用1 mol/L HCl调节上清液的pH至4.7,以4 000 r/min离心10 min,取沉淀,加入10倍质量的预先用1 mol/L HCl调节pH至 4.7的去离子水进行洗涤,以4 000 r/min离心10 min,重复3次,取沉淀;加NaOH溶液调节沉淀的pH至7,然后冷冻干燥24 h,即得玉米胚芽蛋白,记为原样。
1.2.2 不同交联时间玉米胚芽蛋白样品制备
配制5%的玉米胚芽蛋白溶液,调节溶液pH至10,并加热到45℃,按50 U/g(以玉米胚芽蛋白的质量计)加入碱性蛋白酶,反应3 h,得到酶解物溶液,经冷冻干燥,即得玉米胚芽蛋白酶解物,记为酶解样。将按上述方法制备的玉米胚芽蛋白酶解物溶液置于37℃的恒温水浴振荡器中,按10 U/g(以玉米胚芽蛋白的质量计)加入TGase,分别振荡反应1、2、3 h,置于90℃水浴锅灭酶5 min,冷却至室温后倒入冻干杯,冷冻干燥、研磨后得到不同交联时间的玉米胚芽蛋白。
1.2.3 红外光谱测定
采用傅里叶变换红外光谱仪对蛋白样品分子结构进行表征,扫描范围500~4 000 cm-1。使用peakfit软件拟合样品的特征峰,通过特征峰位置和面积分析蛋白二级结构α-螺旋、β-折叠、β-转角和无规则卷曲的含量。
1.2.4 粒径分布和Zeta电位测定
参考文献[16]的方法,将样品配制为0.1 mg/mL的蛋白质分散液,用0.22 μm水膜过滤后,用粒度分析仪测定粒径分布和Zeta电位。
1.2.5 溶解性测定
参考文献[15]的方法,分别取0.125 g样品于6只干净的烧杯中,分别加入25 mL去离子水,用1 mol/L HCl溶液和1 mol/L NaOH溶液调节溶液的pH分别至2.0、4.0、6.0、8.0、10.0、12.0,将烧杯放入水浴摇床振荡30 min,然后在3 000 r/min下离心20 min,取上清液,测定280 nm处的吸光度,当吸光度大于0.8时,稀释相应倍数并重新测定吸光度,空白对照液为去离子水。以吸光度表征样品的溶解性,吸光度越大,溶解度越大,溶解性越强。
1.2.6 起泡性测定
参考文献[17]的方法,用磷酸盐缓冲液配制蛋白质质量浓度为1 g/L的样品溶液,取100 mL蛋白溶液于250 mL烧杯中,测量样品体积(VL),用高速组织搅拌机以12 000 r/min均质1 min,记录搅打刚停止时的泡沫体积(V0),以及搅打后静置30 min时的泡沫体积(V30)。按下式计算样品的起泡能力(FC)和泡沫稳定性(FS)。
FC=V0/VL×100%
(1)
FS=V30/V0×100%
(2)
1.2.7 持水性和持油性测定
参考文献[18]的方法测定持水性。向干燥的离心管(质量记为m1)中加入0.200 0 g干燥至恒重的蛋白样品(质量记为m0),加入10 mL蒸馏水,搅拌使蛋白样品与蒸馏水充分混匀,然后在5 000 r/min下离心30 min,缓慢倒出上清液,称量离心管与沉淀的质量(质量记为m2)。按下式计算持水性(CW)。
CW=(m2-m1-m0)/m0
(3)
参考文献[18]的方法测定持油性。向干燥的离心管中加入0.2 g蛋白样品(样品质量为m),再加入10 mL大豆油(体积记为V1),搅拌使蛋白样品与大豆油充分混合,然后在5 000 r/min下离心30 min,将上清液缓慢倒入量筒中,记录其体积(体积记为V2)。按下式计算持油性(Co)。
Co=(V1-V2)/m
(4)
1.2.8 乳化性测定
参考文献[19]的方法,以0.1 mol/L磷酸盐溶液为溶剂配制质量浓度为1 g/L的蛋白样品溶液,加入大豆油(大豆油与蛋白质溶液体积比1∶3),然后用均质机以12 000 r/min均质1 min。取50 μL上清液,加入5 mL 1 g/L的十二烷基磺酸钠溶液,测定500 nm处的吸光度(A0)。再取均质静置10 min后的上清液重复上述操作。按下式计算乳化活性和乳化稳定性。
(5)
IES=A10/A0×100%
(6)
式中:IEA为乳化活性,m2/g;φ为样品溶液油的体积分数;c为乳化前蛋白样品溶液的质量浓度,g/mL;n为稀释倍数;IES为乳化稳定性;A10为乳液静置10 min后的吸光度。
2 结果与分析
2.1 交联时间对玉米胚芽蛋白二级结构的影响
玉米胚芽蛋白的红外光谱图如图1所示,二级结构含量如表1所示。
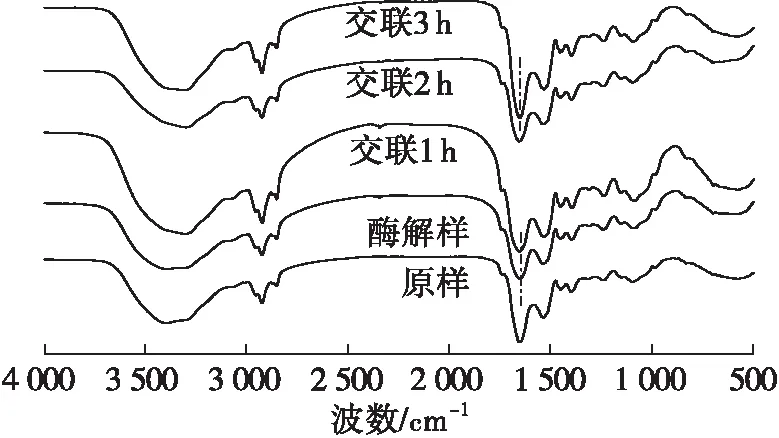
图1 玉米胚芽蛋白红外光谱图
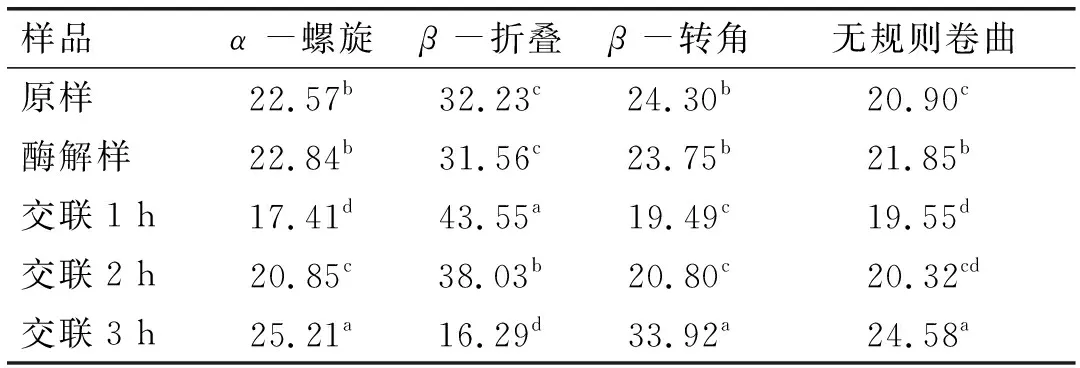
表1 玉米胚芽蛋白二级结构含量 %
由图1可见:在3 300~3 600 cm-1的衍射峰对应O—H的伸缩振动[20],各组样品均出现氢键的特征峰,而3 350 cm-1和3 188 cm-1处的双峰则对应N—H的反对称与对称伸缩振动吸收峰[21];经过TGase交联后的玉米胚芽蛋白的最大吸收峰值较原样发生偏移,表明蛋白质氢键发生改变且O—H和N—H含量发生变化;2 880~2 990 cm-1处的衍射峰对应C—H伸缩振动,随着交联时间的延长该处峰面积增大,表明随着交联时间的延长,蛋白质的主侧链碳基结构发生变化;在TGase交联3 h后,在酰胺Ⅰ带范围内(1 600~1 700 cm-1),玉米胚芽蛋白的特征峰(1 658 cm-1)相对于酶解样的特征峰(1 653 cm-1)蓝移了5 cm-1。
由表1可见,玉米胚芽蛋白被碱性蛋白酶酶解后,二级结构中除无规则卷曲增加外,其他变化不显著,因为酶解主要改变蛋白质一级结构,而对玉米胚芽蛋白的二级结构影响程度较小。随着TGase交联的进行,β-折叠含量在前1 h内升高随后下降,α-螺旋和β-转角含量的趋势正好相反,无规则卷曲的含量则在前2 h内基本稳定,在3 h时突然增加,可能受蛋白质聚集影响,使蛋白质由有序结构向无序结构转变。
2.2 交联时间对玉米胚芽蛋白粒径的影响(见图2)
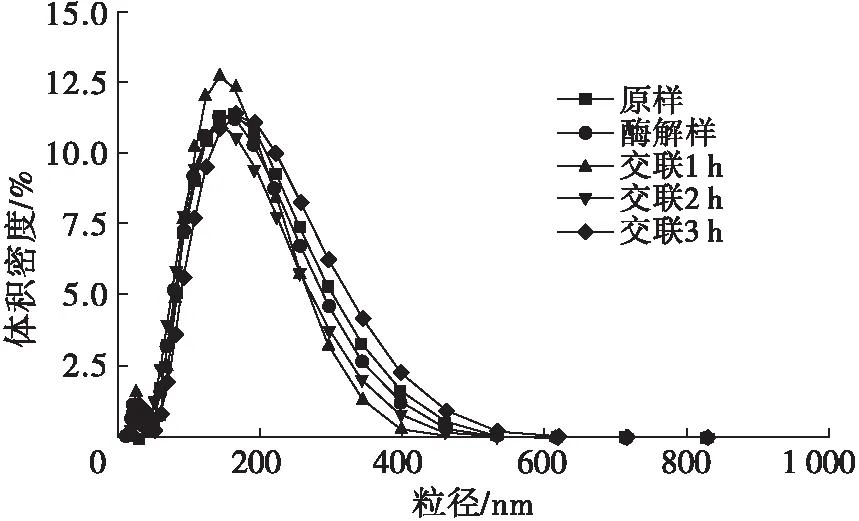
图2 交联时间对玉米胚芽蛋白粒径的影响
由图2可见,随着交联时间的延长,玉米胚芽蛋白的粒径发生了变化,原样、酶解样、交联1 h、交联2 h和交联3 h的样品的平均粒径分别为138.1、116.5、121.3、125.5、138.2 nm。经碱性蛋白酶酶解后玉米胚芽蛋白的粒径减小,是由于蛋白质分子链断裂所致;随着TGase交联时间的延长,玉米胚芽蛋白粒径逐渐增大,是由于TGase的作用使得经过酶解后的部分蛋白质分子发生再聚集,形成体积较大的聚合体,聚合体数量随交联时间的延长而增多,从而使粒径增大。另外,各样品的峰值所对应粒径的大小,也呈现相同的变化趋势。
2.3 交联时间对玉米胚芽蛋白Zeta电位的影响(见图3)
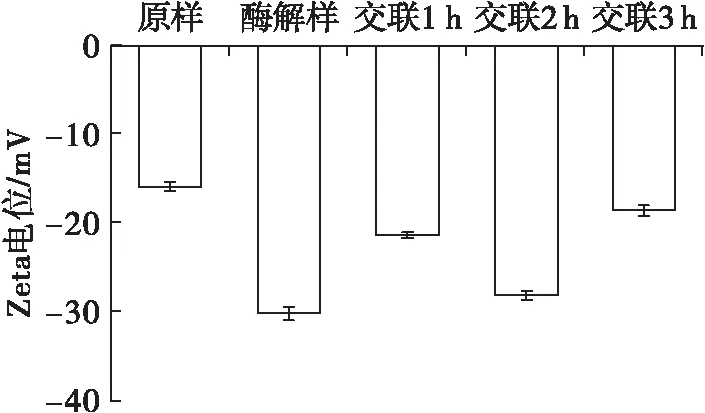
图3 交联时间对玉米胚芽蛋白Zeta电位的影响
Zeta电位绝对值大小反映蛋白质表面的静电排斥强弱,Zeta电位绝对值越大,静电排斥作用越强,分子间越不易聚集[22]。由图3可见,酶解后Zeta电位绝对值增加,这是因为酶解促使蛋白质内部带负电荷的氨基酸残基暴露[23]。TGase交联后Zeta电位绝对值小于酶解后的玉米胚芽蛋白。随着TGase交联时间的延长,Zeta电位绝对值先增大后减小,交联2 h时,Zeta电位绝对值最大。这是因为在交联前期,TGase交联会使谷氨酰胺与赖氨酸形成异肽键,导致氨基丢失,减少正电荷数,使Zeta电位绝对值增加;在交联后期,反应体系中没有赖氨酸残基或伯胺时,水作为酰基受体与谷氨酰胺残基发生水解,脱除带负电的酰胺基团,从而减少了Zeta电位绝对值[24]。
2.4 交联时间对玉米胚芽蛋白溶解性的影响(见图4)
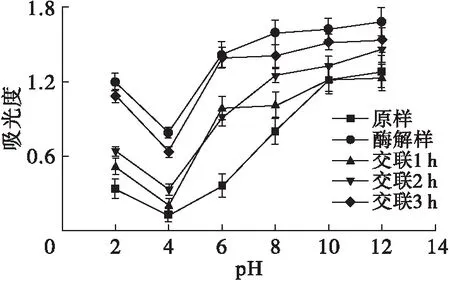
图4 交联时间对玉米胚芽蛋白溶解性的影响
由图4可见:随着pH的升高,各样品的溶解度呈先下降后上升的趋势,酶解样的溶解度在各pH均最高,这是因为经碱性蛋白酶酶解后蛋白质分子链变短,有利于蛋白质溶解;在pH为4时各样品的溶解度均表现为最低值,这是因为此时蛋白质接近电中性,分子间静电斥力减弱,因此溶解度最低[25];随着交联时间的延长,玉米胚芽蛋白的溶解性逐渐增强,交联3 h的玉米胚芽蛋白溶解性最强,这是因为TGase可以催化谷氨酰胺残基与赖氨酸形成分子内和分子间的异肽键,降低球蛋白表面的疏水性,从而提高溶解性,另外,β-转角含量升高也会降低蛋白质的表面疏水性,提高蛋白质的溶解性[26-27]。
2.5 交联时间对玉米胚芽蛋白起泡性的影响(见图5)

图5 交联时间对玉米胚芽蛋白起泡性的影响
由图5可见,随着交联时间的延长,玉米胚芽蛋白的起泡能力呈上升趋势,交联3 h时,起泡能力最强,为175%,显著高于其他样品(p<0.05),说明TGase处理玉米胚芽蛋白可提高其起泡能力,且可通过交联时间的长短来调控。这是因为随着TGase交联时间的延长,玉米胚芽蛋白肽链上谷氨酰胺与氨基酸残基相连,形成高机械强度网状液膜,膜的弹性及致密性提高,气体不易向外扩散,从而使起泡能力增强[28]。随着交联时间的延长,玉米胚芽蛋白泡沫稳定性先上升后下降,原样、酶解样和交联1 h的样品泡沫稳定性差异不显著(p>0.05),交联2 h的样品泡沫稳定性最强(90.6%),交联3 h时样品的泡沫稳定性减弱。虽然玉米胚芽蛋白发生交联反应形成了较大的聚合物,有利于泡沫的形成和吸附,导致起泡能力增强,但TGase交联3 h的样品Zeta电位绝对值变小,分子间易于聚集,导致泡沫坍塌,影响泡沫的稳定性[29-31]。
2.6 交联时间对玉米胚芽蛋白持水性和持油性的影响(见图6)

图6 交联时间对玉米胚芽蛋白持水性和持油性的影响
由图6可见,玉米胚芽蛋白经碱性蛋白酶酶解和TGase交联反应后,持水性和持油性均有所增强,并且持水性随着交联时间的延长而提高,交联3 h时持水性达到了3.90 g/g,较原样提高了9.16%,其原因可能是碱性蛋白酶的脱酰胺导致蛋白质的二级结构发生变化,更多的亲水肽链暴露,经TGase处理后形成了新的化学键,增强了蛋白质的网状结构,为水分子的留存提供了空间,两者协同提高了玉米胚芽蛋白的持水性[31]。结合蛋白质二级结构的变化规律,推测β-折叠向β-转角的转变可能会促进玉米胚芽蛋白网状结构的形成。交联3 h 时玉米胚芽蛋白的持油性表现为最高值(3.81 mL/g),较原样提高了8.71%,且显著高于其他样品(p<0.05),但在0~2 h的交联时间内,持油性增长缓慢,归因于TGase交联反应初期的肽链解离,形成的聚合物较少,而油分子较大,蛋白质结构不能良好地支撑油分子,随着交联时间的延长聚合物增多,蛋白质空间结构变密,相对分子质量变大,有利于俘获和支撑油分子[32]。
2.7 交联时间对玉米胚芽蛋白乳化性的影响(见图7)

图7 交联时间对玉米胚芽蛋白乳化性的影响
由图7可见,碱性蛋白酶酶解后玉米胚芽蛋白的乳化活性(3.315 m2/g)比原样(1.973 m2/g)有所增加,这是由于酶解后玉米胚芽蛋白的分子链变短,暴露出极性基团使其乳化活性稍有改善。经碱性蛋白酶酶解后的玉米胚芽蛋白乳化稳定性最高(42.01%),这是因为酶解后蛋白质相对分子质量较小,溶解性最好,Zeta电位绝对值最高,所以其乳化稳定性最强。随着交联时间的延长,玉米胚芽蛋白的乳化活性逐渐升高,交联3 h的玉米胚芽蛋白乳化活性较原样提高了16.7倍,并且也显著高于其他样品(p<0.05)。这是因为经过TGase交联的蛋白质小分子发生聚集,形成了更多的网状结构,增强了水油界面的吸附性,同时更大的蛋白质粒径也有助于形成更大粒径的乳液,从而提高了乳化活性[33];其次,随交联时间延长蛋白质羟基增多,其二级结构的改变造成了其溶解性和疏水性的改变,疏水性的降低可能是由于聚合肽暴露的疏水残基被埋在聚合分子内部,蛋白质亲水基团增多利于其在水油界面上的吸附,从而提高了乳化活性[34-35]。玉米胚芽蛋白乳化稳定性则随着TGase交联时间的延长而降低,这可能是由于交联形成的聚合物增多导致相对分子质量增大,蛋白质之间易于团聚所导致。
3 结 论
对TGase交联玉米胚芽蛋白功能和结构性质进行检测表征,结果表明,与原样相比,TGase交联处理可以增强玉米胚芽蛋白的溶解性、起泡能力、持水性、持油性和乳化活性,除持油性外,与交联时间均呈正相关的趋势,综合来说,交联3 h的玉米胚芽蛋白的功能性质表现最佳。交联处理后蛋白质中β-转角二级结构和羟基增多,蛋白质的粒径大小和Zeta电位发生了改变,蛋白质结构与表面化学性质的变化共同影响着玉米胚芽蛋白的功能性质。

