桂皮醛对百草枯中毒小鼠急性肝损伤的保护作用
郭治华, 刘振宁, 李子英, 蒲 羿, 韩思盈
百草枯(paraquat, PQ)是一种触杀型高效除草剂。尽管自2016年开始国内已经发布禁止生产销售百草枯水剂,但是在临床上仍有百草枯中毒事件的发生。急性百草枯中毒病死率高,通常情况下20%百草枯溶液10~20 mL即可造成患者多器官损伤甚至死亡。百草枯进入体内以后,迅速吸收入血,分布全身各个组织器官,造成肺脏、肝脏、肾脏、心肌等功能损伤。由于肺脏中存在着丰富的多胺摄取系统,肺泡上皮细胞很容易将其摄取,产生氧化还原反应造成急性肺损伤[1]。肾脏作为百草枯的主要排泄器官,同样可以造成急性肾损伤。有学者研究发现, 近50%百草枯中毒患者出现了急性肝损伤[2]。然而,百草枯导致急性肝损伤的机制以及能否有药物对肝脏产生保护作用,目前尚未明确,需要进一步研究和探索。
桂皮醛(cinnamaldehyde, CA)是中国传统中药材肉桂挥发油的主要成分,具有抗炎、抗氧化、免疫调节等多种生物活性[3-4]。桂皮醛可以显著减少活性氧自由基释放,降低一氧化氮表达水平,并增加抗氧化酶包括超氧化物歧化酶(SOD)及谷胱甘肽还原酶的含量,发挥抗氧化作用[3]。桂皮醛可以抑制巨噬细胞NACHT、LRR和PYD结构域蛋白3(NLRP3)炎性小体的激活,降低促炎症因子白细胞介素-1β(IL-1β)和肿瘤坏死因子-α(TNF-α)的表达,发挥抗炎作用[5]。鉴于既往研究显示氧化应激损伤和炎症反应是百草枯在体内导致器官损伤的主要机制,而桂皮醛能否在百草枯致小鼠急性肝损伤过程中发挥保护作用,目前尚不清楚,国内外未见相关研究报道。本研究将采用不同剂量桂皮醛对百草枯中毒小鼠进行预处理,研究其对肝脏的保护作用以及可能的作用机制。
1 材料与方法
1.1药品与试剂 百草枯和桂皮醛(Sigma-Aldrich公司, 美国);IL-1β ELISA试剂盒(R&D,美国),SOD和丙二醛(MDA)检测试剂盒(南京建成生物公司,中国);过氧化物酶体增殖物激活受体-γ共激活因子-1α(PGC-1α)、沉默调节蛋白1(SIRT1)、NLRP3、半胱氨酸蛋白酶-1(Caspase-1)和甘油醛-3-磷酸脱氢酶(GAPDH)抗体(Proteintech,美国);其余均为进口或国产分析纯化学试剂。
1.2动物与分组
清洁级雄性C57BL/6N小鼠(体质量18~25 g),共计24只,由北京维通利华实验动物技术有限公司提供。小鼠饲养的条件为室内温度控制20~25 ℃、湿度控制40%~60%,昼夜节律控制,自由摄取水和食物。该实验研究方案经过中国医科大学盛京医院动物伦理委员会批准[伦理编号:2020PS195K(X1)]。
将24只小鼠随机平均分成4组,每组6只。百草枯中毒(PQ)组:按照百草枯30 mg/kg剂量一次性腹腔注射;低剂量桂皮醛(PQ+L-CA)和高剂量桂皮醛(PQ+H-CA)干预组:按照50 mg/(kg·d)或100 mg/(kg·d)两种不同剂量桂皮醛进行小鼠灌胃7 d,然后给予百草枯30 mg/kg腹腔注射;对照组(Control):0.3 mL生理盐水灌胃。在百草枯腹腔注射后24 h,处死小鼠,留取血液和肝组织标本,置于-80 ℃保存以备检测。取肝脏左叶部分置于4%多聚甲醛溶液中固定72 h,以备石蜡包埋切片。
1.3研究方法
1.3.1 HE 染色 取出保存在4%多聚甲醛固定好的小鼠肝组织,流水中冲洗1 h后切割组织块(厚度约0.5 cm),常规组织梯度酒精脱水,二甲苯透明,再将标本放置65 ℃液态蜡块中浸蜡,包埋模具内包埋成蜡块,使用切片机连续切片厚度约4 μm。将切片用二甲苯脱蜡,再移入苏木精染色3 min,然后流水冲洗,晾干后放入1%盐酸乙醇溶液分化,伊红液染色10 s后,流水冲洗终止染色,放在梯度酒精中脱水,二甲苯透明处理,滴加中性树胶封片保存。在光镜下使用图像采集软件(NIS-Elements F3.0)观察肝脏组织形态学改变。
1.3.2 肝脏组织学评分 两名研究人员采用盲法对肝脏组织病理学变化进行评估。肝脏组织病理学评分[6]涉及到下列项目:肝窦充血,肝细胞空泡化,肝细胞坏死;分数范围设定为0:没有改变,1:微小改变(单个细胞坏死),2:轻度改变(<30%),3:中度改变(30%~60%),4:重度改变(>60%)。
1.3.3 免疫组化染色 将肝脏组织切片使用0.1 mol/L PBS漂洗3~5次,然后使用3%H2O2孵育20 min,再使用PBS冲洗5次,加入适量3% Triton X-100进行孵育。20 min以后,再用0.01 mol/L柠檬酸钠缓冲液(pH 6.0)进行抗原修复20 min。然后滴加10%正常山羊血清封闭游离的结合位点,室温孵育20 min。去上血清,分别滴加适量兔抗鼠PGC-1α、SIRT1及NLRP3抗体(1∶500稀释), 4 ℃冰箱过夜。同时使用PBS代替一抗作为阴性对照。使用PBS冲洗玻片3~5次,然后滴加生物素标记的山羊抗兔二抗工作液(1∶200),室温孵育30 min。再次使用PBS冲洗3~5次, 滴加SABC, 室温20 min。使用PBS冲洗20 min,再使用DAB显色剂显色2~3 min,终止显色。苏木素复染15 s,分色,二甲苯透明,晾干,中性树胶封片。
1.3.4 肝组织MDA、SOD和血清IL-1β含量测定 按照建成生物公司SOD和MDA检测试剂盒说明书执行,检测肝组织中含量;使用ELISA方法按照IL-1β说明书检测血清中含量。
1.3.5 Western blot 方法检测肝组织PGC-1α、SIRT1、NLRP3及Caspase-1的表达 按照细胞核蛋白提取试剂盒说明,提取肝组织蛋白;配制 15%分离胶和5%浓缩胶,蛋白定量后取50 μg 加样,聚丙烯酰胺在120 V条件下电泳2 h;50 V 条件下PVDF 膜转膜3 h;5%脱脂牛奶封闭,滴加PGC-1α、SIRT1、NLRP3和Caspase-1一抗(1∶100),4 ℃过夜; 次日,使用 TBST 缓冲液清洗 3 次,每次 5 min。再加入二抗(1∶500)室温下孵育2 h,再用TBST 缓冲液清洗 3 次,每次5 min,后滴加 ECL 发光液,然后置于凝胶成像系统显影,获得图像。使用Image J软件获得各个条带的灰度值,以GAPDH为内参,计算蛋白的相对表达量,并进行组间比较。

2 结果
2.1肝组织损伤评分 正常小鼠肝脏细胞结构正常,肝小叶结构完整。百草枯中毒组小鼠肝脏组织肝小叶中央静脉淤血,周围肝细胞水肿,甚至出现胞浆疏松化,肝细胞核出现固缩甚至溶解,汇管区出现炎症细胞浸润。使用桂皮醛预处理以后,尤其是高剂量组小鼠肝小叶静脉淤血明显减轻,肝细胞浆空泡化减轻,肝细胞坏死减轻,炎症细胞浸润减少(见图1)。肝组织病理学评分结果显示,百草枯中毒后肝组织病理学评分增加,而使用桂皮醛预处理以后肝组织病理学评分下降,尤其是高剂量组,与百草枯中毒组比较差异有统计学意义(P<0.05)。见表1。

注:PQ为百草枯中毒组;PQ+L-CA为低剂量桂皮醛干预组;PQ+H-CA为高剂量桂皮醛干预组;Control为对照组
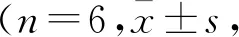
表1 不同组别小鼠肝组织病理学评分分)
2.2肝组织中SIRT1、PGC-1α、NLRP3和Caspase-1蛋白表达 PGC-1α和SIRT1蛋白在正常小鼠肝组织中仅少量表达。百草枯中毒后二者表达增加,与对照组比较差异有统计学意义(P<0.05)。使用桂皮醛预处理以后,二者表达较前增加,尤其是高剂量组更为明显,与百草枯中毒组比较差异有统计学意义(P<0.05)。NLRP3和Caspase-1在正常小鼠肝组织中表达量极少。百草枯中毒后二者表达增加,明显高于对照组(P<0.05)。与百草枯中毒组比较,桂皮醛预处理可以减轻百草枯诱导的NLRP3和Caspase-1表达(P<0.05)。见图2、3。

注:PQ为百草枯中毒组;PQ+L-CA为低剂量桂皮醛干预组;PQ+H-CA为高剂量桂皮醛干预组;Control为对照组;SIRT1为沉默调节蛋白1;PGC-1α为过氧化物酶体增殖物激活受体-γ共激活因子-1α;NLRP3为NACHT、LRR和PYD结构域蛋白3
2.3肝组织中MDA和SOD含量 百草枯中毒小鼠肝组织中MDA含量较正常组小鼠增加,而SOD含量降低(P<0.05)。经过桂皮醛预处理后,MDA含量较百草枯中毒组降低,而抗氧化蛋白SOD含量随着桂皮醛的剂量增加,与百草枯中毒组比较差异有统计学意义(P<0.05)。见表2。

注:PQ为百草枯中毒组;PQ+L-CA为低剂量桂皮醛干预组;PQ+H-CA为高剂量桂皮醛干预组;Control为对照组; SIRT1为沉默调节蛋白1;PGC-1α为过氧化物酶体增殖物激活受体-γ共激活因子-1α;NLRP3为NACHT、LRR和PYD结构域蛋白3; Caspase-1为半胱氨酸蛋白酶-1;GAPDH为甘油醛-3-磷酸脱氢酶;与Control组比较,*P<0.05;与PQ组比较,#P<0.05
2.4血清IL-1β含量 与对照组比较,百草枯中毒小鼠血清IL-1β含量增加(P<0.05)。使用桂皮醛预处理以后,IL-1β含量下降,尤其是高剂量组,与百草枯中毒组比较差异有统计学意义(P<0.05)。见表2。

表2 不同组别小鼠肝组织中MDA和SOD含量及血清IL-1β含量
3 讨论
除肺脏之外,肝脏作为百草枯中毒另一个重要器官,引起众多临床医生的关注,其中毒机制尚不十分清楚。目前普遍认为百草枯作为强氧化剂,进入体内后通过氧化还原系统产生氧化应激反应,进而触发炎症反应,炎症细胞浸润,炎症细胞因子大量分泌,导致细胞死亡[7]。既往研究发现,百草枯中毒后肝脏出现局灶性甚至广泛性细胞坏死,中性粒细胞巨噬细胞等大量炎性细胞浸润。在本研究中,同样发现百草枯中毒小鼠肝组织出现细胞水肿,细胞空泡变性,肝细胞凋亡。使用桂皮醛预处理以后,肝细胞损伤较百草枯中毒小鼠减轻,尤其是高剂量组肝组织损伤评分明显减轻,对百草枯中毒导致的急性肝损伤产生保护作用。
SIRT1 是一种烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NAD)依赖性蛋白去乙酰化酶,属于sirtuins 家族,可以使NF-κB、过氧化物酶体增殖物激活受体γ共激活因子-1α(peroxisome proliferator-activated receptor γ coactivator-1α, PGC-1α)等赖氨酸残基发生去乙酰化,调节相关基因表达,从而抑制氧化应激和炎症反应[8]。PGC-1α是线粒体生物合成的重要调控因子,能够通过诱导抗氧化酶的表达清除活性氧自由基,在维持氧化还原状态方面起到非常重要的生物学作用[9]。SIRT1 可以使肝内线粒体的生成增加,促进肝内抗氧化物酶、MnSOD 的表达[10]。此外,还有研究表明SIRT1对 PGC-1α 的去乙酰化能显著提高PGC-1α的活性。PGC-1α 基因敲除鼠过氧化氢酶,SOD1及SOD2 表达水平均明显下降,抗氧化能力减弱[11]。本研究发现, 百草枯中毒小鼠肝组织中SIRT1和PGC-1α均有少量增加。使用不同剂量桂皮醛预处理以后,SIRT1和PGC-1α在肝组织中的表达均进一步增加,抗氧化酶SOD活性增强,作为细胞脂质过氧化产物MDA明显减少。相对于低剂量桂皮醛而言,高剂量桂皮醛更为明显增加SIRT1和PGC-1α的表达及SOD的活性,发挥抗氧化作用。
NACHT、LRR和PYD结构域蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3, NLRP3)炎性小体是由模式识别受体识别病原体相关分子模式或危险相关分子模式,进而招募凋亡相关斑点样蛋白及效应分子胱冬肽酶(pro-caspase1)组成。当NLRP3炎性小体被激活以后,pro-caspase-1 可通过剪切活化成为具有酶活性的Caspase-1,Caspase-1活化后可使IL-1β和IL-18前体转变成成熟的IL-1β和IL-18释放至细胞外,参与炎症反应[12]。近年来,国内外学者研究[13-15]发现, NLRP3炎性小体参与包括内毒素(LPS)、药物、缺血再灌注等各种原因引起的急性肝损伤。既往课题组研究发现,百草枯中毒可以诱导NLRP3炎性小体活化,进而导致炎性细胞因子IL-1β和IL-18表达增加[16];在百草枯中毒导致急性肝损伤的动物模型中,NLRP3炎性小体同样参与其中过程[17]。在本研究中,两种剂量桂皮醛均能够减少NLRP3 和Caspase-1蛋白表达,导致小鼠血清IL-1β含量进一步减少。高剂量桂皮醛对NLRP3炎性小体活化抑制作用尤为明显,减少炎性细胞因子的分泌。
近年来,桂皮醛越来越受到国内外学者的关注和研究。在鼠伤寒沙门氏菌感染引起的小鼠肝损伤动物模型中,肉桂醛可通过减少促炎细胞因子和趋化因子的表达,减轻炎症反应,抑制氧化应激和细胞凋亡,达到保护肝损伤的目的[18]。另一项研究[19]表明,桂皮醛可通过抑制NF-κB和p53通路减轻大鼠肠系膜缺血再灌注导致的急性肝损伤,减轻细胞凋亡和炎症反应,进一步说明桂皮醛在急性肝损伤方面的保护作用。在本研究中,两种不同剂量桂皮醛呈剂量依赖性对百草枯中毒导致急性肝损伤产生保护作用,减轻肝组织病理学损伤,增加抗氧化酶SOD的表达,降低脂质过氧化产物MDA的产生,减少炎性细胞因子IL-1β的释放。分析其作用机制,桂皮醛可能通过调控SIRT1/PGC-1α表达和抑制NLRP3炎性小体活化发挥抗氧化和抗炎作用,从而对百草枯中毒导致急性肝损伤产生保护作用。本研究只从动物层面进行了初步探索,未在细胞水平对桂皮醛的药理作用进行更深入的研究,更多分子作用机制仍需进一步探讨。桂皮醛作为一种天然植物的提取物,具有很好的临床研究价值,未来有望应用于百草枯中毒患者的临床救治。

