microRNAs与肿瘤寡转移的研究进展
李宝宝 郭爱红 王丙聚 吴曼玲 李 珊 路昭颖 郝瑛子
延安大学咸阳医院神经内科,陕西咸阳 712000
目前,恶性肿瘤进展阶段主要分为原发病灶及远处转移。众所周知,根治性手术常用于治疗原发灶,而对已发生远处转移的患者多予以姑息治疗。对于肿瘤转移,可能忽视了存在其中的异质性差异。1995年,Hellman 与Weichselbaum 认为在肿瘤转移过程中可能存在介于肿瘤的原发灶与广泛转移之间的中间阶段,并首先提出“寡转移”这一概念。此概念提示治疗局部肿瘤极有可能改善处于寡转移阶段患者的生存情况,甚至治愈肿瘤。MicroRNAs(miRNAs)已被人们发现参与调控肿瘤寡转移,因此深入了解肿瘤寡转移,并且熟知寡转过程中miRNAs 及其靶分子的作用机制与功能,将会为今后的诊断与治疗提供一定的帮助。
1 肿瘤的寡转移
随着临床及基因组数据逐渐积累,肿瘤寡转移目前定义为不超过5 个部位的远处转移。尽管人们对寡转移认识逐渐加深,但有关寡转移分子及基因组学的研究仍然有限。目前针对寡转移形成存在两种假设:①起源差异,即寡转移与多灶转移间存在遗传性分子及表型差异;②寡转移只作为广泛转移发展过程中早期且短暂的阶段。Gerlinger 等在转移瘤细胞中发现,肿瘤转移灶与原发肿瘤虽具有相同的突变事件但仍存在异质性。然而,寡转移的具体产生时机及相关调控机制仍不明确。寡转移与多灶转移的两种不同假设见图1(封三),提示寡转移形成过程可在一定程度上反映目前存在的两种假设。
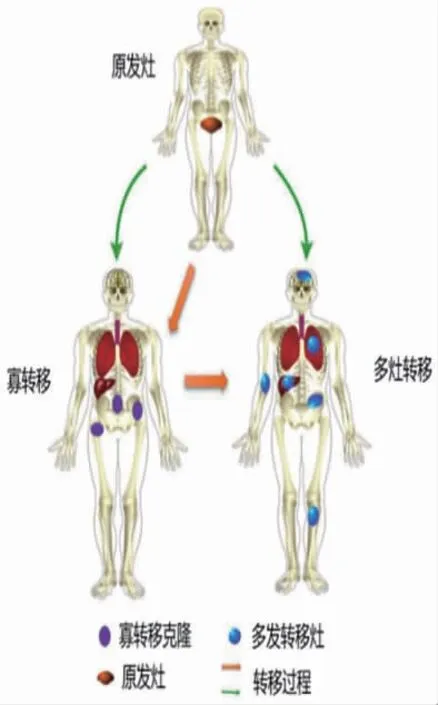
图1 寡转移与多灶转移的两种不同假设(见内文第29页)
随着高通量基因组学、转录组学与蛋白质组学的发展,人们普遍认为转移瘤的形成涉及多个步骤,寡转移与多灶转移的分化可能起始于转移过程的不同阶段。目前的临床研究也证实,至少三类的患者出现寡转移:①最初诊断即为寡转移;②在原发肿瘤完整切除后又出现寡转移;③减瘤性治疗后产生寡转移。这提示明确肿瘤转移过程中发生寡转移与多灶转移的具体阶段以及确定不同阶段的分子标记物,对临床诊断与治疗至关重要。不断积累的研究显示,miRNAs 可能在肿瘤寡转移过程中,发挥重要的调控机制。
2 miRNAs 与肿瘤寡转移
2.1 miRNAs 参与肿瘤转移的分子学基础
miRNAs 是一类小非编码RNA,它们可结合靶mRNA 3′末端非编码区(untranslated regions,UTR),导致靶mRNA 降解或抑制其翻译。部分miRNAs 在肿瘤的发生、转移等过程中发挥重要作用。miRNAs 基因常位于染色体脆弱位点,在肿瘤发生、发展中,其正常调控功能常被解除。
miRNAs 在肿瘤转移级联步骤中机制广泛。Lujambio 等发现,miRNAs 受p53 与myc 调控,并由此确定是否激活原发肿瘤初始增殖所必需的增殖机制。此外,在肿瘤转移的级联步骤中,miRNAs 可参与调节上皮间质转化(epithelial mesenchymal transition,EMT)。既往研究发现,多种miRNAs,如:miR-199、miR-214、miR-193a-3p、miR-210-3p 及miR-200 家族等,经下游信号换能器和转录激活器(signal transducer and activator of transcription 3,STAT3)、转化生长因子-β(transforming growth factor-β,TGF-β)、ZEB1 等分子参与,使肿瘤发生EMT。同样,在转移细胞黏附阶段,miR-31 及miR-26a 可分别在RhoA(ras homolog family member A)、ITGA5(integrin subunit α 5)、Rb1(Rb transcriptional corepressor 1)及ras 同源家族成员A(E2F transcription factor 1,E2F1)分子参与下,介导循环肿瘤细胞黏附。在最后的转移定植阶段,miR-17可抑制血小板反应蛋白1,从而促进肿瘤血管生成;同时,在缺氧诱导下miR-210 可稳定线粒体并调控细胞存活与增殖。上述miRNAs 在肿瘤转移过程中涉及的广泛作用,是其调控寡转移的重要分子基础。
2.2 miRNAs 在寡转移中的分子机制
目前已有研究表明miRNAs 可通过调控下游靶基因及蛋白参与寡转移。Lussier 等通过无监督聚类分析(unsupervised hierarchical clustering)发现,转移相关miRNAs 可确认部分寡转移阶段以及广泛转移阶段的转移样本。表明某些miRNAs 表达模式可能同时存在于肿瘤寡转移与广泛转移阶段,且不同的miRNAs 表达模式可能构成了寡转移与多灶转移的分子基础。
有研究发现,14q32.2 区基因可编码多种寡转移相关miRNAs,且已发现该位点内表达的多个miRNAs可抑制肿瘤细胞EMT;在寡转移细胞内,该区编码的miR-127-5p、miR-369-3p、miR-544a 与miR-655-3p表达显著上调,提示这些miRNAs 可共同调控靶基因从而介导肿瘤细胞黏附、侵袭及迁移作用(cell adhesion,cell invasive and cell motility,AIM)。过表达miR-369-3p、miR-544a 及miR-655-3p 后,寡转移细胞间黏附显著抑制,且四种miRNAs 均可明显抑制寡转移细胞侵袭性,表明14q32.2 区编码miRNAs在调节寡转移细胞表型上有重要作用。以往研究显示,转化生长因子受体2(transforming growth factor beta receptor 2,TGFBR2)、Rho 相关卷曲蛋白激酶2(rho associated coiled-coil containing protein kinase 2,ROCK2)、胞周期蛋白依赖性激酶抑制物(inhibitor of cyclin-dependent kinase,ICK)及钙黏蛋白11(cadherin 11,CDH11)基因参与介导AIM 过程,且这些基因都存在可供miRNA 结合的3′UTR 区。经检测上述基因可作为14q32.2 区编码miRNAs 的靶基因,共同上调寡转移细胞miR-655-3p、miR-544a 与miR-655-3p、miR-127-5p 后,TGFBR2、ICK 及ROCK2、CDH11 基因表达明显抑制,值得注意,单独过表达miR-369-3p 可同时抑制4 种基因表达,提示上述miRNAs可能竞争性抑制促转移基因表达。进一步进行离体及在体实验证实,shRNA 敲低TGFBR2 和ROCK2 基因后,寡转移细胞间黏附力与侵袭力都明显减弱。提示寡转移细胞内可能存在miR-127-5p/miR-544a/miR-655-3p-TGFBR2/ROCK2/ICK/CDH11 信号通路,调节其黏附及侵袭作用,但此通路是否还存在下游靶分子及相关具体通路仍需探讨。
miRNAs 也参与调节寡转移细胞转移。Lussier 等将上调了miR-200c 功能的寡转移细胞植入小鼠后,发现寡转移细胞发生了明显的多灶转移。虽然研究表明miR-200c 在抑制或促进肿瘤转移中都发挥一定作用,但这主要取决于转移所处阶段。由于以往研究显示miR-200c 以抑制转移为主,Lussier 等团队在低转移表型的黑色素细胞瘤细胞内重复验证后,发现了明显的多灶转移,表明miR-200c 可增强寡转移细胞的转移能力。另外,该课题组还发现,在miR-200c功能上调的寡转移细胞中,ZEB1 与ZEB2 mRNA 表达水平明显下调,同样FGD1 与NEDD4 表达水平也明显下调。既往基因预测分析证实,FGD1、NEDD4 是miR-200c 的潜在靶基因。同时有研究报道Zeb1 与Zeb2 基因为miR-200c 特异性下游靶基因,并与miR-200c 表达呈负相关,且NEDD4 也已发现可通过抑制TGF-β 通路抑制EMT。上述结果不仅说明miR-200c 有靶向特异性,也提示miR-200c 可能通过miR-200c-ZEB1/ZEB2 通路或miR-200c-FGD1/NEDD4-EMT 通路调控寡转移进展。Sun 等在其构建的寡转移细胞系中发现,Sec23a 可同样作为miR-200c 的靶基因。且过表达miR-200c 或下调Sec23a都可促进细胞转移及定植。值得注意的是,已鉴定的Sec23a 调控蛋白S100A8 可通过结合B 淋巴细胞瘤-2 基因(BCL2 apoptosis regulator,BCL-2)促进自噬。这提示自噬可能也参与寡转移,为今后研究寡转移提供了新的思路。
3 miRNAs 对寡转移的临床价值
在临床应用上,miRNAs 扮演重要的寡转移分子标记物角色,并发挥潜在的治疗作用。Oshima 等使用纳米配位聚合物(nanoscale coordination polymers,NCP)将寡转移相关miR-655-3p 植入结直肠癌肝转移细胞后,发现肿瘤定植明显减少,寡转移细胞TGFBR2、ICK 基因表达显著降低。Chan 等通过进一步的研究证实,PTTG1、SENP6 表达水平也同样下调。有研究报道,TGFBR2 可激活TGF-β 信号通路,并调控G1/S 期检查点,从而促进肿瘤细胞转移;且下调PTTG1 与SENP6 可分别诱导细胞退出细胞周期及抑制DNA 合成。这提示miRNAs 或可通过调节DNA合成及细胞周期影响寡转移。还发现,与miR-655-3p共培养48 h 后,肝转移细胞核β-catenin 显著下降,以往研究显示,β-catenin 可通过干扰转录而介导肿瘤转移并经Wnt/β-catenin 通路影响EMT。因此这一结果暗示EMT 在寡转移中发挥潜在作用。
随着手术、立体放射治疗(stereotactic body radiotherapy,SBRT)等治疗手段用于治疗寡转移,越来越多的研究发现,寡转移患者在治疗后可获得长期生存。Wong 等发现,miRNAs,如:miR-23b、miR-449a、miR-449b 可预测寡转移患者在立体放射治疗后的肿瘤生物学及临床结果。这意味着miRNAs 将有助于选择可能受益于SBRT 的寡转移患者。miRNAs对预测寡转移患者预后与复发也有重要意义。Uppal等发现,寡转移细胞内miRNAs(miR-655-3p、miR-544a 与miR-655-3p、miR-127-5p)表达情况,与肺转移瘤手术切除后复发时间呈正相关,值得注意,在miRNAs 表达上调的患者中,60%的患者在5年的随访中没有出现转移性复发。同样,Lussier 等检测也发现,多种miRNAs 可区分高进展组和低进展组患者,并预测转移进展及生存情况。这些研究为今后miRNAs 用于寡转移诊断与治疗打下了基础。
4 小结及展望
目前,研究发现在肿瘤寡转移阶段,不同miRNAs在肿瘤细胞增殖、迁移、黏附和EMT 上有相似的生物学效应。同时,多种miRNAs 可为寡转移患者选择合适治疗手段并有效预测患者预后及生存情况。另外,对已发生寡转移患者,及时放疗或手术切除可能明显改善预后。然而,与寡转移理论不同,Halsted 等认为,肿瘤的扩散是有序地从原发肿瘤经淋巴管向远处扩散,系统性假说认为,临床显著性肿瘤是一种全身性疾病。因此Halsted 理论认为根治性切除可以治愈肿瘤,而系统性理论只依赖于全身治疗,且对局部转移疗效有限。不可否认,Halsted 等的理论与系统性理论都在肿瘤治疗中发挥了一定作用,但与之相比,充分认识寡转移并阐明其生物学机制有可能提供更精准的肿瘤诊断和治疗。
虽然现有的研究仍有不足之处,但随着研究的深入及上述问题的解决,miRNAs 在寡转移中的突出作用将为未来的诊断与治疗做出贡献。

