绿芫菁成虫触角中气味结合蛋白和化学感受蛋白基因的鉴定和表达分析
刘盼静, 魏洪义, 郭 坤, 马广源, 张 涛,*
(1. 河北省农林科学院植物保护研究所, 河北保定 071000; 2. 江西农业大学昆虫研究所, 南昌 330045)
昆虫的嗅觉识别过程非常复杂,涉及多种嗅觉相关蛋白的参与,主要包括气味结合蛋白(odorant-binding proteins, OBPs)、化学感受蛋白(chemosensory proteins, CSPs)、嗅觉受体(odorant receptors, ORs)、味觉受体(gustatory receptors, GRs)、离子型受体(ionotropic receptors, IRs)和嗅觉神经元膜蛋白(sensory neuronmembrane proteins, SNMPs)等(Leal, 2013; Guetal., 2015)。当化学信号分子进入感受器淋巴时,OBPs和CSPs等与信号分子结合,并将其运输到神经元膜上的ORs,进而将化学信号刺激转化为电信号。随后,这些信号分子被淋巴腔或传感器细胞中的气味降解酶(odorant degrading enzymes, ODEs)降解(Vogt and Riddiford, 1981; Leal, 2005)。OBPs和CSPs大量存在于触角和口器中,参与多种化学信号的结合和传递(Xuetal., 2019)。OBPs是一类可溶性蛋白质,一般来说,根据保守半胱氨酸(Cys)残基的数量,OBP大概分为至少5种类型:典型的OBPs(classic OBPs)(含有6个保守的Cys残基)、minus-C OBPs(缺少第2位Cys “C2”和第5位Cys “C5”)、plus-C OBPs(多了2个额外的Cys,且第6位Cys“C6”后紧接着1个脯氨酸“P”)、二聚体OBPs(dimer OBPs)(含有两组“典型OBPs Cys残基”)和非典型OBPs(atypical OBPs)(含有9~10个Cys残基并有很长的羧基端)(Zhouetal., 2004; Zhou, 2010; Leal, 2013; Tsitsanouetal., 2013; Ozaki, 2019)。CSPs也是一种小分子的可溶性蛋白质,它有4个高度保守的半胱氨酸残基,形成2个二硫键,在化学感觉器官和非嗅觉组织中均有表达(Maleszkaetal., 2007; Picimbon, 2019)。
绿芫菁Lyttacaraganae属鞘翅目(Coleoptera)芫菁科(Meloidae),广泛分布于我国华北、东北等地区(王海玲, 2013)。绿芫菁食性杂,成虫取食国槐、紫穗槐、苜蓿、黄檗、水曲柳、复叶槭、白蜡、杨树、柳树等植物叶片,为害严重时还可诱发腐烂病等病害;而幼虫则可以取食蝗虫及土蜂的幼虫或卵,是蝗虫等直翅目害虫的天敌(巴合提古丽·也山, 2017; 高鹏飞, 2019)。而目前对于绿芫菁的研究多局限于生物学特性及发生规律,在嗅觉识别方面的研究尚无报道。本研究主要借助转录组测序技术对绿芫菁成虫触角进行生物信息学分析,并筛选参与嗅觉感受的一些重要OBPs和CSPs,为今后绿芫菁嗅觉感受蛋白的作用机制研究奠定基础。
1 材料与方法
1.1 供试昆虫
2018年5月初于河北省保定市满城区苜蓿田采集绿芫菁成虫后带回实验室于25℃下饲养。选取活动能力较强的雌雄成虫各100头,用灭菌水冲洗虫体,70%酒精表面消毒30 s,再用灭菌水冲洗两遍,在冰上迅速切下触角,雌雄分开收集,液氮速冻后保存于-80℃备用。
1.2 总RNA的提取与质量检测
使用TRIzol up试剂(全式金,北京)提取绿芫菁雌雄成虫触角总RNA,用1.0%的琼脂糖凝胶电泳检测总RNA是否有降解,NanoDrop 2000检测RNA的纯度,Agilent 2100精确检测RNA的完整性。使用雌雄成虫各50头的触角RNA进行转录组测序。
1.3 cDNA文库构建与测序
1.5 μg高质量的RNA用于构建cDNA文库,用带有Oligo(dT)的磁珠富集真核生物mRNA,以mRNA为模板合成双链cDNA,并用AMPure XP系统(Beckman-Coulter,Beverly,美国)纯化。在末端修复和接头连接后,优先选择长度为250~300 bp的cDNA片段。在进行PCR前,使用3 μL的USER Enzyme(美国NEB)和大小选定的适配器连接的cDNA预处理(37℃ 15 min;95℃ 5 min)。用Phusion High-Fidelity DNA聚合酶、通用PCR引物和Index(X)引物进行PCR扩增。最后,采用Ampre XP系统纯化PCR产物,并在Agilent Bioanalyzer 2100系统上评估文库质量。cDNA文库构建及测序由北京诺禾致源生物公司完成。
1.4 转录组测序数据组装及基因功能注释
对测序得到的绿芫菁成虫触角原始测序序列或者raw reads进行过滤,去掉含有带接头和低质量的reads,得到clean reads,同时计算Q30(clean data质量值大于或等于30的碱基比例)、GC含量及重复序列水平,并采用Trinity系统(Grabherretal., 2011)对clean reads进行拼接,从而获得高质量的unigenes。利用BLASTn和BLASTx对绿芫菁成虫触角转录组的unigenes在NCBI数据库进行比对,BLAST比对阈值为E-value<10-5,获得基因的功能注释信息。将BLAST结果进一步导入Blast2GO进行GO注释,比对NR, NT, KO, Pfam, Swiss-Prot, GO和KOG七大数据库进行功能注释。
1.5 绿芫菁触角OBP和CSP基因鉴定及序列分析
根据1.4节基因功能注释信息筛选绿芫菁成虫触角转录组中OBP和CSP基因,并获得氨基酸序列,在NCBI数据库进行BLAST比对,确定最终的候选OBP和CSP。 OBP和CSP信号肽预测使用SignalP 5.0在线网站(http:∥www.cbs.dtu.dk/services/SignalP/)。OBP和CSP的序列比对使用ClustalX 1.83软件,比对结果用GeneDoc软件呈现。 从NCBI数据库中下载鞘翅目其他物种(眼斑沟芫菁Hycleuscichorii、大斑沟芫菁Hycleusphaleratus、中欧山松大小蠹Dendroctonusponderosae和赤拟谷盗Triboliumcastaneum的OBP和CSP序列,并使用MEGA 7.0的邻接法(neighbour-joining, NJ)以bootstrap=1 000的参数构建OBP和CSP的进化树,用FigTree v.1.4.3软件对进化树进行美化编辑(Kumaretal., 2016)。
1.6 绿芫菁触角OBP和CSP基因的表达量分析
以拼接得到的转录组作为参考序列,将每个样品的clean reads映射(mapping)到参考序列上,并采用RSEM软件(Li and Dewey, 2011)进行统计,进一步得到了每个样品比对到每个基因上的read count,通过每百万reads中来自某一基因每千碱基长度的reads数目(fragments per kilobase of exon model per million mapped reads, FPKM)方法计算(Trapnelletal., 2010)。
使用1.2节合成的绿芫菁成虫触角RNA,按照All-in-One First-Strand cDNA Synthesis SuperMix 试剂盒(全式金,北京)说明书合成cDNA。雌雄各设置3个生物学重复,每个生物学重复包含15头绿芫菁的触角。用Primer Premier 6.0软件设计具有完整ORF的OBP和CSP基因的特异性引物,以GAPDH(GenBank登录号: MZ703177)为内参基因(表1)。qRT-PCR在ABI7500实时荧光定量PCR仪上进行,反应体系: Tip Green qPCR SuperMix 10 μL, 正反向引物(10 μmo/L)各1 μL, cDNA模板1 μL, ddH2O 7 μL。反应程序: 94℃ 30 s; 94℃ 5 s, 60℃ 15 s, 72℃, 10 s, 40个循环。每样品重复测定3次。

表1 引物信息
1.7 数据分析
采用2-ΔΔCt法分析基因表达量数据,并用SPSS22.0软件进行单因素方差分析(one-way ANOVA)的最小显著性差异法(LSD)进行差异显著性检验,最后用GraphPad Prism 8软件绘图。
2 结果
2.1 绿芫菁成虫触角转录组的测序和组装
使用Illumina HiSeqTM平台构建了绿芫菁雌雄成虫触角的cDNA文库,用Trinity系统进行组装,将转录组测序原始数据上传至SRA数据库,雌雄触角的cDNA文库登录号分别为:SRR15462538和SRR15462539(https:∥www.ncbi.nlm.nih.gov/sra)。数据过滤后从雌雄成虫触角转录组中分别获得57 997 546和48 430 908条clean reads。经拼接和聚类后共获得51 028条transcripts和41 998条unigenes,长度超过2 000 bp的unigenes有16 958条(图1: A)。
2.2 绿芫菁成虫触角转录组基因功能注释
41 998条unigenes中,有30 550条(72.74%), 26 344条(62.72%), 25 841条(61.52%)和24 841条(59.14%)unigenes分别注释到NR, GO, Pfam和Swiss-Prot数据库中(表2)。在7个数据库中都注释到的有5 953条(14.17%)unigenes,至少在1个数据库中注释到的unigenes高达32 391条(77.12%)。将unigenes在NR数据库中进行同源比对,取E-value<1 e-5, 赤拟谷盗中的unigenes匹配度最高(87.3%),其次是中欧山松大小蠹的(3.7%),湿木白蚁Zootermopsisnevadensis的(0.7%),黄粉虫Tenebriomolitor的(0.4%),豌豆蚜Acyrthosiphonpisum的(0.4%),其他物种中的占7.5%(图1: B)。

图1 绿芫菁成虫触角转录组中unigenes和transcripts长度分布(A)及unigenes在NR数据库中的同源物种分布(B)
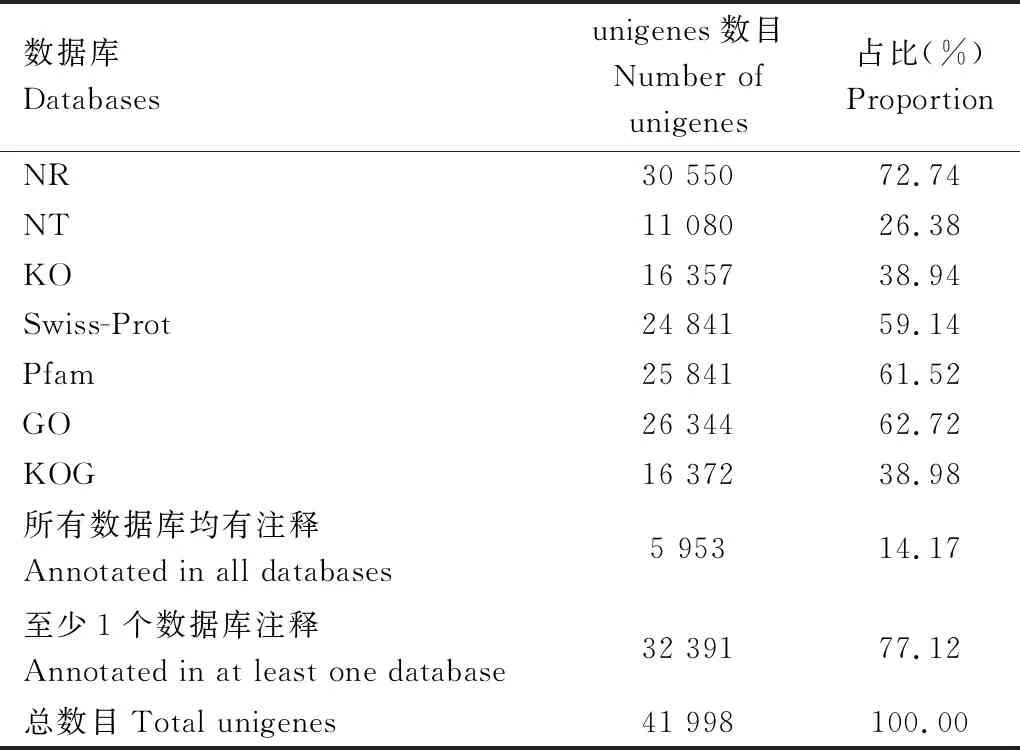
表2 绿芫菁成虫触角转录组unigenes功能注释统计
2.3 绿芫菁成虫触角OBP和CSP基因鉴定及序列特征
通过比对NR, GO, Pfam和Swiss-Prot等数据库的注释信息,共筛选到22个LcarOBP基因和7个LcarCSP基因,并上传至NCBI,登录号为MZ703148-MZ703176(https:∥www.ncbi.nlm.nih.gov/genbank/)。22个LcarOBP基因中有19个具有完整的ORF,其蛋白长度为68~213 aa,18个LcarOBPs具有信号肽(除LcarOBP4, LcarOBP7和LcarOBP21-22)(表3)。氨基酸序列比对结果表明,LcarOBP2-10, LcarOBP15, LcarOBP18-20共13个OBPs具有6个保守的半胱氨酸残基,符合Cys-X25-32-Cys-X3-Cys-X37-48-Cys-X8-11-Cys-X8-Cys的结构,为classic OBPs(图2)。

图2 绿芫菁成虫触角转录组中classic OBPs氨基酸序列比对
绿芫菁的7个LcarCSP基因均具有完整的ORF,蛋白长度在115~276 aa范围内,5个LcarCSPs具有信号肽(LcarCSP3-7)(表3),与眼斑沟芫菁和大斑沟芫菁CSPs的氨基酸序列一致性较高,在60.48%~85.05%范围内。

表3 绿芫菁成虫触角转录组中OBP和CSP基因
2.4 绿芫菁成虫触角OBP和CSP的系统进化
进化树表明,22个OBPs在整个进化树的各个分支都有分布,与同为芫菁科的眼斑沟芫菁和大斑沟芫菁亲缘关系最近,且均聚类在一个分支上。其中,LcarOBP9, LcarOBP10, LcarOBP21和LcarOBP22聚在一个分支上,与大斑沟芫菁的HphaOBP6和HphaOBP8关系较近,其次是与中欧山松大小蠹的DponOBP14和DponOBP32(图3)。

图3 邻接法构建的基于氨基酸序列的绿芫菁成虫触角转录组中LcarOBPs与其他鞘翅目昆虫OBPs的系统发育树(1 000次重复)
80个来自不同物种的CSPs被分成3个大分支,绿芫菁的7个CSPs分散到各个分支上,其中LcarCSP7单独位于一个小分支。LcarCSP1和LcarCSP2聚集到一个分支上,它们与眼斑沟芫菁CSPs的氨基酸序列一致性分别为65.36%和60.48%,并且都与眼斑沟芫菁和大斑沟芫菁亲缘关系最近(图4)。

图4 邻接法构建的基于氨基酸序列的绿芫菁成虫触角转录组中LcarCSPs与其他鞘翅目昆虫CSPs的系统发育树(1 000次重复)
2.5 绿芫菁成虫触角中OBP和CSP基因的表达量
根据FPKM值显示,LcarOBP15和LcarOBP16在绿芫菁触角中的高丰度表达,其次是LcarOBP10,而LcarOBP7则在触角中微量表达(表3)。对19个具有完整ORF的LcarOBP基因进行表达量测定,qRT-PCR结果显示,LcarOBP9和LcarOBP10在雄成虫触角中显著高表达,其中LcarOBP9在雄成虫触角中的表达量比在雌成虫触角中的高8倍,而LcarOBP1,LcarOBP3,LcarOBP5,LcarOBP11-LcarOBP13,LcarOBP15-LcarOBP17和LcarOBP20在雌成虫触角中有较高的表达量,其他几个基因在雌雄成虫触角中的表达量无显著差异(P>0.05)(图5)。
LcarCSP4在绿芫菁雌雄成虫触角中有高丰度表达,其FPKM>1 000(表3)。绿芫菁7个LcarCSP基因的表达量测定结果显示,LcarCSP1和LcarCSP2在雄成虫触角中有较高的表达量,而LcarCSP3-4在雌成虫触角中的表达量较高,其他几个基因的表达量在雌雄成虫触角中无显著差异(P>0.05)(图5)。

图5 绿芫菁雌雄成虫触角中LcarOBP和LcarCSP基因的相对表达量
3 结论与讨论
本研究从绿芫菁成虫触角转录组中共获得8.7 Gb的原始数据,拼接成41 998条unigenes,并将32 391条(77.12%)unigenes注释到NR, NT,KO,Pfam, Swiss-Prot, GO和KOG七大数据库(表2)。部分unigenes未被注释到,其原因可能是在组装拼接过程中有不可避免的错误序列信息,或者是组装过程中一些新基因在所用的数据库中匹配不到(Wangetal., 2010)。
本研究根据注释信息及结构特点,从绿芫菁中鉴定出22个LcarOBPs和7个LcarCSPs,与鞘翅目其他昆虫相比,绿芫菁化学感受蛋白的数量少于赤拟谷盗中鉴定到的50个OBPs和20个CSPs(TriboliumGenome Sequencing Consortium, 2008; Dippeletal., 2014)、中欧山松大小蠹的31个OBPs和11个CSPs(Anderssonetal., 2013),而多于紫榆叶甲Ambrostomaquadriimpressum(16个OBPs,10个CSPs)、黄粉虫(19个OBPs,12个CSPs)和云杉八齿小蠹Ipstypographus(15个OBPs,6个CSPs)(Anderssonetal., 2013; Liuetal., 2015; Wangetal., 2016)。这种数目上的差异可能是复杂的环境变化或基因功能的多样性造成的,或者是因为化学感受相关的基因不仅仅存在于触角中,其他组织器官中也存在,例如有些基因只在幼虫中表达(Engsontiaetal., 2008),因此更多的嗅觉基因的挖掘需要进一步补充其他组织转录组或者从基因组水平上鉴定基因。
不同种类的昆虫OBPs在序列上相似性较低,但大多数的OBPs含有6个高度保守的Cys残基,形成3个稳定的二硫键结构,次级结构一般折叠形成6个α-螺旋,从而形成圆锥形的空腔来结合气味分子(Zhou, 2010; Leal, 2013; 杨海博等, 2018)。而重要的氨基酸突变会影响蛋白结构,从而影响与配基结合能力,有研究表明,在西方蜜蜂Apismellifera中,保守的Cys和能形成氢键的特定位置氨基酸改变对蛋白结合能力有重要的影响作用(Spinellietal., 2012; 吴帆等, 2021)。本研究从绿芫菁成虫触角转录组中鉴定到的22个LcarOBPs中,其中有13个LcarOBPs具有6个保守的Cys位点,属于classic OBPs,这些保守的Cys残基将有助于形成稳定的二硫键,从而有利于蛋白与气味分子的特异性识别(Vieira and Rozas, 2011),其具体的嗅觉识别功能还有待进一步的研究与验证。此外,本研究中尚未鉴定到plus-C OBPs,而与绿芫菁同源关系较近的赤拟谷盗中鉴定到1个(TcasOBP5E),中欧山松大小蠹中鉴定到1个(DponOBP2),云杉八齿小蠹鉴定到3个(ItypOBP2FIX和ItypOBP10),绿芫菁中plus-C OBPs的缺失可能是鞘翅目化学感受器的一个特殊进化事件,或者是转录组中不可避免的错误序列信息造成的(Anderssonetal., 2013; Liuetal., 2015)。
绿芫菁OBPs与其他鞘翅目昆虫的OBPs构建的系统进化树(图3)表明,多数LcarOBPs的分布较为集中,如LcarOBP9/LcarOBP10/LcarOBP21/LcarOBP22, LcarOBP16/LcarOBP17, LcarOBP18/LcarOBP19聚集在一支,说明绿芫菁OBPs在种内的分化较小。LcarOBP9/LcarOBP10/LcarOBP21/LcarOBP22与赤拟谷盗的TcasOBP5F/5G/5H在同一个大分支,表明这些基因起着同源化学感受作用,而有研究表明这一类基因属于ABPII基因,它们主要在触角中表达,在嗅觉识别中起着重要作用(Dippeletal., 2014)。此外,昆虫OBPs在雌雄成虫中普遍存在偏向表达,这可能与雌雄成虫在生命活动中各自承担的角色不同有关,比如在甘薯蚁象Cylasformicarius中,CforOBP1-3在雄虫触角中高表达,并通过RNA干扰实验证明了沉默上述基因的甘薯蚁象丧失了部分定位性信息素和寄主植物挥发物的能力(Huaetal., 2021)。本研究发现,绿芫菁LcarOBP9和LcarOBP10在雄成虫触角中的表达量高于雌成虫触角中的(图5),这些基因可能在交配或与寄主互作时可能会发挥重要作用,还需要后期的荧光竞争结合实验和RNA干扰实验进一步验证。
本研究首次构建了绿芫菁的雌雄成虫触角转录组数据库,成功注释了绿芫菁成虫触角转录组相关基因的功能信息,丰富了鞘翅目昆虫基因数据库;成功筛选得到了部分嗅觉相关基因,并初步探讨了气味结合蛋白OBPs和化学感受蛋白CSPs在鞘翅目昆虫中的分子系统发育关系以及在雌雄成虫触角中的表达情况,为绿芫菁嗅觉机制的进一步研究提供了理论基础。

