AA-PR8冷适应流感病毒疫苗株在小鼠中的保护作用
徐康维,郭航炜,李星星,谢莹,权娅茹,赵慧,李长贵
中国食品药品检定研究院国家卫生健康委员会生物技术产品检定方法及其标准化重点实验室 国家药品监督管理局生物制品质量研究与评价重点实验室,北京 102629
流感病毒是一种重要的呼吸道病原体,能够引起季节性流感和大流行流感,严重危害人类健康。季节性流感在全球每年造成5%~15%的人口感染,并导致300万 ~500万的严重病例和25万 ~50万的死亡病例[1]。接种流感疫苗是目前预防流感最有效的手段[2-4]。目前广泛应用的主要有流感病毒裂解疫苗、重组蛋白疫苗和冷适应流感减毒活疫苗等[5-7]。其中冷适应流感减毒活疫苗采用鼻腔喷雾方式进行接种,病毒在上呼吸道黏膜局部复制,不仅能诱导体液免疫产生IgG抗体,还能产生分泌型IgA抗体,形成预防感染的第一道防线[8],并且能够有效激发T细胞免疫,从而对不同的流感病毒毒株产生一定的交叉保护[9-11]。在前期研究中,本实验室采用反向遗传技术,以A/Ann Arbor/6/60(H2N2)冷适应流感病毒内部6基因为骨架,与PR8病毒HA、NA基因共同进行病毒拯救,制备了AAPR8冷适应流感病毒疫苗株[12]。本研究对该疫苗株在小鼠中的免疫原性及保护效果进行评价。
1 材料与方法
1.1 病毒A/Puerto Rico/8/34(H1N1)株流感病毒(简称PR8流感病毒)、AA-PR8冷适应流感病毒疫苗株(简称AA-PR8疫苗株)由中国食品药品检定研究院呼吸道病毒疫苗室保存。
1.2 实验动物9~11日龄SPF鸡胚,购自北京勃林格殷格翰维通生物技术有限公司;SPF级BALB/c小鼠,雌性,4~6周龄,体重13~15 g,由中国食品药品检定研究院提供,并在ABLS-2实验室进行试验操作,动物生产许可证号:SCXK(京)2019-0017,动物使用许可证号:SYXK(京)2017-0013。本实验均以科研为目的进行小鼠的养殖和使用,且进行了实验动物伦理审查[中检动(福)第2022(B)004号]。
1.3 主要试剂及仪器HRP标记的山羊抗小鼠IgG购自北京义翘神州科技有限公司;HRP标记的山羊抗小鼠IgA购自美国Abcam公司;BSA购自美国Sigma公司;Leibovitz′s L-15培养基购自美国Gibco公司;96孔酶标板购自美国Corning公司;酶标仪购自美国TECAN公司。
1.4 小鼠免疫 将AA-PR8疫苗株病毒浓度稀释至106EID50/50 μL。采用异氟烷对BALB/c小鼠进行麻醉后,左右两个鼻孔各滴入25 μL AA-PR8疫苗株进行免疫。第1次免疫后21 d,采用相同方法进行第2次免疫。阴性对照组左右两个鼻孔各滴入25 μL PBS。分别于第1次免疫后0、7、14、21、28、35和42 d,各取5只小鼠,经眼眶采血分离血清,处死后,用800 μL PBS灌洗小鼠肺脏,收集肺泡灌洗液。检测血清和肺泡灌洗液中IgG和IgA抗体效价。
1.5 IgG和IgA抗体效价检测 采用间接ELISA法。将AA-PR8疫苗株稀释106倍后接种SPF鸡胚,200 μL/枚,33℃孵箱培养48 h,收集尿囊液,采用蔗糖密度梯度离心进行纯化,获得纯化的AAPR8病毒,用PBS将其稀释200倍后,加入酶标板,100 μL/孔,4℃包被过夜;PBS-T(含0.25‰吐温20的PBS)洗涤3次,加入封闭液(1%BSA,含0.25‰吐温20的PBS),200 μL/孔,室温封闭1 h。将小鼠血清用封闭液100倍稀释后,2倍系列稀释至12 800倍,加至封闭后的酶标板,100 μL/孔,以100倍稀释的阴性小鼠血清作为对照;将小鼠肺泡灌洗液用封闭液10倍稀释后,2倍系列稀释至1 280倍,加至封闭后的酶标板,100 μL/孔,以10倍稀释的阴性小鼠肺泡灌洗液作为对照,37℃培养箱孵育1.5 h;PBS-T洗涤3次,加入HRP标记的山羊抗小鼠IgG(1∶10 000稀释)或山羊抗小鼠IgA(1∶10 000稀释),37℃培养箱孵育1 h;PBS-T洗板5次,加入TMB显色液,室温显色15 min;加入0.5 mol/L硫酸溶液终止反应,读取A450/630值。以阴性对照孔A450/630值的2.1倍作为Cut-off值,样品A450/630值 ≥Cut-off值的最高稀释倍数定为效价。IgG抗体效价低于100按50计算,IgA抗体效价低于10按5计算。
1.6 小鼠攻击保护效果评价 将小鼠按照1.4项所述方式和剂量,采用1次免疫或0、14 d 2次免疫的程序,以PBS作为阴性对照。分别在第1和2次免疫后14 d将小鼠麻醉,采用5倍小鼠半数致死剂量(5 MLD50/50 μL)的PR8流感病毒左右两个鼻孔各滴入25 μL进行攻击。每组取6只小鼠每日观察体重变化及死亡情况,共观察14 d。每组取5只小鼠在攻击后第3天处死取肺脏,加入9倍肺脏体积的Leibovitz′s L-15培养基匀浆后,接种鸡胚检测病毒滴度。
1.7 统计学分析 使用GraphPad Prism 8和Excel 2010软件绘图并进行数据分析,两组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 免疫后小鼠血清IgG抗体效价 小鼠第1次免疫后7 d,即可检测到特异性IgG抗体,GMT为152;第14和21天抗体持续升高,GMT分别为230和264。第1次免疫后21 d进行加强免疫,抗体水平继续升高,第2次免疫后7、14和21 d IgG抗体GMT分别达到348、919和1 056。2次免疫后均在14 d内抗体效价增长较快,而21 d抗体效价较14 d仅略有增长。第2次免疫后抗体水平显著高于第1次免疫后,其中第2次免疫后14 d IgG抗体GMT为第1次免疫后14 d的4倍。见图1。
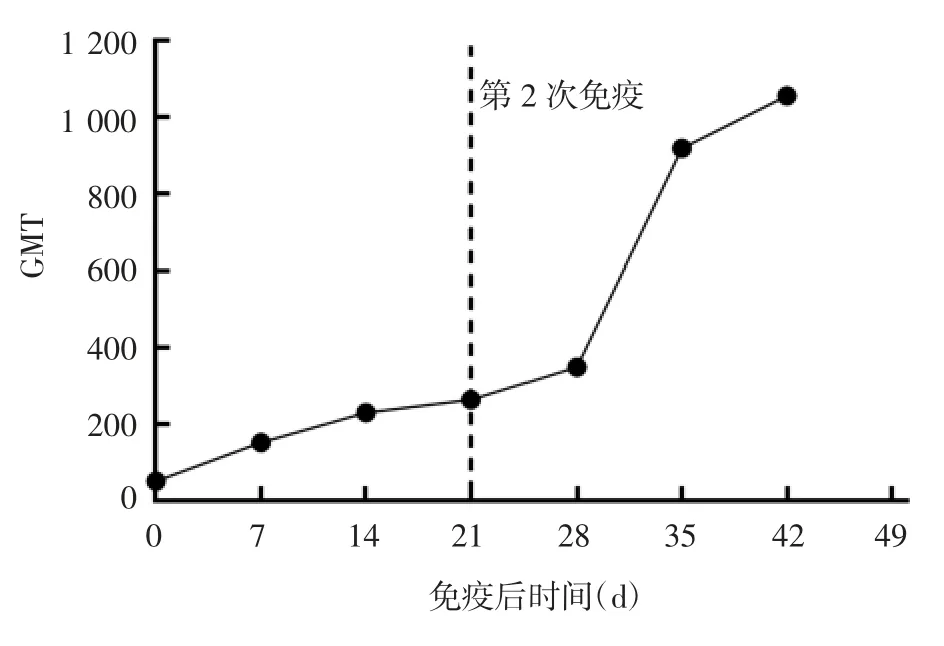
图1 免疫后小鼠血清IgG抗体效价Fig.1 Serum IgG titer in immunized mice
2.2 免疫后小鼠肺泡灌洗液IgA抗体效价 小鼠第1次免疫后7 d,可检测到特异性IgA抗体,GMT为23;第14天GMT升高至211,而在第21天GMT降低为92。第1次免疫后21 d进行加强免疫,第2次免疫后7 d GMT为53,未见升高,第14天GMT升高至368,第21天GMT降低为160。2次免疫后IgA抗体效价均在第14天达到最高值,第21天较第14天降低。第2次免疫后同时间抗体水平均高于第1次免疫后,第2次免疫后14 d IgA抗体GMT为第1次免疫后的14 d的1.7倍。见图2。
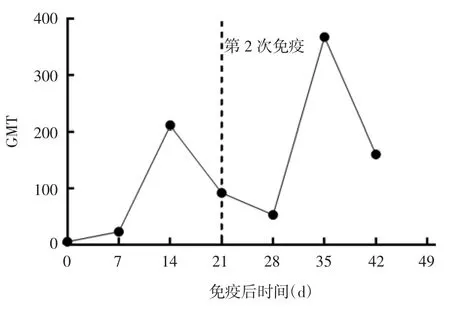
图2 免疫后小鼠肺泡灌洗液IgA抗体效价Fig.2 Titers of IgA in alveolar lavage fluid of immunized mice
2.3 攻击后小鼠死亡及体重变化情况 小鼠1次免疫后14 d,采用PR8流感病毒进行攻击,攻击后第9天,阴性对照组6只小鼠全部死亡,攻击后第8天,免疫组6只小鼠死亡1只,保护率为83.33%(5/6),见图3A。对照组小鼠攻击后体重持续降低,至攻击后第8天,体重降低达25%,而免疫组小鼠在攻击后7 d内体重降低,第7天体重平均降低14%,之后逐渐增长,至攻击后第14天恢复至97%攻击前体重。见图3B。
0、14 d对小鼠进行2次免疫,第2次免疫后14 d,采用PR8流感病毒进行攻击,攻击后第8天,阴性对照组6只小鼠全部死亡,而免疫组6只小鼠全部健存,保护率为100%(6/6),见图3C。阴性对照组小鼠攻击后体重持续降低,至攻击后第7天,体重降低达24%。而免疫组小鼠在攻击后前3 d体重降低,第3天体重平均降低2%,之后逐渐增长,在攻击后第5天体重恢复至攻击前水平,见图3D。
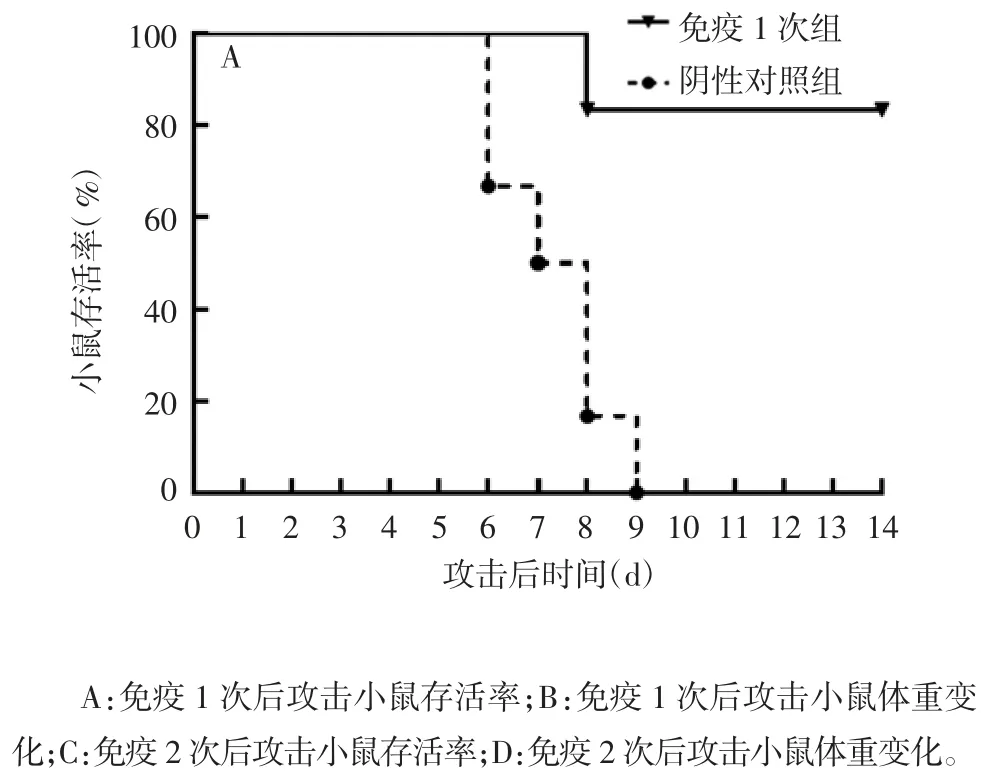
图3 PR8流感病毒攻击后小鼠存活率及体重变化Fig.3 Survival rate and bodyweight change of mice challenged with PR8 influenza virus
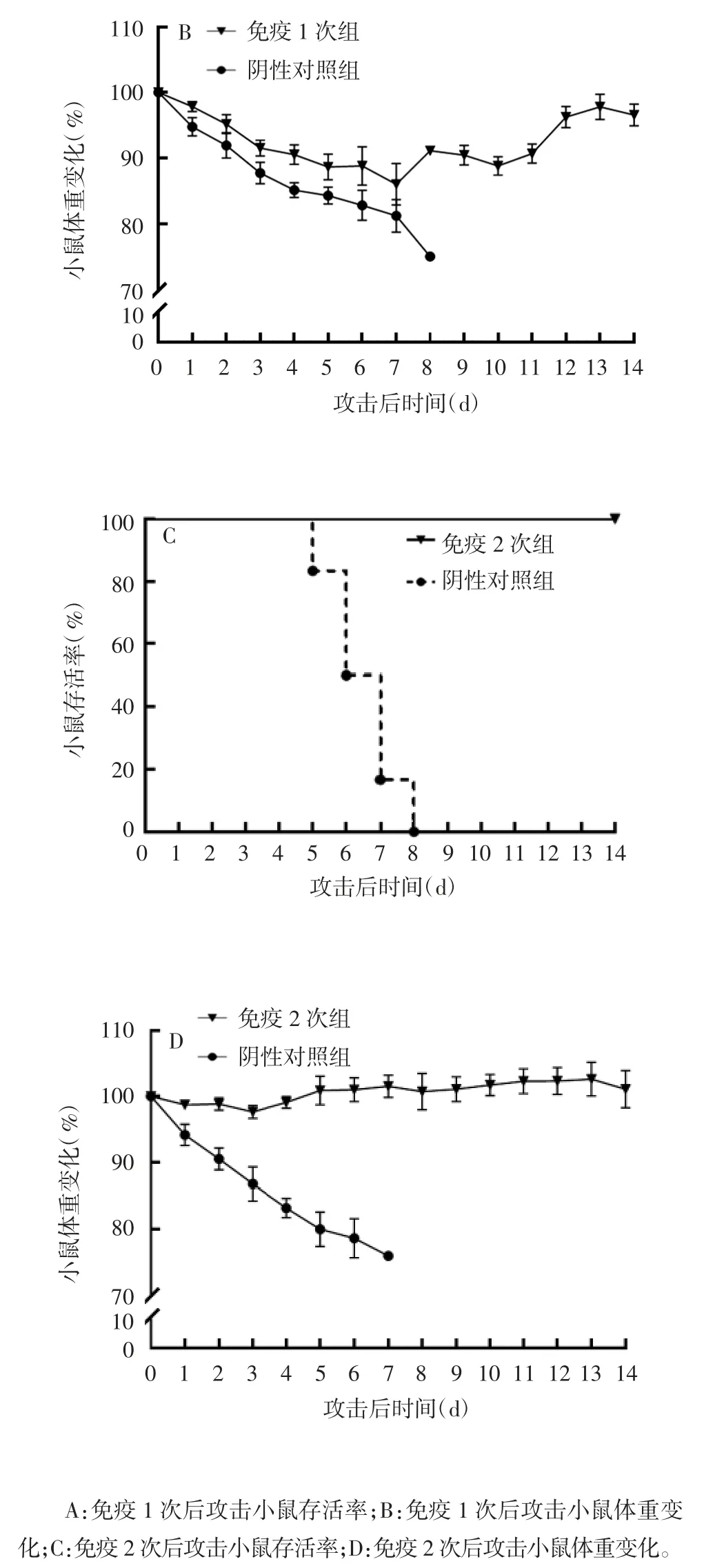
续图3 PR8流感病毒攻击后小鼠存活率及体重变化Fig.3(Continued)Survival rate and bodyweight change of mice challenged with PR8 influenza virus
2.4 攻击后小鼠肺脏病毒载量 免疫1次后攻击,免疫组小鼠肺脏病毒载量平均值为2.30 lgEID50/g,阴性对照组小鼠为6.01 lgEID50/g,免疫后病毒载量较阴性对照组降低5 128倍(t=19.35,P<0.000 1)。免疫2次后攻击,免疫组5只小鼠肺脏中均未检测到病毒,而阴性对照组小鼠病毒载量为5.82 lgEID50/g(t=36.61,P<0.000 1)。见图4。
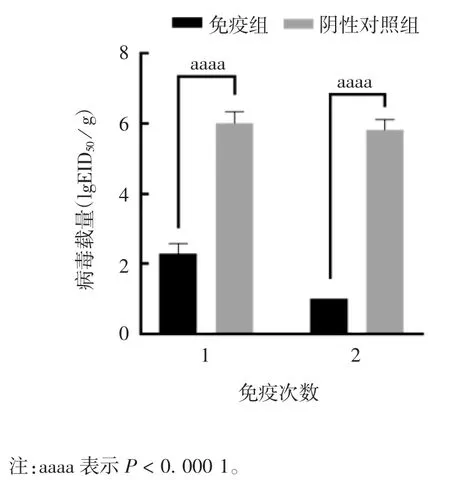
图4 攻击后小鼠肺脏病毒载量Fig.4 Lung viral loads of mice after challenge
3 讨论
流感病毒裂解疫苗为目前应用最为广泛的流感疫苗,通过肌肉注射方式接种,使人体产生血清IgG为主的保护性抗体,通常以血凝抑制或微量中和试验方法进行检测[13]。冷适应流感减毒活疫苗采用鼻腔喷雾方式进行接种,病毒能够在温度较低的上呼吸道进行复制,而在温度较高的下呼吸道不能复制,产生有限程度的感染。相比于裂解疫苗,冷适应疫苗的血凝抑制抗体效价较低,但能够诱导产生分泌型IgA抗体发挥对机体的保护作用[8]。动物实验通常采用小鼠模型[14-16],因此,本研究对小鼠进行免疫后,采用灵敏度较高的间接ELISA法检测小鼠血清IgG和肺泡灌洗液IgA抗体效价,对AA-PR8冷适应流感病毒疫苗株在小鼠中的免疫原性进行评价。结果显示,小鼠第1次免疫后7 d,即可检测到血清IgG抗体,第14和21天抗体效价持续升高;加强免疫后,IgG抗体效价进一步升高,第2次免疫后21 d GMT约达到第1次免疫后21 d的4倍。第1次免疫后7 d,小鼠肺泡灌洗液同样可检测到IgA抗体,第14天GMT达到最高,而第21天GMT降低至约14 d的1/2;第2次免疫后14 d GMT约为第1次免疫后14 d的1.5倍,第21天GMT再次降低至约14 d的1/2,表明IgA抗体的持久性较IgG差。
本研究还评价了AA-PR8疫苗株在小鼠中对同株流感流感病毒的保护作用,采用1次免疫或0、14 d 2次免疫的程序,免疫后14 d用5倍半数致死剂量的PR8流感病毒进行攻击。结果显示,1次免疫即可使83.33%的小鼠获得保护,体重降低幅度明显低于阴性对照组,且在攻击后第3天,肺脏病毒载量较阴性对照组降低约5 000倍。2次免疫程序保护率为100%,全部小鼠在经受致死剂量病毒攻击后存活,攻击后前3 d体重仅降低2%,第5天即恢复至攻击前水平;攻击后第3天,肺脏中未检测到流感病毒,表明已完全阻断了PR8流感病毒对小鼠下呼吸道的侵袭。
综上所述,AA-PR8疫苗株能够激发小鼠体液免疫和黏膜免疫,具有良好的免疫原性,且能够保护小鼠在经受致死剂量的同株流感流感病毒攻击后存活,可作为冷适应流感减毒活疫苗的候选疫苗株。

