土壤中三价锑的老化对秀丽隐杆线虫毒性的影响
宋子杰,赵 龙,党秀丽,侯 红,蔡世鑫,王京原
1. 中国环境科学研究院,环境基准与风险评估国家重点实验室,北京 100012
2. 沈阳农业大学土地与环境学院,农业农村部东北耕地保育重点实验室,土肥高效利用国家工程研究中心,辽宁 沈阳 110866
作为类金属元素,锑(Sb)在阻燃、铅合金、对苯二甲酸二甲酯生产等领域得到了广泛应用[1-2]. 未受污染的天然土壤中,Sb 以相对较低的浓度(0.3~8.6 mg/kg)存在[3]. 然而,随着采矿冶炼作业、化石燃料燃烧、含Sb 产品生产应用等一系列人类活动的开展,土壤环境中的Sb 浓度急剧上升[4]. Sb 不具备生物学功能且对生物体具有毒害作用,被美国环境保护局视为优先污染物[5-6]. 中国作为世界Sb 储量最大的国家(占全球78%的Sb 产能)[7],土壤Sb 污染形势尤为严峻. 莫昌琍等[8]在湖南省锡矿山冶炼厂周边调查发现,土壤中Sb 平均含量高达6 070.08 mg/kg.
土壤Sb 污染引起了国内外研究者的关注,并陆续开展了一系列Sb 的生态毒性研究. 林祥龙等[9]研究土壤外源Sb(Ⅲ)对白符跳的毒性,结果显示,经过7 d 老化的北京潮土中外源Sb(Ⅲ)对白符跳慢性致死毒性的LC50(50%致死浓度)值和慢性繁殖毒性的EC50(50%效应浓度)值分别为703 和307 mg/kg. Lin等[10]研究表明,经Sb(Ⅲ)处理后老化1 d 的黑龙江黑土和重庆紫土对大麦根伸长毒性的EC50值分别为5 561 和5 958 mg/kg. 多数Sb 毒性研究没有考虑长时间老化对土壤中外源Sb(Ⅲ)毒性的影响. 林蕾等[11]研究发现,随着老化时间的推移,Zn 对小白菜的生长毒性和有效态Zn 浓度均呈下降趋势. Lock 等[12]研究指出,利用未经老化处理的重金属污染物进行生物毒性测试会在一定程度上高估土壤中重金属的毒性. 三价锑〔Sb(Ⅲ)〕和五价锑〔Sb(Ⅴ)〕是土壤中Sb 的主要氧化态[6],已有研究[13]指出,Sb(Ⅲ)的生物毒性高于Sb(Ⅴ),但土壤环境中的Sb 以Sb(Ⅴ)为主. 如果不充分考虑Sb(Ⅲ)进入土壤环境后的价态变化会误判其对生物的真实毒性. 此外,土壤性质对重金属的毒性和老化过程同样存在影响. 何飞等[14]研究指出,土壤有机质、全氮、阳离子交换量、铁、锰是影响外源Sb(Ⅲ)对甘蓝根伸长毒性的主要因素. 孙硕等[15]研究发现,土壤性质的不同会导致重金属老化过程的差异,EDTA 提取态Pb 浓度与土壤pH 和电导率均具有极显著的相关性.
得益于短生命周期和易培养的优势,模式生物秀丽隐杆线虫(Caenorhabditis elegans)被广泛应用于生物毒性测试. Höss 等[16]对22 种具有不同性质和污染模式的土壤以及9 种无污染的参考土壤进行了基于ISO 10872 指南的线虫毒性测试,结果表明,该方法适用于测试土壤中污染物的毒性. Kim 等[17]研究显示,土壤中Cd、Cu、Ni、Zn 浓度分别达637、429、744、669 mg/kg 时,线虫的后代个体数量均降低50%,并指出基于ISO 10872 指南的毒性测试是评价土壤污染物毒性的一种简单快速方法.
相较发达国家,我国土壤环境基准研究相对滞后[18],没有充分考虑土壤污染物对不同生态受体的毒性[19]. 目前,围绕土壤中Sb 对生物毒性的测试多以陆生植物、蚯蚓、跳虫为受试生物[14,20-21],有关Sb 对土壤线虫毒性的研究较为鲜见,从而导致研究基础数据较为匮乏,不能较好地服务于土壤环境基准研究. 因此,该研究选用2 种性质的农田土壤(安徽黄棕壤和新疆灰漠土),以秀丽隐杆线虫为受试生物,研究7和56 d 老化对土壤中外源Sb(Ⅲ)的价态变化、可提取态Sb 浓度以及对线虫毒性的影响,探讨不同土壤中外源Sb(Ⅲ)老化过程的差异,以期为我国土壤基准研究以及Sb 污染风险管控提供理论依据和数据支撑.
1 材料与方法
1.1 供试材料
1.1.1 供试试剂
该研究选用酒石酸锑钾(C8H4K2O12Sb2·3H2O)作为外源Sb(Ⅲ)化合物,其为分析纯(>99%)白色粉末状固体颗粒,购自上海麦克林生化科技有限公司.
1.1.2 供试土壤
该研究选用的黄棕壤和灰漠土分别采集自安徽省宣城市(安徽黄棕壤)和新疆维吾尔自治区乌鲁木齐市的农田表层(0~20 cm)(新疆灰漠土),土壤于自然条件下风干,过2 mm 尼龙筛网后备用. 土壤性质及测定方法如表1 所示.

表1 土壤性质及测定方法Table 1 Soil properties and determination methods
1.1.3 供试生物
该研究选用秀丽隐杆线虫(Caenorhabditis elegansvar. Bristol,strain N2)和 大 肠 杆 菌(Escherichia coli,strain OP50)作为毒性测试生物和食物源,均购自福建上源生物科技有限公司.
1.2 试验方法
1.2.1 土壤中外源Sb(Ⅲ)的添加和老化
土壤中外源Sb(Ⅲ)的添加通过喷洒酒石酸锑钾溶液的方式进行,使土壤中的理论总Sb 浓度分别达400、800、1 600、3 200、6 400 mg/kg,对照组土壤中仅添加去离子水. 充分搅拌使土壤与酒石酸锑钾溶液混匀,调节土壤含水量至田间持水量的55%~60%,装入自封袋中进行老化并取土壤样品测定实际总Sb 浓度,老化过程中通过称重法补充去离子水以维持土壤含水量. 经过7 和56 d 的老化后,取土壤样品测定不同价态Sb 和可提取态Sb 浓度,并进行土壤中外源Sb(Ⅲ)对线虫毒性的测试.
1.2.2 线虫毒性测试
1.2.2.1 线虫的培养和同步化
食物源的培养:接种单克隆大肠杆菌菌株至LB培养基(称取0.5 g 酪蛋白胨、0.5 g NaCl、0.25 g 酵母抽提物溶解于50 mL 去离子水中,121 ℃蒸汽灭菌后冷却备用),振荡培养(37 ℃,160 r/min)17 h 后,备用于线虫的培养和毒性测试.
线虫的培养:线虫在20 ℃条件下生长于线虫生长培养基(nematode growth-medium,NGM)琼脂(称取6.8 g 琼脂粉、1.2 g NaCl、1.0 g 酪蛋白胨溶解于300 mL 去离子水中,121 ℃蒸汽灭菌后冷却至55 ℃,加入0.4 mL 1 mol/L CaCl2溶液、0.4 mL 1 mol/L MgSO4溶液、10 mL 1 mol/L pH=6.0 的KH2PO4溶液和0.4 mL 5 g/L 的胆固醇乙醇溶液,用无菌水定容至400 mL 后,转移15~20 mL 琼脂至培养皿冷却备用),通过更换接种有大肠杆菌的NGM 琼脂以维持线虫的生存.
线虫的同步化:经过约72 h 的培养,NGM 琼脂表面分布大量的线虫幼虫,用M9 培养基(称取6 g Na2HPO4、5 g NaCl、3 g KH2PO4和0.25 g MgSO4·7H2O溶解于1 000 mL 去离子水后备用)将琼脂表面的线虫冲洗至管口布置有5 μm 尼龙筛网的离心管内,利用线虫不同生长时期的体型差异过滤出同步的一龄期线虫幼虫,备用于线虫毒性测试.
1.2.2.2 线虫的毒性暴露和回收
根据ISO 10872 指南[26]和文献[27]进行线虫的毒性暴露和回收. 转移0.5 g 的风干土壤样品至培养板的测试孔中,添加100 μL 大肠杆菌菌液(15 mg/mL)与土壤样品充分混合,并调节土壤含水量至田间持水量的80%,以满足毒性暴露期间线虫对食物和水分的需求. 通过毛细管向土壤样品中添加10 条同步的一龄期线虫幼虫后密封培养板. 在20 ℃无光照条件下中进行96 h 的毒性暴露. 毒性暴露完成后,向培养板中添加500 μL 0.3 g/L 的虎红(C20H2Cl4I4Na2O5)溶液以染色线虫角质层,将培养板置于电热鼓风干燥箱中,通过高温(80 ℃)杀死线虫以终止毒性测试. 通过液态氧化硅悬浮法将培养板中的线虫回收于离心管内低温(4 ℃)保存,备用于生长量、生育率、繁殖数的测定. 每个试验处理设置3 次重复.
1.2.2.3 线虫生长量、生育率和繁殖数的测定
将回收于离心管内的线虫倒入培养皿中,在显微镜下完成线虫躯体长度测量、生育能力检查(线虫躯体内至少有一颗虫卵,则被认为具备生育能力)、个体数量计数后,计算线虫的生长量、生育率、繁殖数.
生长量计算公式:
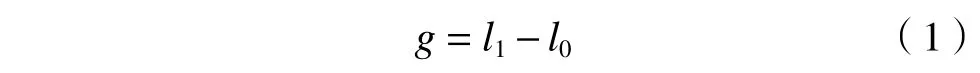
式中:g为 线虫的生长量,μm;l1为毒性测试结束时的线虫体长,μm;l0为毒性测试开始时的线虫体长,μm.取30 条一龄期线虫幼虫体长的平均值作为毒性测试开始时的线虫体长〔(274.2±7.5) μm〕.
生育率计算公式:
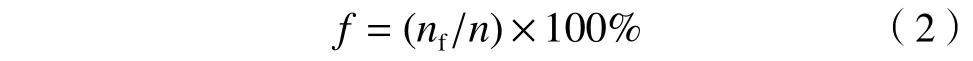
式中:f为线虫生育率,%;nf为具备生育能力的线虫数量,条;n为引入毒性测试的线虫数量,条.
繁殖数计算公式:
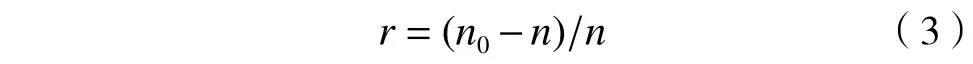
式中:r为线虫繁殖数,条;n0为回收的线虫数量,条.
1.2.3 土壤中Sb 浓度的测定
实际总Sb 浓度的测定参考Fan 等[24]研究,称取0.1 g 风干的土壤样品于消解管内,添加8 mL HF-HClO4-HNO3(三者体积比为3∶1∶1)混合液体,微波消解(180 ℃) 45 min 后赶酸,经过0.5% HNO3溶液适当稀释后,利用电感耦合等离子体发射光谱仪(IRIS Advantage 型,Thermo Electron Corporation,美国)测定溶液中的Sb 浓度.
可提取态Sb 浓度的测定参考Ettler 等[28]研究,称取1 g 风干的土壤样品于离心管内,添加10 mL 1 mol/L Na2HPO4溶液,振荡(25 ℃和200 r/min)2 h后离心(4 000 r/min)10 min,上层清液过0.45 μm 滤膜后,利用电感耦合等离子体质谱仪(Agilent 7500 型,安捷伦科技有限公司,美国)测定滤液中的Sb 浓度.
不同价态Sb 浓度的测定参考文献[29],称取0.5 g 风干土壤样品于离心管内,添加5 mL 0.1 mol/L C6H8O7溶液,振荡(60 ℃和200 r/min)30 min 后离心(4 000 r/min)10 min,上层清液过0.45 μm 滤膜后,通过原子荧光光度计(AFS-920,北京吉天仪器有限公司)测定滤液中的Sb(Ⅲ)和Sb(Ⅴ)浓度.
1.3 数据处理与分析
试验数据的统计分析通过SPSS 22.0 软件进行,土壤总Sb 浓度实测值与线虫生长量、生育率、繁殖数间剂量效应方程的拟合以及毒性阈值(EC50值)的计算通过Sigmaplot 14.0 软件进行,图和表的绘制分别通过Origin Pro 2021 和Excel 2020 软件进行.
2 结果与分析
2.1 老化过程中外源Sb(Ⅲ)的价态变化
由图1 可见,安徽黄棕壤和新疆灰漠土中Sb(Ⅴ)在总Sb 的占比均随Sb(Ⅲ)处理浓度的上升而降低. 经过7 d 的老化,各Sb(Ⅲ)处理浓度下新疆灰漠土中Sb(Ⅴ)的占比均高于安徽黄棕壤,在Sb(Ⅲ)处理浓度为800 和1 600 mg/kg 时达极显著水平(P<0.01),在Sb(Ⅲ)处理浓度为6 400 mg/kg 时达显著水平(P<0.05). 与7 d 老化相比,经过56 d 老化的安徽黄棕壤和新疆灰漠土中Sb(Ⅴ)的占比均出现极显著提升(P<0.01). Sb(Ⅲ)处理浓度(400 和800 mg/kg)较低时,安徽黄棕壤和新疆灰漠土中的Sb 主要以Sb(Ⅴ)形态存在;Sb(Ⅲ)处理浓度为1 600、3 200、6 400 mg/kg 时,新疆灰漠土中Sb(Ⅴ)的占比显著(P<0.05)或极显著(P<0.01)高于安徽黄棕壤. 综上,土壤中Sb(Ⅲ)的氧化效率与Sb(Ⅲ)的处理浓度、老化时间以及土壤性质有关.
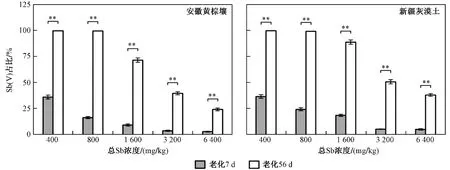
图1 不同老化时间的安徽黄棕壤和新疆灰漠土中Sb(Ⅴ)占总Sb 比例Fig.1 Proportion of Sb(Ⅴ) in total Sb in Anhui yellow-brown soil and Xinjiang grey dessert soil with different aging time
2.2 老化过程中可提取态Sb 浓度的变化
由图2 可见:整体而言,土壤可提取态Sb 浓度随Sb(Ⅲ)处理浓度的提高呈上升趋势. 经过7 d 的老化,新疆灰漠土中可提取态Sb 浓度显著高于安徽黄棕壤(P<0.05). 经过56 d 的老化,经3 200 和6 400 mg/kg 处理的安徽黄棕壤中可提取态Sb 浓度分别出现显著(P<0.05)和极显著(P<0.01)的降低;经800 mg/kg 处理的新疆灰漠土中可提取态Sb 浓度出现显著(P<0.05)的降低;Sb(Ⅲ)处理浓度为1 600、3 200 和6 400 mg/kg 时,新疆灰漠土中可提取态Sb 浓度出现极显著(P<0.01)的降低,Sb(Ⅲ)处理浓度相同时新疆灰漠土中可提取态Sb 浓度仍高于安徽黄棕壤. 结果表明,土壤中可提取态Sb 的提取比例与老化时间及土壤性质有关.
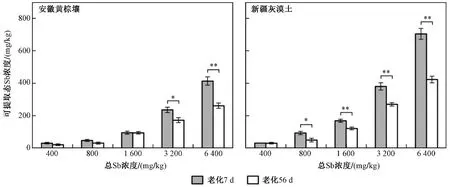
图2 不同老化时间的安徽黄棕壤和新疆灰漠土中可提取态Sb 浓度Fig.2 Extracted Sb concentration in Anhui yellow-brown soil and Xinjiang grey dessert soil with different aging time
2.3 老化土壤中Sb 对线虫的毒性
根据ISO 10872 指南中关于线虫毒性测试的有效性标准进行毒性测试结果的检验. 由表2 可见,该研究的线虫毒性测试结果符合有效性标准.
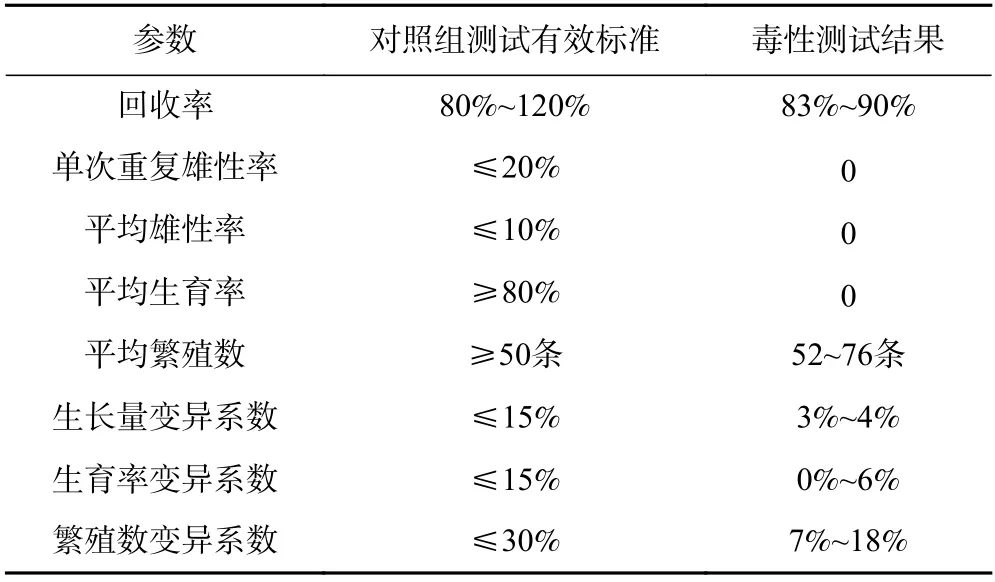
表2 毒性测试有效性Table 2 Validity of toxicity test
2.3.1 老化土壤中Sb 对线虫的生长毒性
由图3 可见:总Sb 浓度为6 400 mg/kg 时,经过7 d 老化的安徽黄棕壤和新疆灰漠土中线虫的生长量均不足各对照组的10%;而老化56 d 时,线虫的生长量分别为各对照组的41.2%和17.7%. 根据外源Sb(Ⅲ)对线虫生长毒性的EC50值以及老化因子(见表3)可以发现,经过7 和56 d 老化处理的安徽黄棕壤中,外源Sb(Ⅲ)对线虫的生长毒性低于新疆灰漠土,新疆灰漠土中外源Sb(Ⅲ)表现出更明显的老化效应.
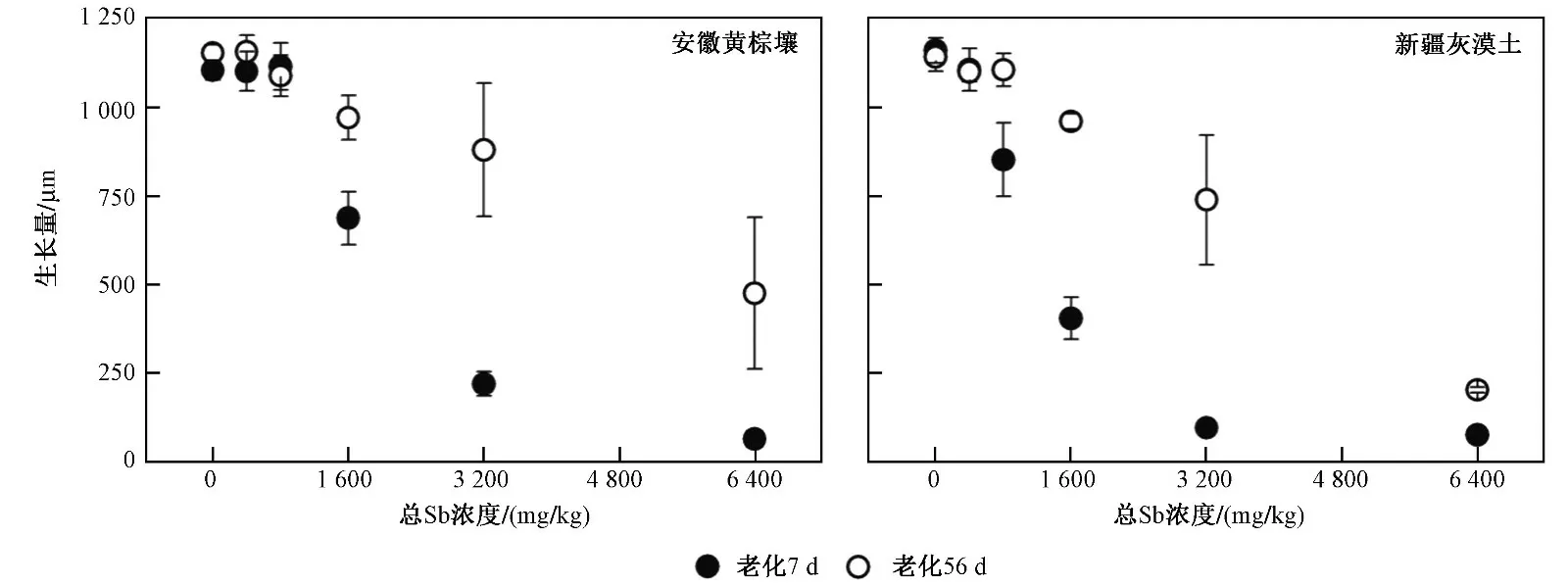
图3 不同老化时间的安徽黄棕壤和新疆灰漠土中Sb 对线虫的生长毒性Fig.3 Growth toxicity of Sb to C. elegans in Anhui yellow-brown soil and Xinjiang grey dessert soil with different aging time
2.3.2 老化土壤中Sb 对线虫的生育毒性
由图4 可见,经3 200 mg/kg Sb(Ⅲ)处理的安徽黄棕壤和新疆灰漠土老化7 d 后完全抑制了线虫的生育能力,而经过56 d 的老化,线虫的生育率分别为51.7%和46.7%. Sb(Ⅲ)处理浓度(6 400 mg/kg)最高时,2 种土壤中仅有16.7%和3.7%的线虫具备生育能力. 由外源Sb(Ⅲ)对线虫生育毒性的EC50值以及老化因子(见表3)可知,经Sb(Ⅲ)处理后老化7 和56 d 的新疆灰漠土均表现出对线虫较高的生育毒性和较强的老化效应,外源Sb(Ⅲ)对线虫生育毒性的阈值均低于其对生长毒性的阈值,毒性评价终点的敏感性差异整体表现为生育毒性高于生长毒性.
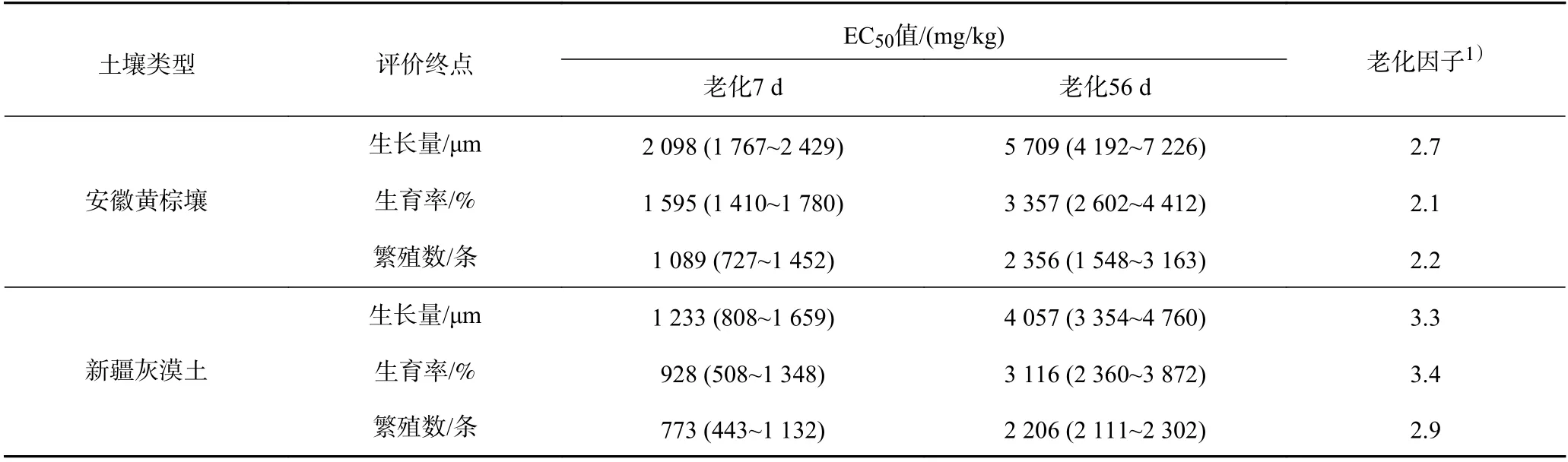
表3 土壤中Sb 对线虫生长、生育、繁殖毒性的EC50 值及老化因子Table 3 EC50 values of Sb in soil and aging factors derived from the growth, fertility, and reproduction of C. elegans
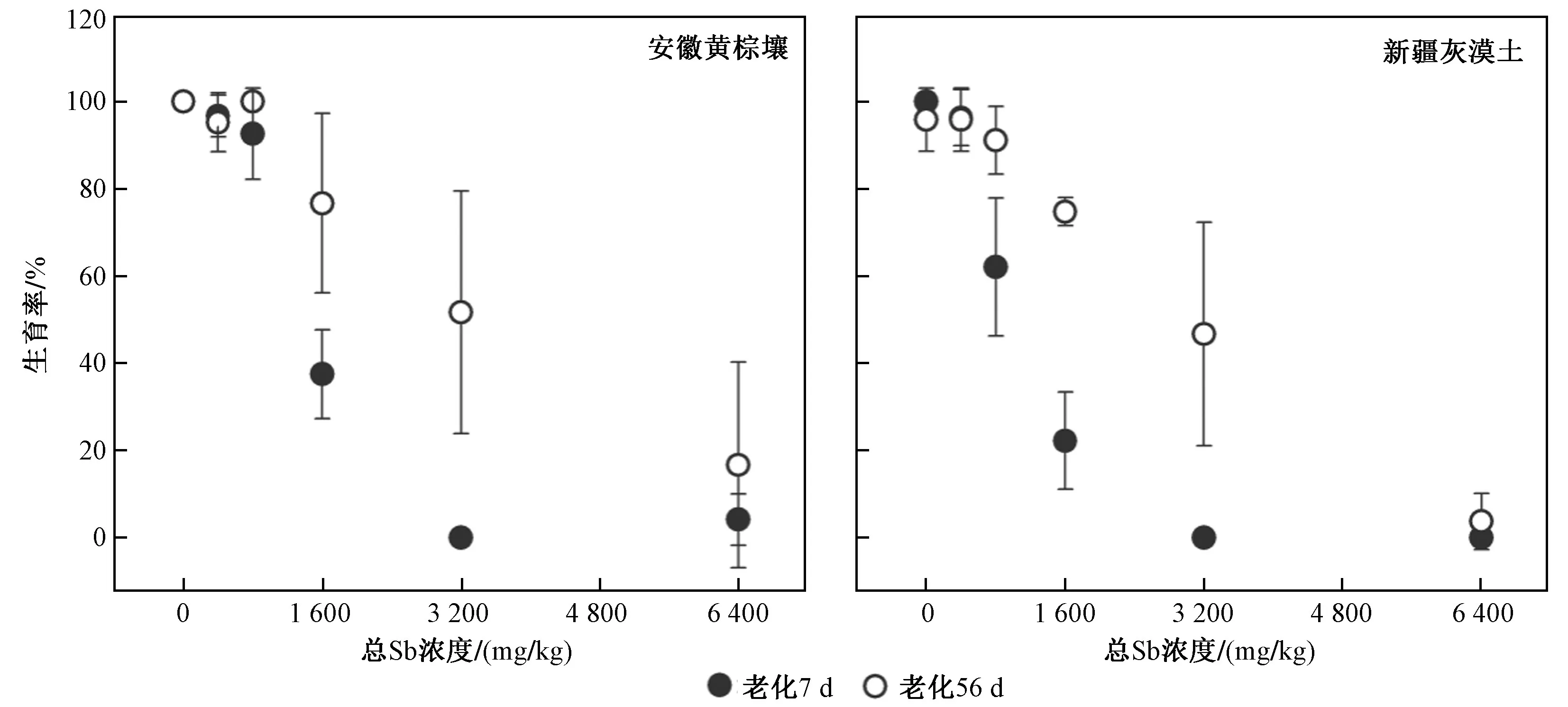
图4 不同老化时间的安徽黄棕壤和新疆灰漠土中Sb 对线虫的生育毒性Fig.4 Fertility toxicity of Sb to C. elegans in Anhui yellow-brown soil and Xinjiang grey dessert soil with different aging time
2.3.3 老化土壤中Sb 对线虫的繁殖毒性
由图5 可见,经1 600 mg/kg Sb(Ⅲ)处理的安徽黄棕壤和新疆灰漠土老化7 d 后线虫的繁殖均受到显著抑制(P<0.05),经3 200 mg/kg Sb(Ⅲ)处理的安徽黄棕壤和新疆灰漠土老化56 d 后线虫的繁殖均显著降低(P<0.05). 根据外源Sb(Ⅲ)对线虫繁殖毒性的阈值(见表3)可知,外源Sb(Ⅲ)对线虫繁殖毒性的阈值均低于其对生育毒性的阈值. 比较基于不同毒性评价终点计算的外源Sb(Ⅲ)毒性阈值(见表3)可以发现,外源Sb(Ⅲ)对线虫的繁殖表现出较高的毒性,对线虫的生育毒性次之,对线虫的生长毒性最低. 由老化因子(见表3)可知,新疆灰漠土中外源Sb(Ⅲ)的老化效应强于安徽黄棕壤.
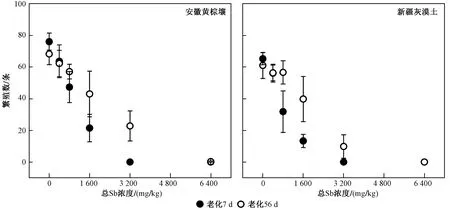
图5 不同老化时间的安徽黄棕壤和新疆灰漠土中Sb 对线虫的繁殖毒性Fig.5 Reproduction toxicity of Sb to C. elegans in Anhui yellow-brown soil and Xinjiang grey dessert soil with different aging time
3 讨论
土壤中重金属的生物毒性取决于其生物有效态浓度,研究中多通过化学可提取态对重金属的生物有效浓度进行表征[30]. 重金属的生物有效浓度与重金属进入土壤环境后的物理化学过程紧密相关[12,31]. 马祥爱等[32]研究发现,高黏粒占比的黑土对Sb 具有较强的吸附能力且对吸附态Sb 的解吸率较低. 林祥龙[33]研究指出,黏粒具有粒径小、比表面积大、吸附点位多等特点,较砂粒能更好地与土壤中Sb 进行结合. 笔者研究选用的安徽黄棕壤中可提取态Sb 浓度低于新疆灰漠土,可能与其较高的黏粒占比有关. 已有研究[34-35]指出,有机质中的活性官能团能与Sb 结合形成配合物,对土壤中Sb 的迁移能力造成影响. 土壤中天然的铁锰铝氧化物同样能对Sb 进行吸附,从而降低其生物有效浓度[2,36-37]. 笔者研究选用的安徽黄棕壤中有机质和铁锰铝氧化物含量均高于新疆灰漠土,降低了外源Sb(Ⅲ)的生物有效性和毒性,一定程度上解释了经Sb(Ⅲ)处理的安徽黄棕壤中较低的可提取态Sb 浓度以及对线虫较低的毒性.
外源Sb(Ⅲ)进入土壤环境会发生价态的转变[38].笔者研究显示,安徽黄棕壤和新疆灰漠土中Sb(Ⅲ)的氧化效率均随总Sb 浓度的提升呈下降趋势. 已有研究同样指出Sb(Ⅲ)的氧化效率受外源Sb(Ⅲ)浓度的影响, Cai 等[39]研究发现,在较低的初始浓度(0.09 和0.47 mmol/L)下,吸附在土壤表面的Sb(Ⅲ)经过240 h 的反应被完全氧化为Sb(Ⅴ),当Sb(Ⅲ)浓度提至0.94 mmol/L 时,土壤表面所有Sb(Ⅲ)被氧化则需要更多的时间. Lin 等[29]研究同样指出,外源Sb(Ⅲ)浓度为1 600 mg/kg 时江西土壤经过150 d 的老化,其中Sb(Ⅴ)占总Sb 的比例高达96.9%,而江西土壤中外源Sb(Ⅲ)浓度提至6 400 mg/kg 时,仅有16.6%的Sb(Ⅲ)被转化为Sb(Ⅴ). 除外源Sb(Ⅲ)浓度的影响外,土壤性质同样是造成Sb(Ⅲ)氧化效率差异的原因. 已有研究[36,40]指出,较高的土壤pH 有利于Sb(Ⅲ)氧化. 笔者研究显示,新疆灰漠土中Sb(Ⅲ)的氧化效率高于安徽黄棕壤,这可能是因为新疆灰漠土较高的pH 促进了高毒性的Sb(Ⅲ)向低毒性的Sb(Ⅴ)转化. 但也有研究[41]指出,pH 较高的条件下,土壤中的OH-与含氧阴离子形式存在的Sb 竞争结合矿物官能团,不利于土壤对Sb 的吸附,这可能是导致新疆灰漠土具有较高的可提取态Sb 浓度以及对线虫毒性较高的原因.
笔者研究中外源Sb(Ⅲ)对线虫的毒性随老化时间的推移呈下降趋势. 研究[11]指出,重金属进入土壤环境后,会在短时期内完成固液相的分配和表面的吸附,随老化时间的推移,通过沉淀、配位、氧化等反应过程达到新的平衡,生物有效性和毒性在老化过程中不断降低. Lin 等[42]研究同样发现,Cr(Ⅵ)处理的土壤老化21 d 后对跳虫的繁殖毒性较老化2 d 的土壤显著降低. 研究[43]指出,老化作用通过降低重金属的生物有效态从而削弱其对生物的毒性. 蔡琼瑶等[44]研究土壤中外源Pb 的老化特征,结果表明EDTA 提取态Pb 浓度随土壤的老化呈下降趋势. 笔者研究选用的2 种土壤中,外源Sb(Ⅲ)对线虫的毒性同样表现出随可提取态Sb 浓度降低而减弱的特征,但可提取态Sb 的降幅存在差异. 这是因为安徽黄棕壤pH较低且具有较高的黏粒占比、有机质以及铁锰铝氧化物含量,外源Sb(Ⅲ)进入安徽黄棕壤后能在较短的时间内通过物理化学过程被吸附,而上述吸附过程在新疆灰漠土中进行得相对缓慢,经更长时间的老化后,新疆灰漠土中外源Sb(Ⅲ)对线虫毒性的降幅更高. Lin 等[45]研究同样表明,与老化7 d 的土壤相比,老化120 d 的土壤中Ni 对跳虫致死毒性的LC50值和繁殖毒性的EC50值分别增加了1.30~1.94 和1.27~1.82倍,外源Ni 在4 种土壤中的老化效应存在差异. 外源Sb(Ⅲ)在新疆灰漠土中能被更快地氧化为毒性较低的Sb(Ⅴ),导致对线虫毒性的阈值提升相对较高,表现出更明显的老化效应.
根据该研究毒性测试结果可知,外源Sb(Ⅲ)对线虫的繁殖具有更高的毒性,对生育的毒性次之,对生长的毒性最低. Schertzinger 等[46]研究显示,污染物对线虫生长的毒害间接抑制了线虫的生育能力,导致污染物对线虫生育的毒性高于其对生长的毒性,对线虫繁殖数的抑制可能是由污染物的直接毒害作用以及对线虫生育的间接毒害作用共同所致.
4 结论
a) 老化过程降低了Sb(Ⅲ)处理土壤中可提取态Sb 浓度和Sb(Ⅲ)占比,从而减弱了外源Sb(Ⅲ)对线虫的毒性.
b) 土壤性质(pH、有机质、铁锰铝氧化物含量)对Sb(Ⅲ)处理土壤中可提取态Sb 浓度和Sb(Ⅲ)氧化效率的影响,导致不同土壤中外源Sb(Ⅲ)对线虫毒性的差异.
c) 外源Sb(Ⅲ)在不同土壤中的老化过程存在差异,新疆灰漠土中可提取态Sb 浓度和Sb(Ⅲ)占比的降幅更高,导致外源Sb(Ⅲ)对线虫毒性的阈值提升更大.

