发酵中药对禽大肠杆菌病肉鸡肠道菌群的影响
顾艳丽,曹艳子,王效禹,单春乔,刘 艳,2,江国托,2
(1. 大连三仪动物药品有限公司,辽宁 大连 116036;2. 江苏三仪生命科学研究院,江苏 邳州 221300)
在国家减抗替抗政策背景下,中药及其复方因残留少、毒性小、不易产生耐药性等特点,引起了人们的广泛关注。中药可以通过调节增强机体体质,提升自身抵抗力,从而抵御疾病。但中药按照传统的粉碎工艺进行处理时并没有将细胞壁充分破坏,因此会出现中药粉剂效果不理想、有效成分含量偏低等问题。笔者所在课题组前期研究发现[1‑2],中药复方经过微生物发酵后,不仅能够增强动物消化酶的活性,提高饲料利用率,而且能够拮抗动物机体的病原菌,增强免疫力和抗病能力。中药成分经过微生物的转化,大分子物质转变成为直接被机体吸收利用的小分子物质,使肉鸡血液中的有效成分迅速达到有效浓度,有助于营养物质的吸收,并且能够显著降低肠道中有害菌大肠杆菌的数量,增加有益菌乳酸菌的含量。
近年来,利用天然植物提取物来维持肠道微生态平衡以提高动物健康已成为研究热点。肠道作为机体重要的消化器官和免疫器官,肠道微生物通过菌群定殖等构建了肠道微生态-黏膜免疫屏障[3‑4],主要表现在生物拮抗、黏膜免疫系统发育、免疫调节、代谢调控以及控制代谢紊乱等方面。微生物菌群稳定对宿主的能量平衡、肠道上皮健康、新陈代谢和免疫功能都有重要作用[5‑6]。高通量测序技术已广泛应用于动物的胃肠道菌群特征分析,成为微生物群落多样性研究中最常用的方法,用16S rRNA 基因测序技术分析口服发酵中药前后肠道内容物中肠道菌群的变化,可了解中药对机体的肠道菌群组成造成的影响[7],高效研究家禽肠道微生物的多样性。
禽大肠杆菌病是由某些致病性血清型大肠杆菌引起的禽类不同疾病类型的总称。选用常见的大肠杆菌血清型之一的O78[8]进行人工感染建立发病模型,采用前期研发的发酵中药[1]和硫酸新霉素进行治疗,分析该发酵中药对白羽肉鸡肠道结构和肠道微生物菌群的影响,以期为该发酵中药在临床上治疗禽大肠杆菌病提供参考,并为进一步将其开发为高品质药用饲料添加剂提供技术支持。
1 材料和方法
1.1 试验动物
1 日龄供试爱拔益加(AA)白羽肉鸡购自大连普湾新区炮台齐泰隆种鸡养殖场,饲养于大连三仪动物药品有限公司动物房。
1.2 试验材料
发酵中药:将穿心莲、白头翁、黄连、黄柏、木香、败酱草和甘草,按比例混合,60 ℃干燥,控制含水量为7%~13%,粉碎,混匀,浸泡4 h,水提2 次,每次90 min,提取液按一定比例添加益生菌种子液进行液体深层发酵[1],发酵液中有效活菌数达到1.0×108cfu/mL,4 ℃保存备用。
硫酸新霉素可溶性粉为本公司自产产品。
鸡新城疫、传染性支气管炎二联疫苗(新支剋星):辽宁益康生物股份有限公司。
DNA抽提试剂盒:北京索莱宝科技有限公司。
1.3 基础饲粮及饲养管理
参照文献[9]的方法并结合NRC(1994)、《肉鸡饲养标准》(NY/T33—2004)制定肉鸡基础饲粮。供试鸡只采用复层式笼养,饲养管理和常规免疫均按《AA 肉仔鸡饲养管理手册》进行,每日观察并记录鸡只健康状况。整个饲养过程严格消毒,每天记录环境变化情况及肉鸡采食饮水和死亡情况。7日龄鸡只采用滴鼻点眼接种传染性支气管炎和新城疫二联疫苗,14日龄腿肌注射,利用7.0×107cfu/mL 大肠杆菌O78 造模,为避免应激反应,取消20 日龄法氏囊灭活苗的接种。
1.4 试验设计
选取1 日龄健康、体质量相近的AA 肉雏鸡300只,将其中270 只随机分成3 组,每组3 个重复,分别为对照组(D 组)、抗生素组(K 组)、发酵中药组(PEG 组),每个重复30 只;剩余30 只为造模对照组。饲养至14日龄,除对照组外,其余3组均用7.0×107cfu/mL大肠杆菌O78 以0.5 mL/只(半数致死量)建立发病模型;K组用成品药硫酸新霉素0.075 g/羽+水0.5 mL,2次/d,口腔灌服,连服5 d治疗;PEG组饲喂基础饲粮,按1.0 g/mL 生药量,0.5 mL/羽,2次/d,口腔灌服,连服5 d 治疗;造模对照组不治疗。试验期28 d。
1.5 样品采集
试验结束时,禁食12 h,每重复选取2 只接近平均体质量的肉鸡,D 组、K 组、PEG 组共取18 只鸡剖检。用事先灭菌的细线将盲肠结扎,剪下,于生物安全柜中取盲肠内容物装入无菌的5 mL离心管中,置于-80 ℃冰箱保存,用于肠道微生物菌群分析。
1.6 肠道微生物菌群分析
根据试剂盒说明书,对盲肠内容物总DNA 进行抽提。使用NanoDrop 2000检测所抽提DNA 的浓度和纯度,并用1%琼脂糖凝胶电泳检测提取的DNA质量。选择16S rRNA 基因V3—V4 区引物338 F(5′-ACTCCTACGGGAGGCAGCAG-3′ )和 806 R(5′-GGACTACHVGGGTWTCTAAT-3′)作为测序引物对盲肠内容物进行PCR 扩增。PCR 产物用2%琼脂糖凝胶电泳检测,回收目标条带,纯化后备用。根据所扩增的16S区域特点,构建小片段文库。
根据所扩增的16S 区域特点,完成基因组DNA抽提后,设计合成引物接头;根据测序区域合成带有bracode 的特异引物,并进行PCR 扩增;构建小片段文库,通过Illumina NovaSeq 测序得到原始数据。对原始数据进行拼接、过滤,得到有效数据,然后基于有效数据进行操作分类单元(OTU)聚类和物种分类分析,综合运用α 多样性分析和β 多样性分析等数据分析方法对各组肉鸡的肠道菌群进行多层面分析[10‑11]。
1.7 统计与分析
数据采用Excel 2010 进行初步整理,应用SPSS 20.0 软件进行单因子方差分析(One‑way ANOVA),结果以平均值±标准差表示。
2 结果与分析
2.1 供试肉鸡造模后临床表现
腿肌攻毒注射4 h 后,造模鸡只开始出现精神沉郁、扎堆趴窝、羽毛凌乱。此时对K 组、PEG 组进行试验治疗,造模对照组继续观察。攻毒48 h 后,造模对照组鸡只出现不同程度死亡,半数以上陆续开始采食,站立行动,但仍有趴卧现象。利用7.0×107cfu/mL大肠杆菌O78腿肌注射能够成功造模,剖检死亡和趴窝鸡只,心脏、肝脏和脾脏器官出现不同程度的包心、包肝、脾脏肿大现象,用灭菌接种环取样涂布于麦康凯培养基中培养24 h,培养基上均长出粉色大肠杆菌典型菌落,感染率100%(表1)。K 组和PEG 组治疗24 h 鸡只出现好转,表现在人进入鸡舍时鸡只听觉灵敏,扎堆趴窝现象消失;72 h鸡只动作敏捷,饲喂时食欲旺盛,抢食抢水,羽毛光滑;试验结束剖检,心脏、肝脏、脾脏均与D组无差别。

表1 大肠杆菌O78感染肉鸡发病模型的建立Tab.1 Establishment of pathogenic model of E.coli O78 on broilers
2.2 肉鸡肠道菌群的稀释曲线
稀释曲线是从样本中随机抽取一定测序量的数据,当曲线趋向平坦时,表明在当前测序数据量下,样本物种信息已基本被检测到,增加测序深度不会产生更多的物种,更多的数据量只会产生少量新的OTU,反之则表明继续测序有可能产生较多的OTU。通过稀释曲线可以反映测序结果的合理性、准确性以及样本微生物多样性的大小。如图1 所示,D 组、K 组和PEG 组样本在read<20 000 之前,OTU 数量随着测序序列数的增加呈指数增长,而在read>20 000之后OTU数量增加速度明显减缓,随着测序量的增加逐渐趋于平缓。各样本物种数量和多样性指数并不会随测序数量的增加而继续增加,说明本研究所有样本测序质量较好,能够覆盖样本中的绝大多数物种,数据量已基本合理,获得的数据可以用于分析。

图1 肉鸡盲肠微生物的稀释曲线Fig.1 Rarefaction curves of broiler cecum microbiota
2.3 发酵中药对禽大肠杆菌病肉鸡肠道菌群数量的影响
从图2 可以看出,3 种不同颜色的圆对应各组AA 肉鸡盲肠所含的菌群,重叠部分为对应组所共同含有的菌群。D 组有1 207 个OTU,K 组有1 173个OTU,PEG 组有1 205 个OTU,OTU 数量可以代表样品物种的丰度,其中PEG 组与D 组物种丰度相当,K 组物种丰度略低,但差异不显著。3 组样本共有875 个OTU,其中K 组与D 组共有945 个OTU,分别占K 组的80.56%,占D 组的78.29%;PEG 组与D组共有1 020 个OTU,分别占PEG 组的84.65%,占D组的84.50%。

图2 不同处理组肉鸡肠道菌群间OTU分布差异韦恩分析Fig.2 Venn diagram of OTU distribution difference in intestinal bacteria between broiler different groups
2.4 发酵中药对禽大肠杆菌病肉鸡盲肠微生物α多样性的影响
各样本在97%一致性阈值下,采用α 多样性指数对样本内的微生物群落的丰富度和多样性进行比较分析,包括Simpson、Shannon、Chao 1和Ace 4个指数。其中Simpson、Shannon 指数用来评估菌群的多样性,菌群的多样性越高,Shannon 值越大,Simpson值越小。从表2可以看出,各组有效序列数均较高,在52 811~58 450,覆盖度均为0.998,说明测序结果已经基本覆盖样本的多样性。D 组Shannon 指数最高,显著高于K 组和PEG 组(P<0.05)。各组间Simpson、Chao 1、Ace 指数均无显著性差异(P>0.05),说明经过抗生素或发酵中药治疗后的患病鸡只,盲肠内微生物的物种总数、菌群丰度和多样性趋近于对照组。

表2 发酵中药对肉鸡盲肠微生物α多样性指数的影响Tab.2 Effects of fermented traditional Chinese medicine on α diversity index of cecum microbiota
2.5 发酵中药对禽大肠杆菌病肉鸡盲肠微生物β多样性的影响
β多样性分析是对不同样本的微生物群落构成进行比较分析。本研究基于OTU 水平计算Unweighted Unifrac,采用无度量多维标定法(NMDS)及β 多样性指数进行分析。由图3 可见,PEG 组样本与D 组样本相距较近,且组内各样本分布较密集,而K 组与D 组、PEG 组相距较远,组内各样本分布稀疏。以上结果表明,PEG 组和D 组样本间多样性差异较小,而K组与D组、PEG组样本间多样性差异较大。

图3 发酵中药对肉鸡盲肠微生物β多样性的影响Fig.3 Effects of fermented traditional Chinese medicine on β diversity of cecum microbiota
2.6 发酵中药对禽大肠杆菌病肉鸡盲肠微生物组成及其丰度的影响
2.6.1 门水平上的细菌组成 根据OTU 划分和分类地位鉴定结果,获得每个样本在门、纲、目、科、属、种各分类水平的具体信息。AA 肉鸡盲肠门水平微生物物种相对丰度前10 如图4 所示,门水平上不同的处理组的优势菌群清晰可见。3个处理组盲肠门水平的优势菌门分别为厚壁菌门(Firmicutes)、拟 杆 菌 门(Bacteroidota) 、 疣 微 菌 门(Verrucomicrobiota)、变形菌门(Proteobacteria)和未确定菌门(Unidentified_bacteria)。其余相对丰度小于1%的菌门分别为放线菌门(Actinobacteriota)、弯曲 杆 菌 门(Campilobacterota)、脱 硫 杆 菌 门(Desulfobacterota)、蓝细菌门(Cyanobacteria)和协同菌门(Synergistota)。如表3所示,各组中厚壁菌门均为主要门,相对丰度在53.84%~58.27%;拟杆菌门相对丰度在25.80%~34.67%;疣微菌门相对丰度在1.57%~7.16%,PEG组显著高于D组(P<0.05)。

表3 不同处理组优势菌的相对丰度(门水平)Tab.3 Relative abundance of dominant bacteria in different treatment groups(phylum level) %

图4 肉鸡盲肠微生物门水平组成Fig.4 Phylum level abundance of broiler cecum microbiota
2.6.2 属水平上的细菌组成 在属水平上,相对丰度大于1%的菌属为优势菌属。由图5 和表4 可知,D 组肉鸡盲肠菌群以粪杆菌属(Faecalibacterium)、拟杆菌属(Bacteroides)为主,感染大肠杆菌肉鸡经抗生素和发酵中药治疗后,肉鸡盲肠细菌菌群组成结构发生了不同程度的变化。K组的粪杆菌属相对丰度显著高于D 组和PEG 组(P<0.05),其他菌属与D组差异不显著(P>0.05);PEG 组Akkermansia、巴氏杆菌属(Barnesiella)的相对丰度显著高于D 组和K组(P<0.05),粪杆菌属等其他菌属与D 组差异不显著(P>0.05)。Akkermansia具有抑制肠道疾病的作用[12]。由此可见,通过该发酵中药对患病鸡只的治疗,改变了Akkermansia在盲肠中的分布,与D 组和K 组相比,PEG 组的盲肠内容物Akkermansia属细菌数分别增加了355%和272%,不仅能够达到健康水平,在某种程度上还能够提高其抑制肠道疾病的能力。
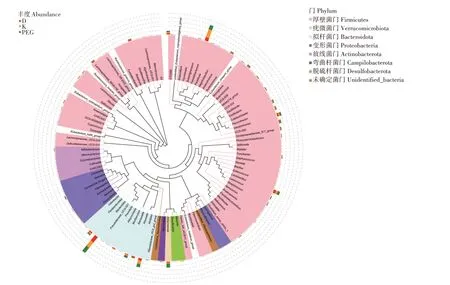
图5 肉鸡盲肠微生物属水平组成Fig.5 Genus level abundance of broiler cecum microbiota
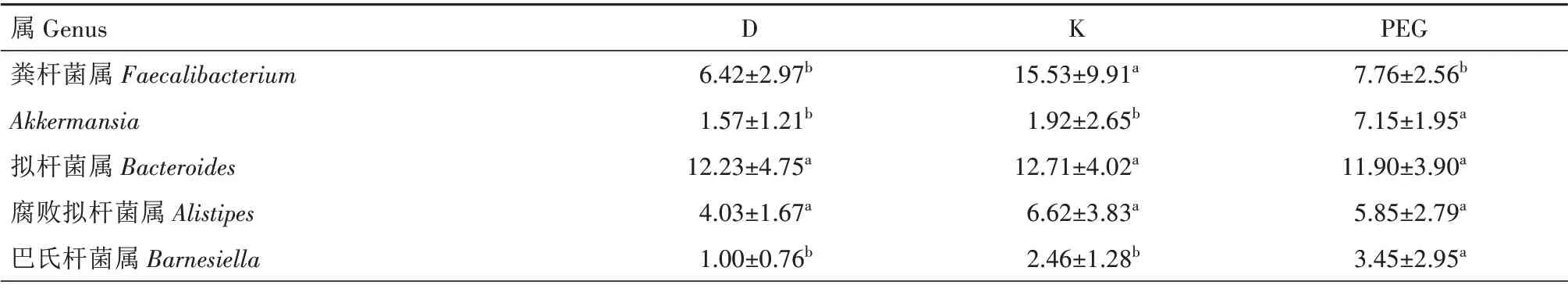
表4 不同处理组优势菌的相对丰度(属水平)Tab.4 Relative abundance of dominant bacteria in different treatment groups(genus level) %
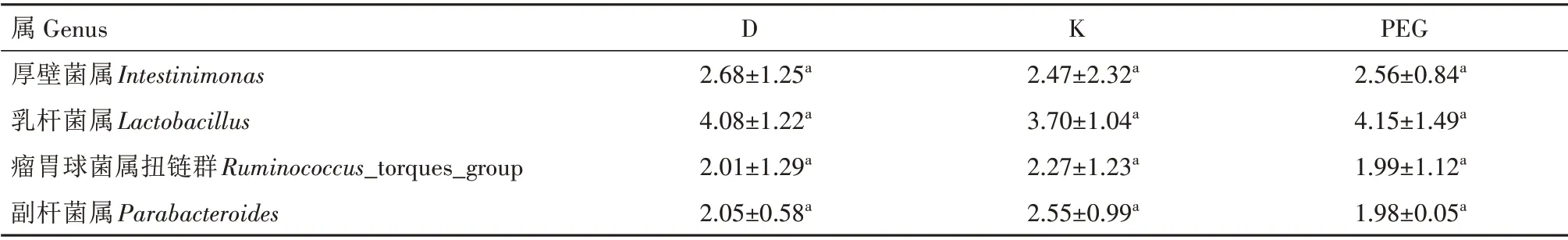
续表4 不同处理组优势菌的相对丰度(属水平)Tab.4(Continued) Relative abundance of dominant bacteria in different treatment groups(genus level) %
2.7 肉鸡肠道菌群功能预测
Tax4Fun 功能预测是通过提取KEGG 数据库原核生物全基因组16S rRNA基因序列,将测序样品以SILVA 数据库序列为参考序列进行聚类,进而获取功能注释信息。为验证不同处理对肉鸡肠道菌群代谢能力影响的差异,根据细菌在数据库中的功能注释及丰度信息,选取丰度排名前35的功能及它们在每个样品中的丰度信息绘制热图,并从功能差异层面进行聚类。结果如图6所示,共获取六大功能:人类疾病、有机体系统、新陈代谢、遗传信息处理、细胞转化和环境信息处理。不同处理组的微生物功能各不相同,D 组在遗传信息处理和环境信息处理方面的功能较丰富;K 组各类功能较为均衡;PEG组在人类疾病、有机体系统和新陈代谢方面的功能较为丰富,表明该发酵中药可调节肉鸡肠道微生物群落结构,提高有益菌群丰度,降低有害菌群丰度,调节物质运输和代谢。
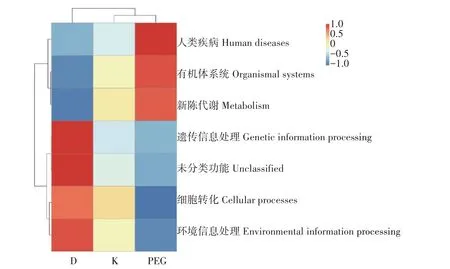
图6 功能注释相对丰度聚类分析Fig.6 Cluster analysis of the the relative abundance of functional annotation
3 结论与讨论
肠道微生物菌群是肉鸡消化吸收体系的一个重要组成部分,其菌群数量和种类随动物所处的环境、饲料和健康状况不同而差异很大。保持动物肠道微生物区系平衡,提高有益菌数量、降低有害菌数量对维持动物健康、提高动物肠道免疫机能非常重要[13]。
复方中诸药合用理论上具有清热解毒、燥湿止痢、行气导滞、增强免疫力的功效[2]。黄连、黄柏的主要成分小檗碱不仅可以提高肠道内门、属级菌群的丰度和多样性,改变肠道微生物菌群的组成,调控肠道菌群代谢产物的产生,还可以降低肠道通透性,维持肠道菌群稳定,从而提高动物肠道功能[14]。白头翁的主要成分皂苷及其肠道菌转化成分可以提高益生菌、降低有害菌的菌群丰度,进而通过改善肠道内菌群结构治疗肠道疾病以及其他疾病[15]。
本研究中,发酵中药不仅在表观上能够与硫酸新霉素有着相同的治愈率,在肠道菌群上,经过抗生素或复方中药治疗后的患病鸡只,盲肠内微生物的物种总数、菌群丰度和多样性趋近于对照组。
本研究中,发酵中药对疣微菌门的影响主要体现在Akkermansia上。Akkermansia是一种肠道微生物,在肠道黏液层的生理学中起关键作用,与肠道屏障功能有关[16]。LIU等[17]的研究结果也表明,芦荟多糖干预后,结肠中短链脂肪酸(SCFA)及SCFA 产生属Akkermansia和Blautia增加,小鼠结肠炎症和屏障功能障碍明显减轻。SCFA 是肠道菌利用益生元产生的一类有助于调节能量代谢和肠道稳态的代谢物[18]。本研究中,发酵中药组内Akkermansia相对丰度显著高于对照组和抗生素组,这可能是发酵中药中的黄连、黄柏中含有小檗碱,能够分解黏蛋白并刺激杯状细胞合成黏蛋白达到动态平衡[19‑20],其确切机制还需要进一步研究。Akkermansia对肠道上皮细胞良好的黏附作用以及自聚集能力,有利于在肠道菌群中形成优势占位。大量研究表明,Akkermansia发挥益生功能的关键生理机制之一是基于其对宿主肠道屏障的调节,抑制肠道菌产生的内毒素进入血液,进而达到缓解机体慢性炎症的作用[16,21],使其成为维持肠道黏膜屏障的关键微生物。本研究因侧重考察发酵中药对肉鸡肠道菌群方面的影响,试验期限28 d,下一步将延长试验期及进行临床试验,在肉鸡出栏前测定其生长性能。
综上,由穿心莲、白头翁、败酱草、黄连等中药制备的发酵中药,可调节肉鸡肠道微生物群落结构,提高有益菌群丰度,降低有害菌群丰度,调节物质运输和代谢,促进机体恢复健康,具有临床推广价值。

