桑黄多糖的提取纯化技术及药理作用研究进展
徐雯雯 陆春霞 肖潇 刘开莉 李小群 莫炳巧 林强轩 唐永飞 杜谨利 梁贵秋
(1. 广西壮族自治区蚕业技术推广站, 南宁 530007;2. 广西壮族自治区蚕业科学研究院, 南宁 530007)
药用真菌桑黄属于桑黄孔菌属(Sanghuangporus),包含14个已知物种的真菌,如桑树桑黄(Sanghuangporussanghuang)、杨树桑黄(Sanghuangporusvannii)、暴马桑黄(Sanghuangporusbaumii)、漆树桑黄(Sanghuangporustoxicodendri)等[1]。一直以来药用真菌冬虫夏草和灵芝以抗肿瘤、滋补强壮等功效受到大众青睐,但近10多年的研究发现桑黄的药用功效不亚于冬虫夏草、灵芝等。事实上桑黄作为传统中药已有2 000多年的历史,在《神农本草经》《药性论》《本草纲目》等古代中药典籍中均有记载,其主要用于活血、止血、止泻、脾虚泄泻等,可通过配茶、煲汤、泡酒等方式服用。运用现代技术检测分析桑黄含有多糖、黄酮、萜类化合物和甾体类化合物等活性成分,其中多糖因具有良好的抗肿瘤、抗氧化、抗血糖、免疫调节等功效受到研究者的关注,业已明确桑黄多糖水解后可以得到木糖、甘露糖、阿拉伯糖、半乳糖和葡萄糖等。
野生桑黄在我国西藏、四川、云南、浙江、陕西、吉林和台湾等省区均有分布,不同种类的桑黄不仅药理作用不同,而且产量也不同,从而导致市场上桑黄的价格差异较大。随着2012年桑树桑黄新品种的发布,其市场需求不断增加,人工栽培桑黄也开始蓬勃发展,但目前桑树桑黄的人工栽培仍然有较大难度,市场上的大多数人工栽培桑黄属于杨树桑黄,其产品品质和有效成分与野生桑黄相比仍然存在差距[2]。此外,桑黄有效成分提取方法和提取工艺技术条件等因素的改变,会直接影响有效成分的组成,进而在很大程度上影响提取物的生物活性。本文对国内外有关桑黄多糖的提取方法和工艺技术条件,以及目标成分的分离纯化、结构鉴定、药理作用等研究进展进行较为系统的总结,以期为进一步对桑黄多糖高品质利用的研究与开发提供参考。
1 桑黄多糖的提取方法
1.1 溶液浸提法
溶液浸提法包括热水浸提法和酸碱浸提法。
水溶性多糖的提取可采用热水浸提法和乙醇沉淀法[3]。热水浸提法具有成本低、操作简单、重现性比较高的优点。热水浸提法的提取率受到提取时间、料液比、提取温度、pH值等因素的影响。李有贵等[4]在料液比1∶30、温度95 ℃条件下浸提24 h得到的滤液经浓缩后为水提取物,再将水提取物用75%乙醇沉淀24 h后离心、冷冻干燥制得桑黄粗多糖。严红实等[5]经过热水浸提试验得出最佳提取工艺条件为料液比1∶18、提取温度90 ℃、提取时间8 h,在此提取工艺条件下桑黄多糖的得率为2.12%。梁大勇等[6]利用热水浸提法提取桑黄发酵液的总多糖,在溶液pH12、温度96 ℃的条件下提取1.6 h,桑黄总多糖的质量浓度达11.76 mg/mL。值得注意的是,经过长时间的高温提取,会加大桑黄中对温度敏感的类生物活性化合物释放,则后续的分离与纯化步骤将更加复杂,桑黄多糖的回收率也会受影响而下降。
酸碱浸提法通常在连续提取步骤的热水浸提之后进行,酸碱浸提处理会破坏桑黄的细胞壁以及粗纤维结构和细胞壁蛋白与葡聚糖之间的可水解键,从而释放细胞内多糖的酸碱溶性部分,并将水不溶性组分转化为水溶性组分[7]。Chen等[8-9]就是采取碱提取技术获得桑黄多糖用于后续研究。
1.2 超声波辅助提取法
超声波辅助提取法是利用超声波的空化作用释放大量能量来破坏原料的细胞壁,增加细胞内物质的释放,从而提高萃取率。曾鹏等[10]通过3因素3水平响应面模型试验设计得到的数据进行多元回归分析,获得超声波辅助提取桑黄多糖的最优工艺条件为提取温度100 ℃、料液比1∶26、提取时间4.35 h,其得率为1.645%。采用超声波辅助提取法较溶液浸提法提取桑黄多糖,具有更省时、更节能和提取率更高的特点,并且仪器设备操作也更方便。但是,长时间的超声波处理会加大可溶性多糖的降解,对桑黄多糖的分离纯化、提取效率等造成影响,所以要尽量减短超声波处理时间。
1. 3 微波辅助提取法
微波辅助萃取法的基本原理是通过溶剂与溶解离子之间的离子传导产生热能,使原料溶液的温度快速升高,溶液的粘度降低,细胞外膜破裂,同时分子旋转中和了Zeta电位[11],使分子周围的电荷重新排列,从而增强了离子的运动并提高萃取效率。微波辅助提取法所需时间较热水浸提法与超声波提取法所需时间短。秦俊哲等[12]采用微波辅助提取桑黄多糖,影响桑黄多糖得率的因素依次为微波功率、液料比、提取时间,当料液比为1∶41、微波功率为558 W、提取时间为5.1 min,经2次提取后桑黄多糖得率可达4.18%。微波辅助提取法与超声波辅助提取法、热水浸提法相比,其加热速度更快、提取时间更短、提取效率更高。
1. 4 酶提取法
酶提取法是利用酶有效地催化真菌细胞壁基质的水解和降解,从而释放出细胞内的生物活性物质,其具有专一性强、操作方便、效率高、工作温度低、特异性强等优点[7]。目前应用于桑黄多糖提取的以复合酶提取法较为常见。周慧吉等[13]使用4%复合酶(纤维素酶、蜗牛酶、果胶酶、中性蛋白酶的质量比为6∶2∶1∶8)提取桑黄多糖,其桑黄多糖的得率比热水浸提和超声波辅助提取的得率都高,且粗多糖水解后的单糖种类最多,包括鼠李糖、阿拉伯糖、木糖、甘露糖、半乳糖以及葡萄糖。由于提取方法的选择对多糖的组成和药理作用有很大影响,所以研究者需要根据目标物选择合适的提取方法。谢丽源等[14]利用超声波与复合酶法双重处理提取桑黄多糖,在超声波优化提取的结果上再进一步采用复合酶提取桑黄多糖,使桑黄多糖的得率由原来的3.356%提高至6.619%,几乎是翻倍提高。采用酶提取法提取桑黄多糖的条件温和,不仅可以保留较多容易分解的多糖组分,还增加了提取效率,节约了提取时间,尤其是采用复合酶提取桑黄多糖的效果更为显著。有关复合酶的选择及配比可以做进一步的研究。
1.5 减压提取法
减压提取法通过调节真空度降低溶剂的沸点,可以使原料溶液保持低温沸腾状态,提取时间也相对减少,使易分解的多糖组分得到保留。孙贺春等[15]采用减压提取法提取桑黄多糖,各因素对提取率的影响为提取次数>提取温度>提取时间>料液比,在真空度300 hPa、料液比1∶20、温度90 ℃、提取时间1.5 h、提取次数2次的最优提取条件下,桑黄多糖的得率达9.4%。
1.6 双水相提取法
双水相体系是指由2种亲水性化合物组成的互不相容的水相体系,目标物在体系中的分配系数不同而溶解度不同,进而在两相中选择性分配。用传统的水提醇沉方法提取多糖,提取率相对较低,提取时间较长,而且后续还需要使用大量的具有挥发性和一定毒性的有机溶剂进行除杂。相对而言,双水相提取法具有提取率高、生物相容性好、操作时间短、绿色环保等特点。Wu等[16]以桑黄菌丝为原料,采用[Chol]Cl/K2HPO4形成的以胆碱为基础的双水相提取方法提取桑黄多糖PLPS,优化后的提取条件为K2HPO4质量分数68.9%、[Chol]Cl质量分数20%、温度21.2 ℃、振荡时间30 min,此时PLPS的最佳提取效率是68.53%±0.29%,与传统的醇沉淀方法得到的桑黄多糖C-PLPS相比,其抗氧化性明显增强,且提取过程绿色环保。该方法用于提取桑黄多糖的研究报道还不多,后续使用该方法可以对形成双水相体系的离子液体和无机盐进行筛选,以开发出不同的双水相提取体系。
2 桑黄多糖的分离与纯化及结构鉴定
2.1 桑黄多糖的分离
初步提取的粗多糖中含有多种杂质,例如蛋白质、色素等物质,因此还需要对杂质进行分离,通常可以采用柱层析达到纯化目的,其流程如下。
2.1.1 除去蛋白质
用Savage法除去提取物中的蛋白质,基本原理是基于蛋白质在有机溶液中变性形成絮状沉淀之后可通过离心去除絮状蛋白质沉淀,重复数次操作即可达到目的。胡启明[17]在使用Savage法除去桑黄多糖蛋白时发现,蛋白质、色素和其他杂质会随着Savage试剂一起除去,随着操作重复次数的增加,蛋白质被有效除去,只是桑黄多糖的损失率也逐渐增大。Savage法虽然温和,但是存在试剂用量大、耗时长并且会损耗多糖的缺点。
三氯乙酸法也常用于分离提取物中的蛋白质,其原理是将三氯乙酸作为蛋白质变性剂使蛋白质构象发生改变,暴露出较多的疏水性基团而形成沉淀。谢丽源等[18]对比了Savage法和三氯乙酸法去除桑黄多糖游离蛋白质的多糖损失率、处理次数和脱蛋白质效果,结果表明三氯乙酸法更适合用于脱除桑黄多糖提取物中的蛋白质。
2.1.2 脱色
多糖的脱色处理可以使用活性炭法、过氧化氢法、大孔树脂吸附法。虽然活性炭因具有强吸附性经常用于脱色处理,但是其吸附色素的同时也会使多糖损失较多。采用过氧化氢法脱色时会由于过氧化氢的强氧化作用使其在氧化色素的同时,也容易使多糖被分解。大孔树脂的脱色原理是利用分子间相互作用将色素吸附到树脂填料上,使用大孔树脂法脱色的脱色率较高,多糖损失率较低,且树脂还具有操作简便、可重复利用的优点,Zhao等[19]采用AB-8大孔吸附树脂对桑黄粗多糖进行脱色后再进行多糖的纯化,取得了较理想的效果。
2.2 桑黄多糖的纯化
常用于分离纯化桑黄多糖的柱层析法包括离子交换柱层析和凝胶柱层析。柱层析法的基本操作首先是在离子交换柱上采用梯度洗脱将粗多糖组分分离为多个馏分或单个馏分,再使用凝胶柱纯化所需馏分得到目标多糖。单糖组分的分析方法包括气相色谱法(GC)、气相色谱-质谱联用(GC-MS)、高效凝胶渗透色谱法(HPGPC)、凝胶渗透色谱-多角度激光散射联用(GPC/MALLS)、高效阴离子交换色谱法(HPAEC)等。单糖的纯度和分子量的测定一般使用高效液相色谱法(HPLC),也可以使用以HPLC为主的系统联合其他检测器,如多角度激光光散射检测器和示差折光检测器等[20]。表1列出了近年来使用柱层析法分离纯化桑黄多糖的研究结果。
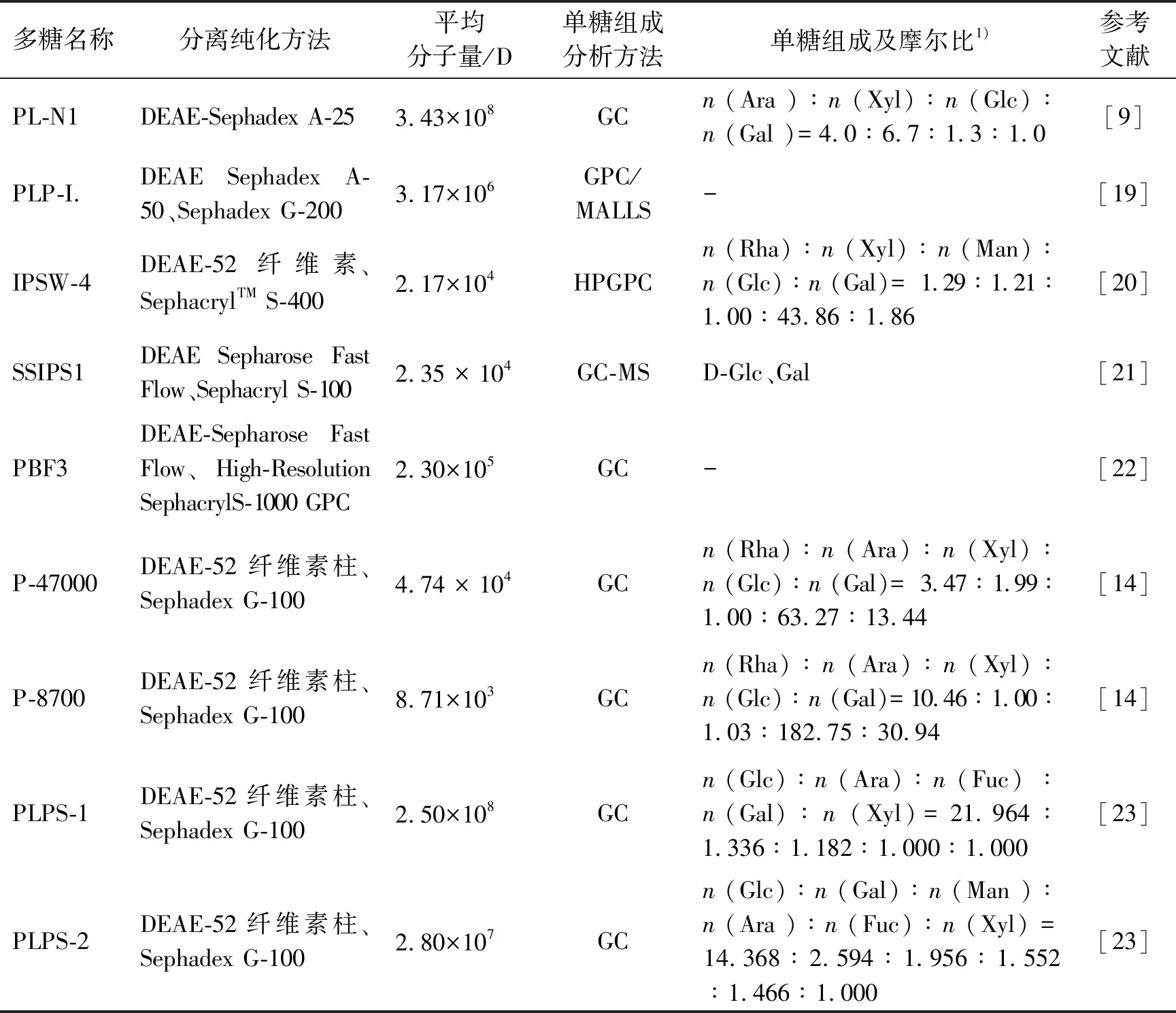
表1 桑黄多糖使用柱层析法分离纯化获得的单糖及组分
2.3 桑黄多糖的结构鉴定
解析多糖的结构有利于多糖的药理作用研究。将近年来对桑黄多糖的官能团特征研究结果列于表2,可以看出吡喃糖环是桑黄多糖特有的结构;对桑黄多糖的链结构分析结果见表3。我们从表1~3可以看出,桑黄多糖的提取方法和分离纯化方法不同,其单糖的组成、分子量、链结构也有很大的差异,这也直接影响到多糖的生物活性及药理作用。例如,多糖PLPS-1和PLPS-2的分子量、单糖组成、链构成不同,它们的抗肿瘤活性相应地也有很大差异,PLPS-1具有强抗肿瘤活性,但是PLPS-2对肿瘤细胞无抑制作用。总之,对提取桑黄多糖的组成分析、分子量分析和结构分析,有助于明确不同桑黄多糖提取物产品的药理作用差异。

表2 用红外光谱法对桑黄多糖官能团组成特征分析的结果

表3 用3种方法对桑黄多糖链结构分析的结果
3 桑黄多糖的药理作用及影响因素
3.1 桑黄多糖的药理作用
3.1.1 抗肿瘤作用
桑黄多糖是桑黄抗肿瘤作用的重要活性成分,其主要是通过抑制细胞增殖、促进细胞凋亡起到抗肿瘤的作用。吴建珩等[24]研究发现桑黄多糖表现出的良好抗肿瘤能力,一方面是通过抑制调控细胞周期的细胞周期蛋白A和细胞周期蛋白依赖性激酶的表达,从而抑制胶质瘤U251细胞的增殖;另一方面则是通过上调细胞凋亡过程中最主要的终末剪切酶Caspase3的表达来使线粒体外膜破裂释放出Cyt-C,引起肿瘤细胞的凋亡。刘燕琳等[25]通过空白对比试验研究桑黄多糖的抗肿瘤功能,认为桑黄多糖可以有效抑制C-myc基因的表达,有效上调抑癌基因PTEN的表达,以起到抗肿瘤效果。
3.1.2 抗炎症作用
桑黄多糖的抗炎作用已经被许多研究者证实。Lin等[26]的细胞学实验结果表明,在不影响巨噬细胞存活的浓度下给予桑黄菌丝提取物,可以有效地调节脂多糖诱导的炎症反应和促炎性物质合成相关基因的表达。Xie等[27]的研究证实了桑黄多糖对脂多糖诱导的RAW264.7细胞炎症反应的预防作用,桑黄多糖抑制NF-κB的易位,增加AMPKα的磷酸化,从而降低RAW264.7细胞的促炎细胞因子产生,增加抗炎细胞因子的产生。Luo等[28]的实验验证了桑黄多糖的抗炎作用,其可加快伤口的愈合,适用于收缩创面和促进组织内部生长。
3.1.3 降血糖作用
多糖已被广泛证明可以促进肠道细菌的健康生长,抑制高血糖,逆转胰岛素抵抗和预防糖尿病的并发症[29]。如果肠道菌群失调,就可能会导致全身性糖代谢紊乱,促使其患上糖尿病[30]。短链脂肪酸具有维持肠道屏障、降低血液中脂多糖、抑制全身性炎症和改善肝脏代谢功能的作用[31]。Liu等[32]以大鼠为实验动物观察到桑黄多糖给药后肠道屏障改善,这可能是因短链脂肪酸呈高水平状态,从而减少了全身炎症和逆转胰岛素抵抗。黄倩等[33]研究发现桑黄多糖可调节MMP-2/TIMP-2平衡,减轻糖尿病肾病小鼠肾间质纤维化,这可能与抑制P311/TGF-β1/Snail1信号通路的激活有关。
3.1.4 抗氧化作用
宋吉玲等[34-35]探究了桑黄多糖的抗氧化能力,通过检测DPPH自由基、ABTS自由基、羟自由基和超氧阴离子清除能力以及铁离子还原能力、亚铁离子螯合能力、总抗氧化能力和超氧化物歧化酶活性,均可证明桑黄多糖具有很强的抗氧化能力。Luo等[28]以桑黄为原料制备的富硒菌丝多糖通过降低脂质过氧化而表现出潜在的抗氧化作用。因此,许多科研人员投身到以桑黄为原料的抗氧化、防衰老的美容保健品及化妆品研发中。除此之外,天然植物多糖的抗氧化作用还可以运用到生物材料、化学材料中,例如Ran等[36]就是利用桑黄多糖为天然还原剂且无毒的特点,用来还原纳米银。
3.1.5 免疫调节作用
近年来的研究发现,植物多糖具有的免疫调节作用可以广泛应用,其中桑黄多糖可以提高人体免疫功能,还能对抗免疫抑制剂以及恢复脾脏和胸腺的免疫功能。赵桂芝等[37]研究发现,与空白对照相比,桑黄多糖可以抑制环磷酰胺所致免疫损伤作用,使大鼠的体质量、脾脏和胸腺指数、外周白细胞数、血红蛋白含量等增加,表明桑黄多糖有提高免疫力的功能。宋柳徵等[38]的细胞学实验结果表明桑黄多糖可以刺激B淋巴细胞的增殖、提高巨噬细胞的吞噬能力,从而增强免疫力。郭俊平等[39]发现桑黄多糖可以提高小鼠的抗疲劳以及耐缺氧能力,可以改善其有氧运动的机能。穆鹏[40]经过对比发现,运动员服用桑黄多糖后的血乳酸、尿素氮含量、血清肌酸激酶和心率变化均低于不服用桑黄多糖的运动员,因此认为桑黄多糖有提高机体免疫,缩短人体恢复疲劳的时间等功效。
3.1.6 护肝作用
张珈宁等[41]的研究表明,桑黄多糖在治疗血吸虫病肝纤维化方面发挥重要作用,可以有效减轻日本血吸虫感染小鼠的肝虫卵肉芽肿和胶原的沉积,抑制肝脂质过氧化,提高谷胱甘肽的含量。过量的扑热息痛(APAP)会促进氧化应激,导致肝细胞坏死和肝功能下降,细胞色素P450在APAP代谢时而被氧化,导致氧化应激增加、肝坏死及谷胱甘肽被消耗[42]。Chen等[8]的研究发现,桑黄多糖的抗氧化性可以抑制细胞色素P450的氧化和肝细胞促炎因子的释放,提高了APAP 解毒Ⅱ期酶水平,有利于加速APAP代谢,这也证明了桑黄多糖在肝脏保护方面具有潜在的应用价值。
3.2 影响桑黄多糖药理作用的因素
3.2.1 原料
桑黄原料的选择会影响桑黄多糖的药理作用。对于子实体桑黄产品而言,市场上出现的大多为桑树桑黄、杨树桑黄、暴马桑黄、小孔忍冬桑黄等。齐欣等[2]检测比较了不同桑黄的多糖含量,结果显示桑树桑黄的多糖含量是杨树桑黄的1.3倍,是暴马丁香桑黄的2.8倍,可见桑黄寄生树种的差异对桑黄多糖的含量有很大的影响,所以不同种类的桑黄价格也相差很大。应瑞峰等[43]使用超声波热水浸提法提取桑黄子实体和桑黄菌丝体的多糖,并发现子实体的桑黄多糖提取得率、多糖含量以及抗氧化能力明显高于菌丝体。由于寄生于树上的桑黄子实体供不应求,人工栽培桑黄成为研究人员的一大重点,其优点是培养基质和栽培环境的可控,现阶段的人工栽培桑黄子实体的栽培基质主要有段木栽培基质和木屑栽培基质。李小欢等[44]检测对比了段木栽培和木屑栽培桑黄子实体中的化学成分,结果是段木栽培的桑黄子实体中总多糖、总三萜、麦角甾酮等成分均高于木屑栽培的桑黄子实体,前者的桑黄总多糖含量是后者的2倍。据此认为,在进行人工培养桑黄子实体时,除了要考虑桑黄菌种之外,还需要对栽培基质进行选择。然而,从资源高效利用的角度看,即使木屑栽培桑黄的总多糖低于段木栽培桑黄的总多糖,但仍可以对木屑栽培方式的培养基进行优化研究,使其生产的桑黄含有药理作用的化学成分与段木栽培的桑黄持平或者更高。
3.2.2 提取方法及提取介质
周慧吉等[13]进行了热水提取法、超声波辅助提取法和酶提取法获取桑黄多糖的理化性质检测分析,结果表明采用酶提取法得到的桑黄多糖含有单糖的种类最多,可能是由于酶溶解细胞壁的效果良好,使大量的多糖被溶解出来;在电子显微镜下观察不同方法提取得到多糖的形态各不相同,热水提取法提取的粗多糖为大粒径的光滑球状且有大块片状,超声波辅助提取法的粗多糖为小粒径球状,采用酶提取法得到的多糖却为棉絮状,这是否与多糖的结构有关,尚需要做进一步的分析。提取介质对桑黄多糖的抗氧化活性也有很大影响,使用酸溶液和碱溶液作为提取介质获得桑黄多糖的抗氧化性比通过热水提取的桑黄多糖强,低分子量组分和糖醛酸含量较高多糖的抗氧化性也相对较强[3]。Wu等[16]将用乙醇沉淀分离获得的桑黄多糖(C-PLPS)与通过氯化胆碱([Chol]Cl)/KHPO为基础的双水相体系分离获得的桑黄多糖(PLPS)进行比较,PLPS的结构特征与之相似,但是单糖组成不同且分子量较低,碳水化合物含量也较高,以上差异也使得二者的抗氧化性有差异。
3.2.3 多糖组成及分子量和结构
影响桑黄多糖的药理作用除了上述因素外,多糖的组成、分子量和结构也是重要的影响因素。Mei等[23]从桑黄中分离纯化出了2种多糖(PLPS-1 和PLPS-2),但是它们的抗肿瘤的作用存在明显差异,PLPS-1对s-180肉瘤细胞具有强抑制作用,而PLPS-2则对该肉瘤细胞无抑制作用。研究人员进一步通过GC测定以上2种多糖的组成,其中PLPS-1由葡萄糖、阿拉伯糖、岩藻糖、半乳糖和木糖组成,而PLPS-2由葡萄糖、半乳糖、甘露糖、阿拉伯糖、岩藻糖和木糖组成;采用苯酚-硫酸比色法测定2种多糖的碳水化合物含量,并且通过红外光谱、甲基化、核磁共振分析2种多糖的结构,发现这2种多糖除了单糖组成不一致外,多糖的主链结构和侧链也不一致,PLPS-1的主链是α-D-Glc(1 → 4)- α-D-Glc(1 → 6),侧链是α-(1 → 4)-D-Gal、 α-(1 → 3)-D-Xyl、β-L-Ara、α-D-Fuc,而PLPS-2的主链是α-(1 → 3)-D-Glc和 α-(1 → 6)-D-Glc,侧链是α- (1 → 4)-D-Man、α-(1 → 4)-D-Gal、 α-(1 → 3)-D-Xyl、β-L-Ara、α-D-Fuc,由此推断2种桑黄多糖的抑制肿瘤细胞作用的差异与其结构有关。
4 桑黄及桑黄多糖的应用概况与展望
4.1 应用概况
桑黄在中国医药古籍中的记载历史已有2 000年之久,人们通常是将桑黄作为传统饮片泡水、煎茶、泡酒等服用。随着现代技术对桑黄药理作用的解析,目前人们已经可以将桑黄的有效药用成分多糖提取及分离纯化出来,再制备成具有抗肿瘤、降血糖、抗氧化等功效的药品以及保健品和美容美妆产品等。以桑黄多糖为主的桑黄制品也在不断丰富:研制了复方桑黄粗多糖口服液,通过对小鼠的实验,明确复方桑黄口服液粗多糖有提高机体免疫的功能[45];已研制的桑黄多糖分散片经过重现性试验、含量测定、崩解时限测定和分散均匀性检查等,证明其符合药典对分散片的要求[46];以桑黄和山药为原料,制作出具有保健作用的山药桑黄酒精饮料[47];以桑黄菌丝液、大麦芽等为原料,开发出一款桑黄啤酒[48];以桑黄醇提物为原料研制成的BB霜,除了可利用其天然的黄色色素调节肤色外,所具有的抗氧化、消炎、抗过敏等药理作用还使产品具有修护功效,即使是敏感肌肤人群也可以使用[49]。
4.2 研究及应用展望
近10多年来,桑黄因其抗肿瘤、抑制血糖、抗氧化等作用受到广泛关注。研究人员发现,桑黄主要活性成分桑黄多糖的提取方法对其功能基团(糖环和糖苷键的类型)并不产生影响[7],但是对其结构特征和单糖组成影响很大。因此,在选择桑黄多糖提取方法及工艺技术条件时,需要在考虑提取率和多糖含量的同时,也考虑到目标多糖的单糖组成、生物活性以及生产成本、工艺操作的简便和绿色环保等因素。一些食用菌类多糖的提取已经成功研发出了许多方法,例如脉冲电场辅助提取、超临界流体提取、亚临界液体提取、均质提取、真空提取、电解氧化水溶剂提取以及纳米颗粒技术的应用等[50],因此桑黄多糖的提取技术也亟待创新。
桑黄药用生物活性成分的研究起步较晚。近10多年桑黄的药理作用研究逐渐由体外试验向体内研究的方向发展,桑黄的药用有效成分和其他药物的协同作用也开始有了较为系统深入的研究。随着桑黄药理作用的逐渐明晰,许多国家的研发者已将桑黄应用到抗癌药物以及美容抗衰老的保健品中,研制出以桑黄多糖为主要活性成分的系列抗癌新药、保健食品和美容产品,这也将是今后桑黄产品研发的主要方向。
基于桑黄需求市场不断增大的现状,研究人员不仅致力于桑黄有效成分的结构、作用机理、临床应用评价、药物成品等方面的研究,也针对桑黄人工培养的技术难题进行攻关。其中,研究桑黄的固体培养和液体培养的基料成分及配比成为促进桑黄人工培养实用、高效化的重点目标;桑黄种类、人工培养途径、培养基料与基料的配比对产品药效及临床评价的影响,也是重要的研究内容。

