水稻咖啡酰辅酶A-O-甲基转移酶基因的原核表达、抗体制备和应用
索青青 吴楠 杨慧 李莉 王锡锋
(中国农业科学院植物保护研究所 植物病虫害生物学国家重点实验室,北京 100193)
木质素是植物生长发育过程中重要的次生代谢产物,也是合成其它疏水聚合物(如角质、木栓素和孢粉素)以及一系列可溶性特殊代谢物(包括类黄酮、羟基肉桂酸酯、木脂素、单宁和二苯乙烯)所必需的[1]。木质素具有极其重要的生物学功能。首先,它是植物细胞壁的重要组分[2],几乎所有的陆地植物和一些藻类都能合成木质素;其次,它在保护植物抵御机械损伤、外来病原物入侵、胁迫响应(如紫外线辐射),水分和养分运输等方面发挥着重要作用[3]。木质素的生物合成主要是通过苯丙氨酸/酪氨酸代谢途径[4],首先苯丙氨酸或酪氨酸脱氨形成肉桂酸,经过羟基化、甲基化和还原等一系列步骤后,形成3种主要单体(对香豆醇、松柏醇和芥子醇)[5],最终由3种单体脱氢聚合形成一种复杂的酚类聚合物[6]。
咖啡酰辅酶A-O-甲基转移酶(caffeoylcoenzyme A-O-methyltransferase,CCoAOMT)是木质素合成过程中的关键酶之一,它是一类S-腺苷甲硫氨酸甲基转移酶,在木质素合成途径中以咖啡酰辅酶A为底物,将S-腺苷甲硫氨酸上的甲基基团转移到底物苯环上,形成阿魏酰辅酶A[7]。咖啡酰辅酶A-O-甲基转移酶与木质素合成过程中的其他酶相比发现较晚。Pakusch等[8]于1989年首次发现并提出可能存在一种催化咖啡酰辅酶A甲基化的甲基转移酶,且该酶的活性受真菌激活诱导。后在拟南芥、水稻、棉花、烟草等多种植物中都相继成功克隆到CCoAOMT基因[7]。有研究表明,在烟草中表达CCoAOMT基因序列的反义拷贝导致总木质素含量减少,并伴随着矮化表型以及叶片和花的形态改变[9]。小麦TaCCoAOMT1基因在茎和根中高表达,它对木质素的生物合成很重要,与茎的成熟度有关[3]。在CCoAOMT基因表达被抑制的转基因烟草与杨树中,木质素含量显著降低[10-11]。由于木质素具有支撑细胞壁的功能,也被认为与植物的抗逆或抗病性有关[12]。甜菜M14品系BvM14-CCoAOMT基因的过量表达能够提高烟草对干旱、高盐胁迫的抗性[13]。最新研究表明拟南芥CCoAOMT1基因可通过调节 H2O2积累和脱落酸信号传导在响应干旱胁迫中发挥积极作用[14]。该酶对于水稻生长发育以及抗逆抗病性等方面中的功能研究少见报道,目前仅有研究证明水稻中3个OsCCoAOMT基因(OsCCoAOMT1、OsCCoAOMT20、OsCCoAOMT26)可能与植物中木质化进程有关[15]。
为进一步了解OsCCoAOMT1基因在水稻生长发育、营养利用和抗病中的重要作用,急需制备该基因所编码蛋白的抗体。本研究通过PCR扩增技术克隆得到OsCCoAOMT1基因,并将其构建在原核表达载体上,转化大肠杆菌,表达重组蛋白,蛋白经纯化后,注射新西兰公兔,成功获得了多克隆抗体。对该抗体进行纯化后检测其特异性与有效性,并通过免疫荧光手段将抗体标记水稻原生质体观察该蛋白在水稻细胞中的定位情况,为后续对水稻咖啡酰辅酶A-O-甲基转移酶的功能研究奠定良好基础。
1 材料与方法
1.1 材料
1.1.1 植物材料 供试水稻品种为镇稻99,由本实验室长期保存,置于光期14 h,温度为30℃;暗期10 h,温度为28℃的光照培养箱中生长。
1.1.2 菌株和载体 原核表达载体pET30a(+)购自Invitrogen公司(美国),原核表达菌株大肠杆菌(Escherichia coli)BL21(DE3)购自全式金公司。
1.1.3 实验试剂 RNA isolater Total RNA Extraction Reagent,2 × Phanta Max Master Mix(Dye Plus),2× Universal Ligation Mix购自南京诺唯赞生物科技股份有限公司;限制性内切酶NdeI和Hind III购自北京康润诚业生物科技有限公司(GenStar);IPTG、NC膜购自Sigma公司(美国);DNA回收试剂盒购自艾德科技(北京)有限公司;质粒小提试剂盒购自Axygen公司(美国);Dylight 568购自美国KPL公司。
1.2 方法
1.2.1 引物设计及目的基因的克隆 根据OsCCoAOMT1基因编码区序列设计带酶切位点NdeI和Hind III的引物OsCCoAOMT1-F1:5'-CATATGATGGCCGAGGCGGCGTCG-3'(引入酶切位点NdeI);OsCCoAOMT1-R1:5'-AAGCTTTCACTTGACGCGGCGGCAGAG-3'(引入酶切位点Hind III)。
利用Trizol法提取水稻总RNA,反转录得到cDNA,以cDNA为模板,利用带有酶切位点的上下游引物进行PCR扩增得到同样带有酶切位点的目的基因片段。
1.2.2 原核表达载体的构建 用限制性内切酶NdeI和Hind III双酶切纯化后的目的基因片段和pET30a(+)载体,将酶切后的目的基因片段和pET30a(+)载体用2 × Universal Ligation Mix连接,得到原核表达载体pET30a(+)-OsCCoAOMT1。
1.2.3 重组蛋白诱导表达 将重组质粒pET30a(+)-OsCCoAOMT1转化到大肠杆菌BL21(DE3)感受态细胞中。挑选3个生长良好的阳性克隆,分别接种到含有50 μg/mL卡那霉素的4 mL 液体LB培养基中。置于37℃的摇床中,以200 r/min的转速摇动。当OD600值达到0.6-0.8时,在其中两个离心管中加入IPTG至终浓度为0.5 mmol/L,分别在15℃下诱导16 h和37℃下诱导4 h,最后一个离心管作为阴性对照不加入IPTG。后将菌液离心,收集沉淀,加入300 μL裂解缓冲液(50 mmol/L Tris,150 mmol/L NaCl,5%甘油pH = 8.0)在超声破碎仪中超声破碎1 min。将50 μL 5×Loading buffer与100 μL细胞裂解液混合,作为全细胞裂解液样品。100℃沸水中加热样品10 min,并在15 000 r/min下离心5 min。将剩余的200 μL细胞裂解液在15 000 r/min下离心10 min,收集细胞裂解液上清液和沉淀,分别将90 μL 5×Loading buffer与180 μL上清液混合,作为细胞裂解液上清液样品。用150 μL 5×Loading buffer重悬沉淀,作为细胞裂解液沉淀样品。将样品在100℃沸水中加热10 min,15 000 r/min下 离 心5 min,利 用SDSPAGE电泳对所得上清和沉淀样品进行检测。
1.2.4 抗体制备和Western blot检测 为了进一步得到OsCCoAOMT1可溶性蛋白,将其按照最优条件诱导,菌体经超声破碎后离心,收集上清,Ni2+-NTA抗原亲和柱纯化蛋白,纯化后的蛋白注射于新西兰公兔,经3次加强免疫后收集相应的抗血清。提取水稻茎和叶总蛋白,通过Western blot对抗体进行特异性检测。
1.2.5 免疫荧光法标记原生质体 原生质体来源于本实验室前期创制的超表达带有GFP荧光标记OsCCoAOMT1的转基因水稻(转录倍数提高21倍)及其野生型水稻品种镇稻99,利用酶解法提取水稻茎部原生质体,向细胞培养皿中加入500 μL 原生质体悬液,再用滴管小心的滴入4%多聚甲醛,室温固定1 h;300 r/min离心5 min,用宽口枪头小心吸除固定液,8%甘露醇洗3次,每次5 min;向培养皿中加入300 μL 制备的OsCCoAOMT1蛋白抗体稀释液(抗体用3% BSA按1∶100稀释),于室温孵育1-2 h;300 r/min离心5 min,用宽口枪头小心吸去抗体稀释液,8%甘露醇洗3次,每次5 min;考虑到转基因水稻带有GFP荧光标记,采用Dylight 568标记的二抗,37℃孵育1-2 h;8%甘露醇洗去残留的二抗,制片,利用激光共聚焦显微镜观察该蛋白在原生质体中的定位。
2 结果
2.1 目的基因OsCCoAOMT1的克隆
以水稻幼苗总RNA反转录后的cDNA为模板,用PCR扩增方法得到目的基因OsCCoAOMT1全长782 bp,与预期结果相符(图1)。将目的基因片段切胶回收,并用限制性内切酶NdeI和Hind III进行双酶切。
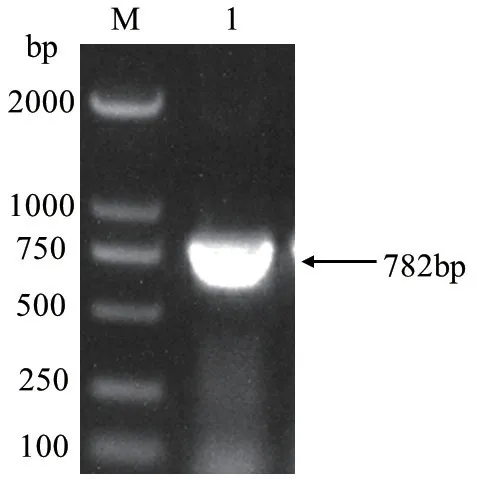
图1 OsCCoAOMT1基因的PCR扩增结果Fig.1 PCR amplifying product of OsCCoAOMT1 gene
2.2 原核表达载体的构建
将pET30a(+)载体用限制性内切酶NdeI和Hind III进行双酶切,与酶切后的目的片段相连接,并转化E. coliBL21(DE3)感受态细胞中,涂布在带有卡那霉素抗性的平板上,筛选阳性克隆后提取重组质粒pET30a(+)-OsCCoAOMT1,将阳性质粒测序并以NdeI和HindIII双酶切验证。测序结果显示克隆片段序列与目的序列相似性为100%,酶切阳性质粒可得到两条带,分别为5 422 bp和782 bp(图2),表明该载体已成功构建。
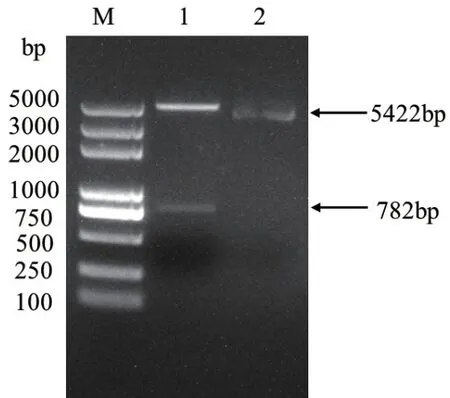
图2 重组质粒pET30a(+)-OsCCoAOMT1的酶切鉴定Fig.2 Restriction identification of recombinant plasmid pET30a(+)-OsCCoAOMT1
2.3 重组蛋白的表达与纯化
挑取阳性单菌落于LB液体培养基中培养,加入IPTG至终浓度为0.5 mmol/L,分别在15℃条件下诱导16 h和37℃条件下诱导4 h后,加入细胞裂解液得到全细胞裂解液、上清和沉淀样品,经SDSPAGE电泳(图3)与Western blot(图4)对所得样品进行检测,结果表明该蛋白最佳诱导条件为IPTG终浓度为0.5 mmol/L下37℃下诱导4 h,并且该蛋白在上清中有较高的含量。在该诱导条件诱导重组蛋白大量表达,菌体经超声破碎后离心,收集上清,Ni2+-NTA抗原亲和柱纯化蛋白,纯化后的蛋白经SDS-PAGE电泳(图5)可知其蛋白条带单一,并通过BCA法测定纯化后的蛋白浓度达到0.83 mg/mL。

图3 重组质粒pET30a(+)-OsCCoAOMT1不同诱导条件下的SDS-PAGE分析Fig.3 SDS-PAGE analysis of recombinant plasmid pET30a(+)-OsCCoAOMT1 under the different inducing condition
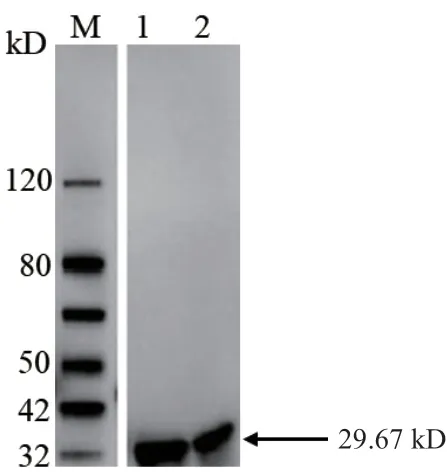
图4 重组质粒pET30a(+)-OsCCoAOMT1不同诱导条件下的Western blot分析Fig.4 Western blot analysis of recombinant plasmid pET30a(+)-OsCCoAOMT1 under the different inducing condition

图5 OsCCoAOMT1蛋白的纯化Fig.5 Purification of OsCCoAOMT1 protein
2.4 OsCCoAOMT1抗体制备和Western blot
将纯化后的OsCCoAOMT1蛋白注射于新西兰公兔,经3次加强免疫后收集相应的抗血清。为了检测 OsCCoAOMT1抗体的特异性,分别提取水稻茎、叶总蛋白,以同样的OsCCoAOMT1抗体浓度(1∶1 000)进行Western blot,结果表明,不同组织的水稻总蛋白均显示目的大小的条带(图6),且由条带强弱可知该蛋白在水稻不同部位的表达量不同,茎中的表达量要高于叶。同时将水稻幼苗总蛋白(3.8 mg/mL)分别稀释2倍、4倍、8倍、16倍,在相同抗体浓度(1∶1 000)下孵育,均可得到单一目的条带,并且条带逐渐变弱(图7)。以上结果表明该抗体可以广泛应用于水稻的不同组织和部位,并且具有较高的灵敏度和良好的特异性。
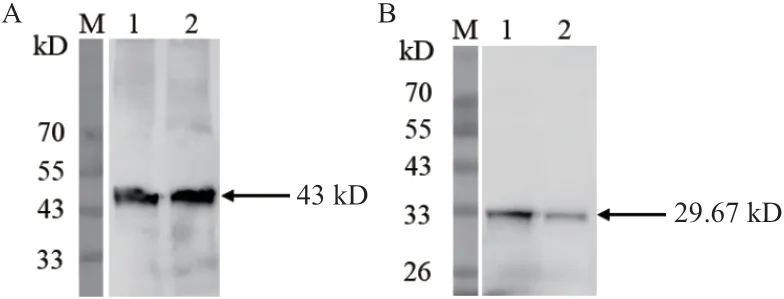
图6 水稻茎、叶中OsCCoAOMT1的Western blot 检测Fig.6 Western blot analysis of OsCCoAOMT1 in rice stem and leaf
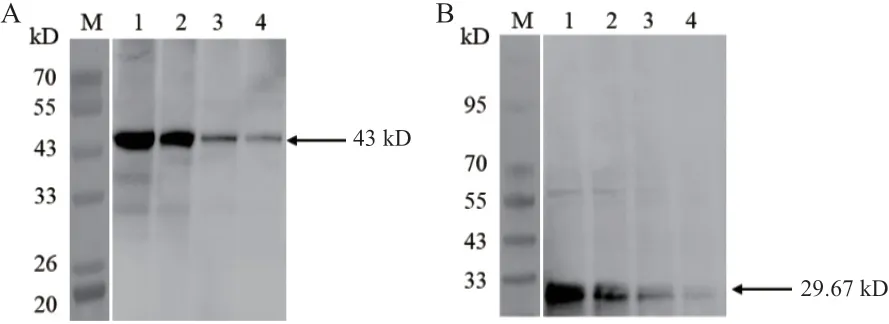
图7 水稻不同蛋白浓度Western blot检测Fig.7 Western blot analysis of different protein concentrations in rice
2.5 原生质体标记
参考本实验室已有的方法[16],对野生型和转基因水稻茎原生质体进行免疫荧光标记,野生型和转基因水稻在激光共聚焦显微镜下均可检测到抗体信号(图8),且转基因水稻的GFP信号可以与抗体的信号共定位。同时对水稻茎的细胞质与细胞核蛋白进行分离,而后分别对细胞质蛋白和细胞核蛋白进行Western blot,结果(图9)表明,同等样品下胞质中OsCCoAOMT1蛋白含量远高于其在细胞核中的含量,说明OsCCoAOMT1蛋白主要存在于细胞质中。因此可以充分说明该抗体特异性良好,且可特异性的用于免疫荧光分析。

图8 OsCCoAOMT1蛋白在野生型(A)和转基因(B)水稻茎原生质体中的定位分析Fig.8 Location analysis of OsCCoAOMT1 protein in the wild-type(A)and transgenic(B)rice stem protoplasts
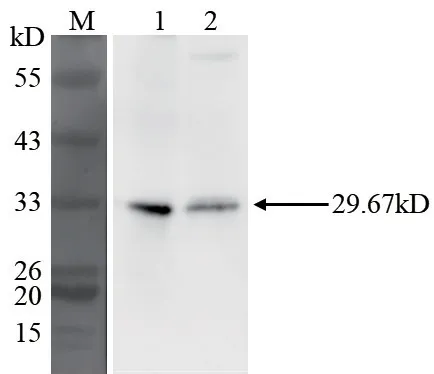
图9 OsCCoAOMT1蛋白在水稻细胞质和细胞核中的表达量分析Fig. 9 Expression level analysis the OsCCoAOMT1 protein in rice cytoplasm and nucleus
3 讨论
利用原核表达重组蛋白免疫动物来制备抗体是研究蛋白质功能的重要手段之一[17]。通过原核表达获得大量的抗原蛋白,可用于蛋白性质、功能、蛋白间相互作用及多种生化功能的研究[18]。本文首先构建原核表达载体pET30a(+)-OsCCoAOMT1,再转化到大肠杆菌感受态细胞中。诱导条件是原核表达系统表达外源蛋白的重要因素[19],因此我们选择了在IPTG终浓度为0.5 mmol/L时,在不同的温度,不同时间下诱导,优化获得了该蛋白高效表达的最佳诱导条件:37℃条件下诱导4 h。当制备多克隆抗体时,作为抗原的蛋白质纯度越高,获得的抗体特异性越好[20]。由于OsCCoAOMT1蛋白在上清中的表达量更高,因此我们选择Ni2+-NTA亲和柱纯化,获得高纯度的蛋白后将其免疫新西兰公兔,成功制备了多克隆抗体。
关于OsCCoAOMT1蛋白的具体功能及其在水稻生长发育以及抗病防御机制中的研究较少。最近有研究表明,编码玉米咖啡酰辅酶A-O-甲基转移酶基因ZmCCoAOMT2对多种病原菌具有数量抗性,且在拟南芥Col-0中,CCoAOMT1基因也在病原体或激发子处理后被诱导,推测其可能在抗性功能中起重要作用[21]。OsCCoAOMT1基因作为水稻木质素合成过程中的重要酶,仅有研究表明其可能参与调控水稻的木质化进程[15]。本研究用制备的抗体对水稻不同组织和部位进行Western blot 检测发现OsCCoAOMT1蛋白在水稻茎部和叶部均有表达,且茎中表达量高于叶中表达量,由此推测其可能在水稻茎的伸长及营养运输等方面发挥重要作用。通过免疫荧光法对转基因和野生型水稻茎原生质体进行标记,激光共聚焦显微镜可观察到转基因水稻的GFP信号可以与抗体的信号共定位,说明该抗体特异性好,可后续用于免疫荧光分析,同时将水稻茎核质蛋白分离,经Western blot检测可知该蛋白主要定位在细胞质中,推测其可能参与细胞质相关代谢过程。但也有相关研究表明甜菜M14品系BvM14-CCoAOMT蛋白可定位于细胞核、质膜上[22],因此关于该蛋白的定位情况还有待深入研究。
4 结论
本研究利用重组DNA技术成功构建了pET30a(+)-OsCCoAOMT1原核表达载体,确定了该蛋白的最佳诱导条件为IPTG终浓度0.5 mmol/L,37℃下诱导4 h,在该条件下大量表达和纯化该蛋白,成功制备了OsCCoAOMT1蛋白的多克隆抗体。OsCCoAOMT1蛋白在水稻茎部表达量更高,推测其可能参与水稻茎部生长发育和营养运输,且该抗体可特异性的用于免疫荧光分析,为后续研究其在水稻生长发育以及抵抗病原侵染等功能奠定了基础。