基因TOB1 通过BCL-2 和BCL-xl 抑制胶质瘤细胞的生长*
杨娴,迟爱秋,范思佳,张伟龙,张琪玟,唐天珍,王佳慧,张青,武艺笑,饶建,林社裕***
(1 南通大学生命科学学院,南通 226019;2 复旦大学上海医学院;3 广西大学生命科学与技术学院;4 南通大学附属医院神经外科)
胶质瘤是由中枢神经系统的神经胶质细胞引起的原发性肿瘤,神经胶质细胞分为3 种类型:星形胶质细胞、少突胶质细胞和小胶质细胞,其中由星形胶质细胞引发的胶质瘤称为星形细胞瘤。胶质母细胞瘤(glioblastoma multiforme,GBM)是所有胶质瘤中最具侵袭性的一种类型[1]。恶性GBM 具有高度的增殖性和侵袭性,尽管手术、放疗和化疗在不断地改进,但预后依然较差,5 年生存率<5%[2]。与其他肿瘤相比,胶质瘤可分泌多种分子,促进肿瘤的生长和增殖,这种对细胞凋亡和增殖的固有抵抗可能是胶质瘤患者预后差的主要原因[3-5]。因此,胶质瘤患者迫切需要新的治疗方案。
TOB1 是抗增殖蛋白家族的成员,在转录和mRNA衰减中起重要作用[6]。TOB1 的亚细胞定位表明,其分布在细胞质并通过细胞核与细胞质的穿梭作用抑制细胞增殖[7]。在乳腺癌中,TOB1 可抑制肿瘤发生,并可作为淋巴结阴性乳腺癌预后不良的标志物[8]。此外,TOB1 可通过激活Smad4 和抑制β-catenin 信号通路诱导胃癌细胞凋亡,抑制胃癌细胞增殖、迁移和侵袭[9]。然而,在胶质瘤中,TOB1 基因是否仍具有抑瘤作用,是否促进细胞凋亡,抑制细胞增殖尚不清楚。
微小RNA(microRNAs,miRNAs)是一种短的、非编码的基因表达调控RNA,通过与特定靶mRNA 序列的3'-非翻译区(3'-untranslated region,3'-UTR)结合,在转录后水平调控基因表达[10]。MiRNAs 已被报道参与了肿瘤的生长、增殖或凋亡[11]。
促凋亡还是抗凋亡由BCL-2 家族蛋白之间的平衡决定,该家族的抗凋亡成员包括BCL-2(BCL2 apoptosis regulator)、BCL-xl(BCL2 like 1)、BCL-W(BCL2 like 2)、MCL-1(MCL1 apoptosis regulator)和BFL-1(BCL2 related protein A1),这些蛋白通过与促凋亡蛋白相互作用来抑制凋亡[12-13]。
本研究探讨TOB1 对胶质瘤细胞活力、细胞周期和凋亡的影响,旨为胶质瘤的诊断和治疗提供依据。
1 材料和方法
1.1 试剂和样本 收集南通大学附属医院神经胶质瘤样本15 例及成人颅脑损伤需部分切除脑组织以降低颅内压的患者组织标本10 例。所有人体样本均按照南通大学附属医院机构评审委员会制定的政策使用。细胞培养相关试剂购自Thermo Scientific 公司(上海,中国)。U251 细胞株购自中国科学院细胞库。细胞周期分析、细胞活力检测和蛋白提取的试剂盒购自中国海门碧云天生物技术研究所。兔抗人TOB1 多克隆抗体购自LifeSpan BioSciences 公司(西雅图,美国)、兔抗磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)多克隆抗体购自武汉博士德生物科技有限公司(武汉,中国)。辣根过氧化物酶标记山羊抗兔IgG 二抗购自KPL 公司(切斯特,美国)。
1.2 免疫组织化学 脑组织用预冷甲醇固定,然后乙醇梯度脱水、石蜡包埋、切片。缓冲液阻断。抗人TOB1 兔多克隆抗体、兔抗人BCL-2 或BCL-xl 单克隆抗体孵育。磷酸缓冲盐溶液(phosphate buffered saline,PBS)洗涤后,与生物素化的二抗反应(博士德,武汉,中国),并用SABC 试剂盒检测,苏木精复染,树脂封片。
1.3 靶向TOB1 基因的miRNA 测定 利用在线软件TarBase V7.0、miRTarbase 及TargetScan 预测靶向TOB1 的可能miRNA,这3 个软件预测的原理是依据实验或种子区保守位点进行搜索。将U251 细胞以1×105细胞/mL 的密度接种到6 cm 培养皿中。当细胞融合度达到80%时,分别转染miR-25-3p、miR-32-5p 和miR-92a-5p,48 h 后,用RIPA 裂解缓冲液提取总蛋白,Western Blot 检测蛋白表达。
1.4 荧光素酶报告基因系统确认TOB1 为miR-92a-3p 的靶基因 基因TOB1 3'-UTR 中miR-92a-3p 的互补序列被扩增,并在BamHⅠ及SalⅠ酶切位点处克隆到pGL3-Promoter 载体中。然后,将U251细胞以3×105细胞/mL 的密度将接种于6 孔板。24 h后,分别转染TOB1 3'-UTR 质粒,TOB1 3'-UTR 突变质粒及pGL3-Promoter 质粒(阴性对照)。同时,这些细胞共转染miR-92a-3p mimic。48 h 后,收集细胞,用荧光素酶检测试剂盒检测,酶标仪检测荧光强度。
1.5 细胞培养与感染 人胶质瘤细胞株U251 用杜尔贝科改良伊格尔培养基(Dulbecco's modified Eagle medium,DMEM)培养。当细胞生长到聚合度达70%~90%时,换为无血清培养基,并进行感染实验,感染病毒分别为TOB1 过表达慢病毒、TOB1 干扰慢病毒及对照慢病毒。
1.6 Western Blot 采用RIPA 裂解缓冲液提取蛋白,BCA 检测试剂盒对蛋白进行定量,然后电泳,并转移到Whatman 硝酸纤维素膜上。与一抗反应过夜,二抗反应4 h,最后用ECL 化学发光试剂进行显影检测。
1.7 U251 细胞活力的测定 采用噻唑蓝比色法(methyl thiazolyl tetrazolium,MTT)检测TOB1 对胶质瘤细胞U251 活力的影响。将U251 孵育24 h 后,加入MTT(5 mg/mL),再孵育4 h。加入二甲亚砜150 μL/孔以溶解晶体。用酶标仪在570 nm 波长处检测光密度(optical density,OD)值。
1.8 U251 细胞周期测定 采用流式细胞术分析TOB1 对胶质瘤细胞U251 细胞周期的影响。首先用胰蛋白酶消化细胞,PBS 洗涤碘化丙啶(propidium iodide,PI)染色,流式细胞仪检测细胞周期。
1.9 U251 细胞凋亡测定 采用流式细胞仪分析U251 细胞凋亡情况。收集U251 细胞,分别加入5 μL PE Annexin V 和5 mL 7-AAD。然后每管加入400 μL 1×结合缓冲液,混匀,立即进行流式细胞仪分析。
1.10 实时聚合酶链式反应(real time polymerase chain reaction,Real-time PCR)分析 采用Trizol 试剂提取总RNA,逆转录得到cDNA,并利用ABI PRISM 7500 系统进行Real-time PCR 扩增凋亡相关因子BCL-2、BCL-xl 等。
1.11 统计学方法 利用SPSS 20.0 软件进行统计分析,双荧光素酶报告基因检测、细胞活力、增殖指数、凋亡检测及凋亡因子Real-time PCR 的分析采用单因素方差分析(one-way ANOVA),免疫组化实验灰度值统计分析采用Student t 检验。数值用表示,双尾P 值,P<0.05 为差异有统计学意义。
2 结果
2.1 TOB1 在胶质瘤组织中的表达受到抑制 免疫组化分析结果显示,与正常脑组织相比,脑胶质瘤组织中TOB1 基因的表达受到抑制(P<0.05)(图1)。

图1 脑胶质瘤中TOB1 表达受到抑制
2.2 靶向TOB1 的miRNA 检测 对在线软件预测的miRNA 进行Real-time PCR 检测,初步筛选结果发现靶向TOB1 的可能miRNA 包括miR-25-3p、miR-32-5p 和miR-92a-3p。这些miRNA 由Genepharma Inc.合成,并转染到U251 细胞株中。通过Western Blot 检测TOB1 的表达情况,结果表明,miR-25-3p、miR-32-5p 和miR-92a-3p 均能调控TOB1 基因的表达,其中miR-92a-3p 的作用最强(图2A)。
构建含有TOB1 的3'-UTR 的荧光素酶报告分析载体(TOB1-3'-UTR)和相应的含有TOB1 的3'-UTR 突变的载体(TOB1-3'-UTR 突变)(图2B)。这些质粒包括pGL-3-promoter 质粒(阴性对照)分别与miR-92a-3p mimics 共转染U251 细胞。分析结果显示,与阴性对照及TOB1-3'-UTR 突变组相比,TOB1-3'-UTR 组的荧光素酶相对活性显著降低(P<0.01)(图2C)。这些结果表明,miR-92a-3p 可以通过直接结合TOB1 基因的3'-UTR 调控TOB1 的表达。
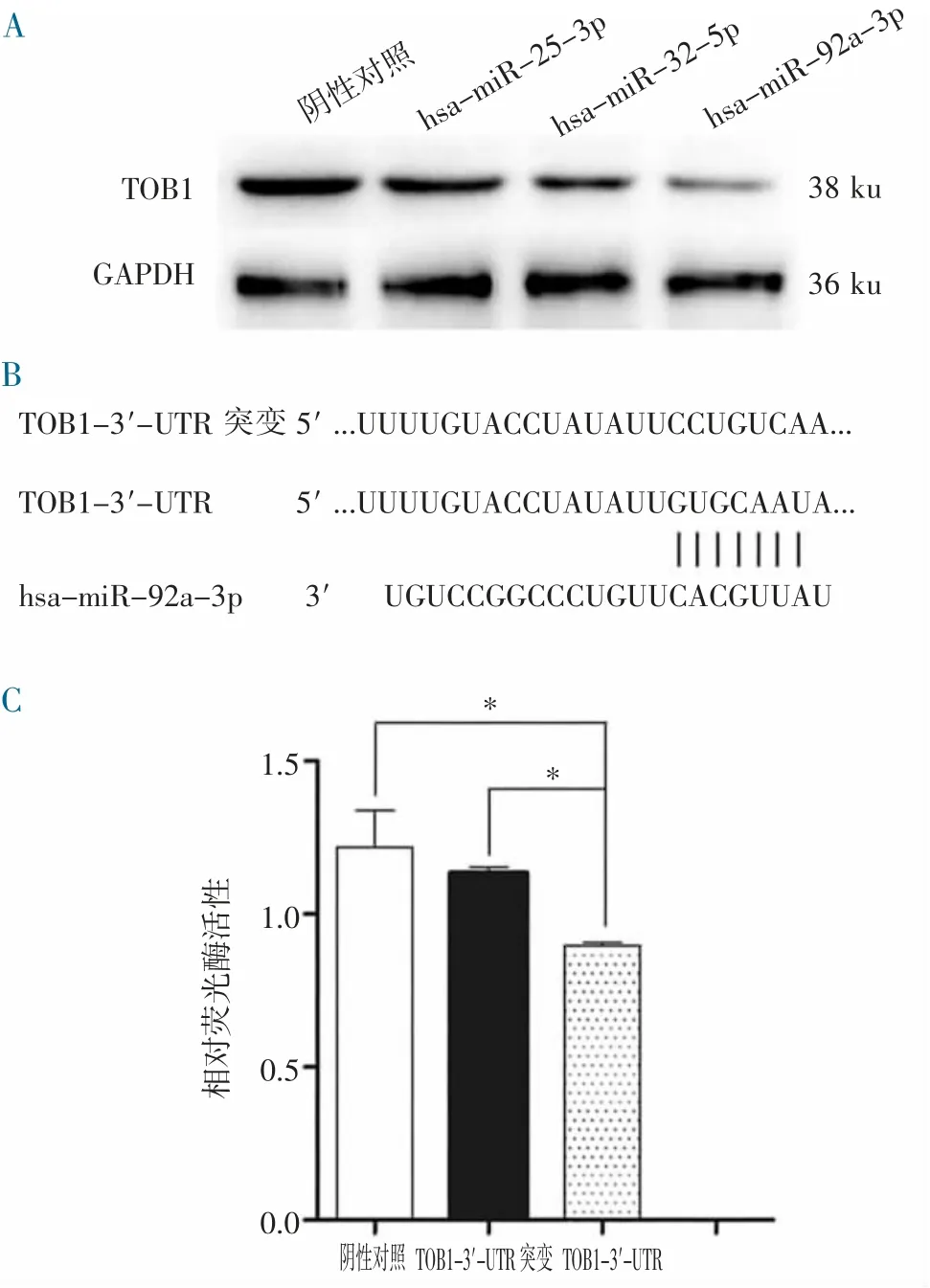
图2 靶向TOB1 的miRNA 表达分析,并确认miR-92a-3p与TOB1 3'-UTR 的相互作用
2.3 基因TOB1 与细胞行为学的关系分析 将U251 细胞分别感染对照慢病毒(对照组)、TOB1 过表达慢病毒(过表达组)和TOB1 siRNA 慢病毒(干扰组)。感染后72 h,Western Blot 结果显示,过表达组的TOB1 蛋白水平显著高于对照组(P<0.05);干扰组的TOB1 蛋白水平显著低于对照组(P<0.05)(图3A)。然后对3 个稳转细胞系进行MTT 检测,结果表明:过表达组的U251 细胞活力明显低于对照组(P<0.05);干扰组U251 细胞活力显著高于对照组(P<0.05)(图3B)。细胞周期分析显示,过表达组PI 显著低于干扰组(P<0.05)(图3C)。流式细胞术结果显示,过表达组的凋亡细胞比例显著高于对照组;干扰组的凋亡细胞比例显著低于对照组(P<0.05)(图3D)。这些结果提示基因TOB1 可以通过降低U251 细胞活力,减少U251 细胞分裂,促进U251 细胞的凋亡,进而抑制U251 细胞的生长。
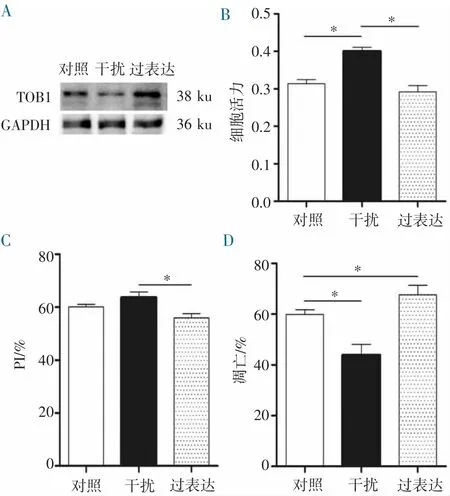
图3 TOB1 对U251 细胞行为的影响
2.4 TOB1 对凋亡相关因子表达的影响 采用Realtime PCR 法检测3 组细胞中凋亡相关因子的表达情况,结果显示,过表达组BCL-2 表达水平显著低于对照组,干扰组BCL-2 表达水平显著高于对照组(均P<0.05);BCL-xl 的表达趋势与BCL-2 相同(P<0.05),而其他凋亡相关因子表达情况说明其不受基因TOB1 的调控(图4)。
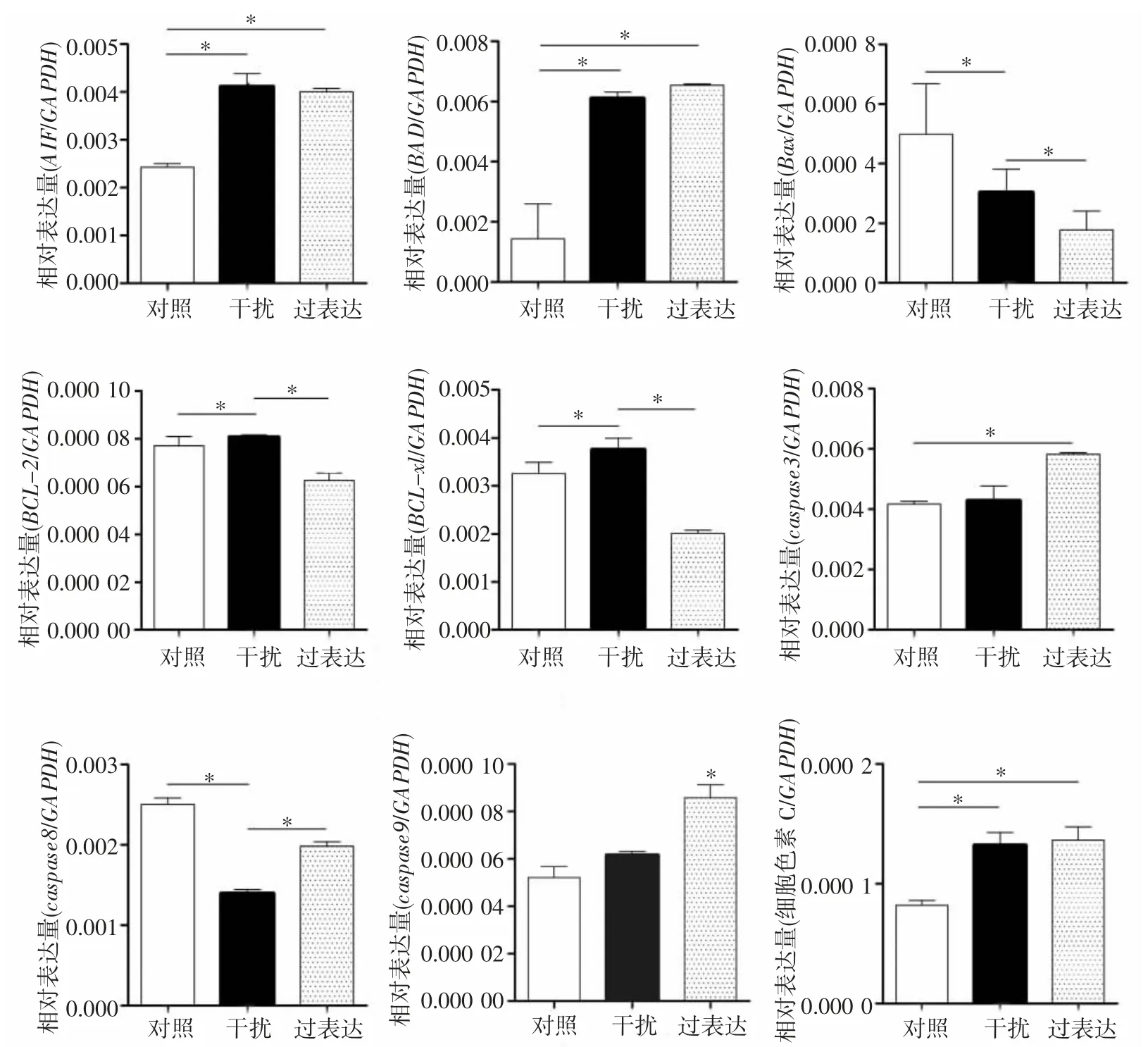
图4 Real-time PCR 分析TOB1 对凋亡相关因子表达的影响(*P<0.05)
2.5 在胶质瘤组织中验证TOB1 调控BCL-xl 和BCL-2 Western Blot 结果显示,BCL-xl 和BCL-2的蛋白表达与mRNA 水平的变化趋势相同(图5A)。免疫组化分析结果显示,正常脑组织中BCL-2 和BCL-xl 水平显著低于胶质瘤组织(图5B~C)。提示BCL-2 和BCL-xl 参与TOB1 抑制细胞增殖和促进细胞凋亡的过程。
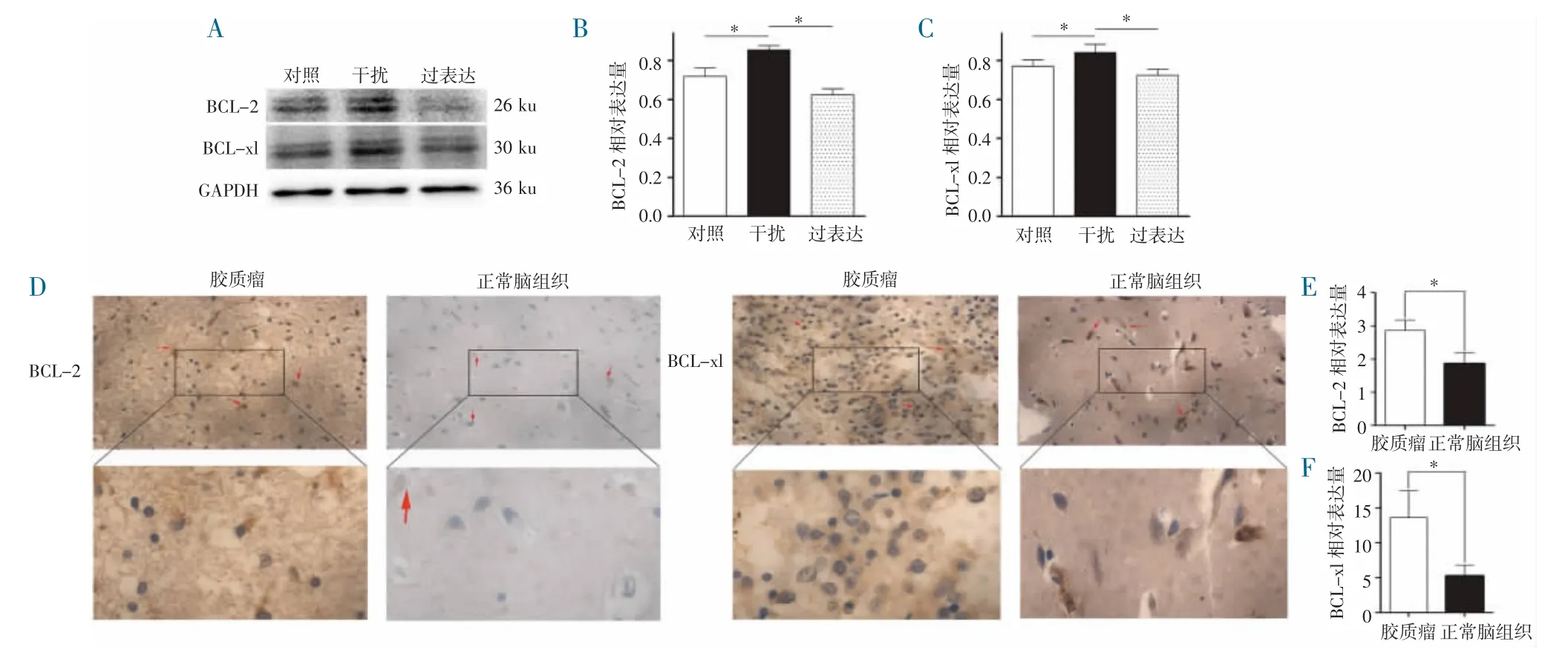
图5 TOB1 对凋亡相关因子BCL-2、BCL-xl 表达的影响
3 讨论
为探索基因TOB1 在胶质瘤中的作用,本研究检测了TOB1 在胶质瘤和正常脑组织中的表达情况,结果显示TOB1 在胶质瘤组织中的表达下调。那么,TOB1 的下调是否与胶质瘤的生长和增殖有关呢?为此,选择U251 细胞株作为胶质瘤的细胞模型,通过构建TOB1 的过表达或干扰组,检测不同模型组的细胞活力、细胞周期和凋亡情况,进而确定基因TOB1与胶质瘤的增殖相关性。结果表明,基因TOB1 可降低细胞活力,增加细胞凋亡率。因此,TOB1 在脑胶质瘤中具有抑瘤作用,该发现与之前发现的TOB1 在其他癌症[14-15]中的作用相一致。
为了探索基因TOB1 下调的原因,本研究分析了多个可能的miRNA,结果表明miR-92a-3p 是最有可能的miRNA。MiR-92a-3p 可以刺激肿瘤相关的巨噬细胞分泌白细胞介素6,并进而导致脂肪肉瘤细胞增殖、侵袭和转移[16]。在胶质瘤中,miR-92a-3p 表达上调,抑制基因Bim 的表达,被认为是癌基因[17]。本研究发现miR-92-3p 通过结合TOB1 基因的3'UTR 区域,降低了基因TOB1 的表达。还证实了基因TOB1 可以通过促进U251 细胞的凋亡来抑制增殖,但是详细的促进细胞凋亡的机制仍不清楚。为此,通过Western Blot 和Real-time PCR 检测了不同处理组U251 细胞中9 种凋亡相关因子。结果表明,抗凋亡因子BCL-2 和BCL-xl 的变化与基因TOB1的变化密切相关。当TOB1 基因上调时,BCL-2 和BCL-xl 的表达显著降低,反之亦然。说明TOB1 通过下调抗凋亡因子来促进胶质瘤细胞的凋亡,此外,胶质瘤组织中的免疫组化也提示BCL-2 和BCL-xl 参与了TOB1 基因诱导的细胞凋亡。
BCL-2,抗凋亡因子,通过增加突变细胞的生存,促进了癌症的形成和发展。事实上,BCL-2 还可以通过其具有的线粒体促凋亡BCL-2 家族成员的BCL-2 同源(BH)结构域3(BH3)对细胞周期发挥抑制作用。在内质网,BCL-2 可以调节Ca2+信号变化,促进细胞增殖,同时增加对凋亡的抵抗作用[18]。根据本研究结果,推测TOB1 诱导的BCL-2 基因的表达调控主要位于线粒体,抗凋亡蛋白BCL-2 表达于线粒体外壁,通过控制线粒体的通透性来调节细胞的凋亡。通常,BCL-2 与促凋亡蛋白,如Bax,形成异二聚体,抑制细胞色素C 释放,调节线粒体跨膜电位,发挥其抗凋亡作用[19]。
BCL-xl 作为一种抗凋亡蛋白,可以阻止细胞色素C 释放到细胞质中,从而抑制细胞凋亡,促进细胞增殖[20]。抗凋亡因子家族BCL-2 的成员BCL-xl 在结构上与Bax 相似,然而,它可以降低膜的渗透性,通过干扰复合物的形成,降低跨膜通道的形成。本研究发现,TOB1 表达上调时,BCL-xl 的表达显著下调,从而引发一系列凋亡相关事件,实现了TOB1 诱导的细胞凋亡。
综上所述,在胶质瘤中,TOB1 是一个肿瘤抑制基因,其表达可能受到miR-92a-3p 的调控而下调,TOB1 可以促进胶质瘤细胞的凋亡,进而抑制其增殖。当然,TOB1 在胶质瘤中的更详细的作用机制仍需要进一步的研究。

