九香虫内生曲霉菌次生代谢产物及其抗菌活性研究
徐笑天,姬凌波,段小群*,王宇晖*
1桂林医学院药学院,桂林 541199;2中国烟草总公司郑州烟草研究院,郑州 450001
微生物的次生代谢产物是抗菌等多种生物活性成分的来源,具有重大的药用价值,近年来也成为天然药物化学研究的热点[1]。昆虫共生真菌是指那些全部或部分生活史在宿主昆虫体内度过、不引起宿主明显感染症状的真菌。它们能分解有机成分为宿主提供营养,帮助宿主抵抗外来微生物侵袭,引起宿主的免疫反应[2,3]。在长期进化过程中,真菌发展出一系列方法适应肠道环境,与宿主形成了稳定的共生关系,它们对宿主的选择和定殖有一定的特殊性。
九香虫,俗称“臭屁虫”,即兜蝽科昆虫瓜黑蝽,是药典收载的一类用药历史悠久的昆虫类中药,在部分地区也作为一种美味食品。《本草纲目》记载九香虫“主治膈脘滞气,脾肾亏损,壮元阳”,可用于肾虚阳痿、腰膝酸软、胃炎胀痛。研究表明,九香虫的滋补作用可能与它富含的丰富的维生素、微量元素、磷脂、氨基酸、蛋白质、脂质及N-乙酰多巴胺类物质有关[4,5]。此外,九香虫提取物对金黄色葡萄球菌、伤寒杆菌、甲型副伤寒杆菌及福氏痢疫杆菌皆有抗菌作用,在其血淋巴中还发现了新型抗菌肽[6]。这些抗菌活性物质可能与九香虫的胃炎治疗相关。九香虫的抗菌作用提示其内生真菌也可能会产生抗菌活性的次生代谢产物。目前对九香虫内生真菌及其代谢产物的研究尚缺乏相关报道。本研究选取九香虫为研究对象,从其肠道中分离得到一株曲霉菌,并采用大米固体培养基进行大规模发酵,对其次生代谢产物进行分离纯化和结构鉴定,并测试抗菌活性,以期得到抗菌活性良好的代谢产物,丰富昆虫内生菌的化学成分和生物活性研究。
1 材料与方法
1.1 材料
质谱由Agilent 6520B Q-TOF质谱仪测定(美国安捷伦仪器有限公司);核磁数据由Bruker AVIII-500及AVIII-600核磁共振仪(布鲁克仪器有限公司)测定(1H NMR:500 MHz和600 MHz;13C NMR:125 MHz和150 MHz),以TMS作为内标;分析型HPLC为Waters 1525型(Symmetry-C18,150 mm×4.6 mm,5 μm,流速1.0 mL/min)、半制备型HPLC为Waters 1525型(Zorbax SB-C18,250 mm×9.4 mm,5 μm,流速4.0 mL/min,美国沃特世仪器有限公司);酶标仪(瑞士帝肯仪器公司);高压灭菌锅(上海申安仪器有限公司);QYC-200型摇床(上海福玛仪器有限公司);正相柱色谱硅胶(200~300目,青岛海洋化工厂);Sephadex LH-20凝胶柱填料(瑞典Pharmacia公司);MCI柱色谱填料(日本三菱公司);所用试剂均为分析纯(天津富宇精细化工有限公司);青霉素(上海麦克林生化试剂有限公司)、硫酸链霉素(北京索莱宝科技有限公司);牛肉膏蛋白胨培养基和马铃薯葡萄糖固体培养基(北京奥博星生物技术有限公司)。
1.2 实验方法
1.2.1 菌种的分离
捕捉九香虫活虫后将虫体消毒,取肠道组织,加入组织匀浆器中研碎。将组织液稀释涂布于马铃薯葡萄糖固体培养基(PDA)上,由此分离得到该曲霉菌。在PDA平板上,该菌为棕黄色绒毛状菌落,表面散布大量孢子,显微镜下可见头状分生孢子梗和圆形孢子(见图1),根据以上形态和显微特征初步鉴定为曲霉属真菌。其18S rDNA和ITS序列鉴定由上海生工有限公司完成,利用PCR技术扩增其18S rDNA和ITS序列后进行测序,发现其18S rDNA序列和ITS序列与Aspergillusflavipes(Genbank accession No.KT809365)100%相似,鉴定为曲霉菌Aspergillussp.。菌种保存于桂林医学院生物技术实验室(保存编号为Aspergillussp.AJXC5-7)。

图1 Aspergillus sp.的形态(A)和显微特征(B,10×40)
1.2.2 发酵、提取与分离
将曲霉菌接种在PDA平板上活化,活化的真菌用刀片切取适量接种于马铃薯葡萄糖液体培养基(PDB)基中,在28 ℃和140 r/min培养5天后作为种子液。取500 mL锥形瓶20个,每瓶装入80 g大米和120 mL蒸馏水,于115 ℃灭菌30 min作为固体发酵培养基。在超净台中,每瓶固体培养基加入10 mL种子液,在28 ℃条件下静置避光培养30天。
固体发酵物用乙酸乙酯提取3次,减压浓缩获得浸膏(40.3 g)。浸膏以硅胶柱分段,分别用石油醚-乙酸乙酯洗脱(20∶1→1∶3),合并后分为8段(A~H)。将E-H段合并上MCI柱,以甲醇-水(10%→100%)洗脱合并为6段(M1~M6)。M3段通过凝胶柱色谱和半制备液相(45%甲醇+0.1%甲酸)进一步分离,得到化合物1(8.3 mg,纯度98.8%,tR= 19.5 min)、2(12.5 mg,纯度99.0%,tR= 28.8 min)、4(28.5 mg,纯度95.7%,tR= 42.8 min)、5(20.4 mg,纯度97.4%,tR= 30.7 min)和6(15.3 mg,纯度91.4%,tR= 34.7 min)。M1段通过凝胶柱色谱重结晶得到化合物3(265.3 mg,纯度97.9%)。
1.2.3 抗菌实验
抗菌实验所用病原细菌为金黄色葡萄球菌(StaphylococcusaureusATCC 25923),枯草芽孢杆菌(BacillussubtilisATCC 6633)和大肠杆菌(EscherichiacoliATCC 25922)。所用细菌在牛肉膏蛋白胨培养基平板上37 ℃活化24 h,挑取菌落加入MH培养液(Mueller-Hinton Broth)中,震荡培养6 h,稀释菌液至1.0×104~1.0×106CFU/mL备用。待测样品用二甲基亚砜(DMSO)溶解,用MH培养液稀释成200.0、100.0、50.0、25.0、12.5 μg/mL的待测溶液。空白组加入200 μL MH培养液,阳性组加入100 μL阳性药溶液和100 μL菌悬液,测试组加入100 μL待测样品溶液和100 μL菌悬液,生长组加入100 μL MH培养液和100 μL菌悬液。37 ℃条件下培养24 h后,用酶标仪测定530 nm下的OD值,每一组设置3个平行。MIC(最小抑菌浓度)值为菌液OD值下降一半的药物浓度,利用GraphPad Prism 5软件统计分析并计算MIC值和SD(标准差)值。
2 结果
2.1 结构鉴定
化合物1 白色固体;HR-ESI-MS:m/z257.078 7[M+Na]+(calcd for C13H14NaO4,257.078 4),推测分子式为C13H14O4。红外光谱3 444 cm-1和1 642 cm-1显示该化合物有羟基和羰基。
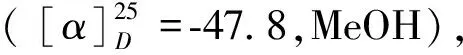

图2 化合物1~6的结构

图3 化合物1的关键HMBC信号

表1 化合物1的NMR数据(500 MHz和125 MHz,CD3OD)
化合物2白色固体;ESI-MS:m/z246.9[M-H]-,分子式为C14H16O4。1H NMR(500 MHz,CD3OD)δ:6.31(1H,br t,H-9),6.29(1H,br t,H-13),6.27(1H,br t,H-11),5.30(1H,s,H-5),4.54(1H,m,H-2),3.73(3H,s,H-15),3.45(2H,s,H-7),2.43(1H,dd,J=17.0,11.9 Hz,H-3a),2.39(1H,dd,J=17.1,5.2 Hz,H-3b),1.43(3H,d,J=6.4 Hz,H-14);13C NMR(125 MHz,CD3OD)δ:77.6(C-2),43.1(C-3),196.2(C-4),105.2(C-5),179.3(C-6),42.1(C-7),139.1(C-8),107.4(C-9),162.5(C-10),101.0(C-11),159.8(C-12),109.7(C-13),20.4(C-14),55.6(C-15)。以上数据与文献[7,8]报道基本一致,故鉴定化合物2为citreovirenone。
化合物3白色固体;ESI-MS:m/z142.1[M+H]+,分子式为C6H6O4。1H NMR(600 MHz,DMSO-d6)δ:9.05(1H,s,5-OH),8.02(1H,s,H-6),6.34(1H,s,H-3),5.66(1H,t,J=0.6 Hz,OH-7),4.29(2H,d,J=0.6 Hz,H-7);13C NMR(150 MHz,DMSO-d6)δ:168.2(C-2),109.9(C-3),174.0(C-4),145.8(C-5),139.3(C-6),59.5(C-7)。以上数据与文献[11]报道基本一致,故鉴定化合物3为曲酸。
化合物4黄色胶状物;ESI-MS:m/z397.2[M+H]+,分子式为C18H17ClO8。1H NMR(500 MHz,CDCl3)δ:10.93(1H,s,3′-OH),6.82(1H,br s,H-3),6.67(1H,br s,H-5),6.56(1H,s,H-4′),3.77(3H,s,H-7),3.72(3H,s,H-9),3.53(3H,s,H-9′),2.32(3H,s,H-7′);13C NMR(CDCl3,125 MHz)δ:139.9(C-1),123.2(C-2),114.5(C-3),151.1(C-4),106.1(C-5),151.0(C-6),56.8(C-7),166.7(C-8),52.6(C-9),159.9(C-1′),105.3(C-2′),154.1(C-3′),108.5(C-4′),144.2(C-5′),117.6(C-6′),21.1(C-7′),170.4(C-8′),52.4(C-9′)。以上数据与文献[12]报道基本一致,故鉴定化合物4为methyl chloroasterrate。
化合物5无色油状物;ESI-MS:m/z357.3[M+H]+,分子式为C19H16O7。1H NMR(600 MHz,CD3OD)δ:7.76(2H,d,J=8.7 Hz,H-13和H-17),7.09(2H,s,H-7和H-11),6.82(2H,d,J=8.7 Hz,H-14和H-16),6.34(1H,s,H-5),3.88(6H,s,H-18和H-19);13C NMR(150 MHz,CD3OD)δ:171.9(C-1),101.8(C-2),165.0(C-3),142.9(C-4),109.0(C-5),138.3(C-6),109.2(C-7/C-11),149.4(C-8/C-10),125.6(C-9),122.8(C-12),130.3(C-13/C-17),116.2(C-14/C-16),157.9(C-15),56.9(C-18/C-19)。以上数据与文献[13]报道基本一致,故鉴定化合物5为aspulvinone P。
化合物6无色油状物;ESI-MS:m/z349.3[M+Na]+,分子式为C18H14O7。1H NMR(600 MHz,CD3OD)δ:7.80(2H,d,J=8.6 Hz,H-13和H-17),7.47(1H,s,H-7),7.18(1H,dd,J=8.3,1.7 Hz,H-11),6.81(3H,d,J=8.5 Hz,H-11、H-14和H-16),6.36(1H,s,H-5),3.90(3H,s,H-18);13C NMR(150 MHz,CD3OD)δ:172.7(C-1),100.5(C-2),167.4(C-3),143.5(C-4),108.1(C-5),126.9(C-6),114.4(C-7),149.2(C-8),148.8(C-9),116.5(C-10),125.9(C-11),123.6(C-12),129.9(C-13/C-17),116.1(C-14/C-16),157.4(C-15),56.5(C-18)。以上数据与文献[13]报道基本一致,故鉴定化合物6为aspulvinone Q。
2.2 抗菌活性测试
对分得的化合物1~6进行了革兰氏阳性菌金黄色葡萄球菌、枯草芽孢杆菌和革兰氏阴性菌大肠杆菌的抗菌活性筛选,分别以青霉素和硫酸链霉素为阳性对照[14,15],结果见表2。化合物1对3株细菌无明显抗菌活性(MIC>100.0 μg/mL)。化合物3和4表现出一定的抑菌活性,MIC值在35.5到67.5 μg/mL之间。
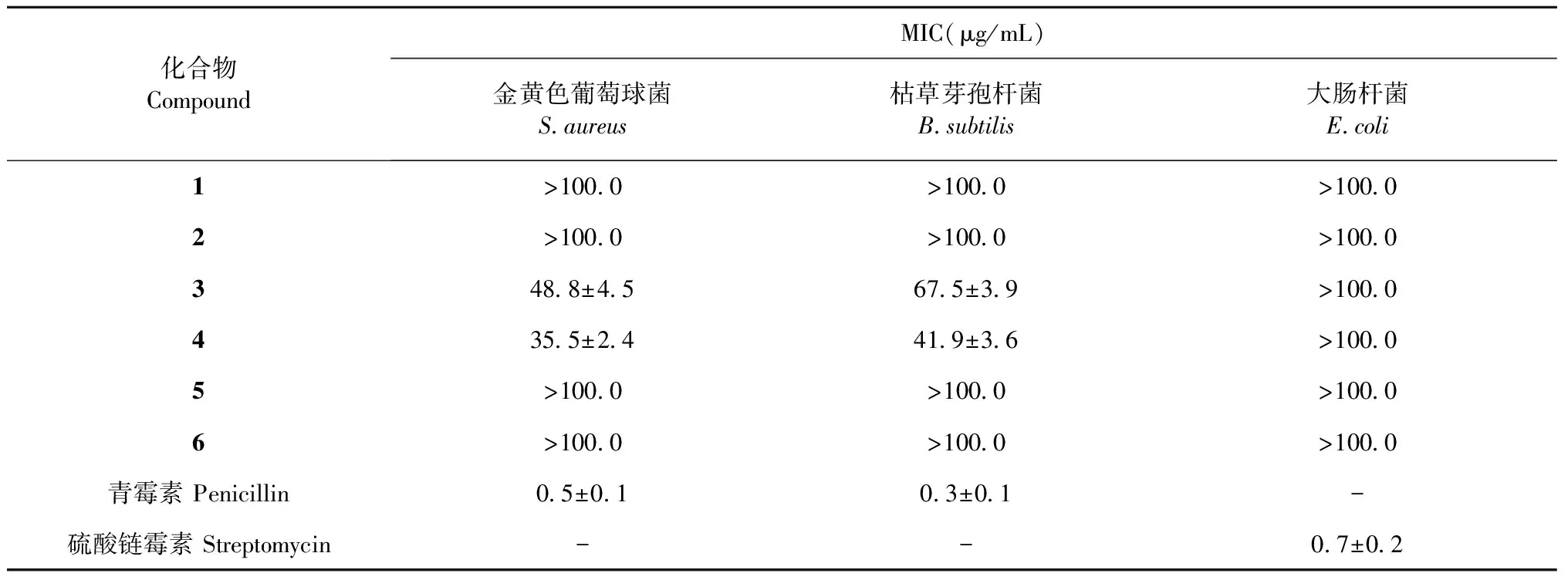
表2 化合物1~6的最小抑菌浓度
3 结论
本研究利用硅胶、MCI、凝胶柱色谱及半制备液相等方法对九香虫内生曲霉菌的次生代谢产物进行分离纯化,从中分离得到6个化合物,包括1个新化合物和5个已知化合物,均为聚酮类化合物,按照结构类型可以进一步细分为吡喃酮类、二苯醚类及丁内酯类。化合物1和2为首次从曲霉菌中分离得到。二苯醚类化合物4表现出一定的抗菌活性,文献也报道此类化合物有良好的抗菌活性,尤其是一些卤素取代的作用更强[14]。因此可以对该菌浸膏其他部分的此类化合物开展分离纯化,其中不乏具有活性突出的化合物值得探究。文献报道曲酸(3)具有良好的抗氧化及抗褐变生物活性,可以开展相关的生物活性研究[16,17]。曲霉属真菌被报道能合成多种结构类型的生物活性物质,但次生代谢产物为非必需物质,产量相对较低,后期可以通过大规模发酵、改良培养基、诱导生物合成及基因组学改造等技术对曲霉属真的菌次生代谢产物进行深入挖掘,以期获得更多的良好活性代谢产物,为合理开发利用虫生真菌资源提供参考。

