妊娠期糖尿病合并子痫前期血清Lipocalin-2、sFlt-1、PIGF水平变化及其临床意义
章薇
(华中科技大学同济医学院,湖北 武汉 430000)
妊娠期糖尿病(gestational diabetes mellitus,GDM)是一种常见的妊娠期并发症,我国的发病率约为5%,但近年来呈现逐渐上升趋势[1],若患者发病初期未及时诊治,极易引发子痫前期(preeclampsia,PE)等多种并发症。PE是一种特发性妊娠期高血压,是主要导致围产儿和孕产妇死亡率升高的原因,严重影响母婴生命健康[2]。有研究[3]显示,GDM合并PE发病率在6%左右。GDM合并PE的发病时间与对母婴的影响呈负相关,且发病机制较为复杂,可引发机体各系统重要脏器功能损害,严重危害母婴健康状况[4]。可溶性血管内皮生长因子受体1(sFlt-1)属于抗血管生成因子,具有酪氨酸激酶活性,对血管新生和内皮细胞增殖具有重要作用[5],而胎盘生长因子(PIGF)则属于促血管生成因子,可有效促进血管内皮细胞分化、滋养细胞增殖[6]。病理学研究[7]显示,PE患者中存在PIGF下降和sFlt-1上升,提示两者水平对于预测PE具有重要意义。脂质运载蛋白2(Lipocalin-2)属于脂肪细胞分泌的细胞因子,其与内皮功能异常、炎症反应、代谢反映等密切相关[8]。既往研究[9]表明,GDM合并PE发病与脂肪细胞因子关系密切。虽然上述研究结果均表明三因子与GDM合并PE发病有关,但关于三因子联合检测的研究却相对少见。本研究旨在探讨GDM合并PE血清sFlt-1、Lipocalin-2、PIGF水平变化及其临床意义。
1 资料与方法
1.1 一般资料
选取2017年12月至2019年12月华中科技大学同济医学院196例行孕前定期检查并分娩的单胎妊娠孕妇为研究对象,根据妊娠合并症情况分为A组(正常妊娠,n=51)、B组(妊娠合并GDM,n=74)和C组(GDM合并PE,n=71)。A组中初产妇28名,经产妇23名;B组中初产妇38例,经产妇36例;C组中初产妇37例,经产妇34例。本研究经医学伦理委员会批准,患者及家属知情同意。C组孕期体质量、舒张压、收缩压高于A组和B组(P<0.05);其他指标比较,差异无统计学意义(P>0.05)。见表1。C组再根据病情分为轻度PE(n=39)和重度PE(n=32)。纳入标准:(1)符合美国糖尿病协会制定75 g口服葡萄糖耐量试验标准[10]者;(2)符合我国现行妊娠期高血压疾病关于轻中度PE诊断标准[11]者。排除标准:(1)有内外科疾病史、手术史、酗酒吸烟史、输血史者;(2)合并免疫系统疾病者;(3)合并急慢性肝炎、慢性高血压、肾脏疾病、感染性疾病、内分泌疾病、红斑狼疮等疾病史者;(4)研究前3个月服用过影响脂代谢药物者;(5)合并精神疾病者。
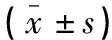
表1 各组患者一般资料比较
1.2 方法
3组均于定期检查日清晨空腹抽取静脉血4 mL,3 000 rpm离心10 min)分离血清后待检。采用酶联免疫吸附法(ELISA)检测血清sFlt-1、Lipocalin-2、PIGF水平,试剂盒均购自瑞士R&D Systems公司,操作步骤严格按照说明书进行。应用全自动生化分析仪检测24 h尿蛋白、游离脂肪酸(FFAs)、尿酸(UA)、三酰甘油(TG)水平。应用稳态模型法算出胰岛素抵抗指数(HOMA-IR),HOMA-IR=空腹胰岛素×空腹血糖/22.5。
1.3 观察指标
(1)A、B、C组sFlt-1、Lipocalin-2、PIGF、24 h尿蛋白、FFAs、UA、TG水平及HOMA-IR;(2)不同程度PE患者 sFlt-1、Lipocalin-2、PIGF、24 h尿蛋白、FFAs、UA、TG水平及HOMA-IR;(3)sFlt-1、Lipocalin-2、PIGF与24 h尿蛋白、FFAs、UA、TGshuping 及HOMA-IR的相关性。
1.4 统计学分析
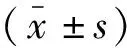
2 结果
2.1 各组sFlt-1、Lipocalin-2及PIGF水平比较
血清sFlt-1、Lipocalin-2水平比较,C组>B组>A组(P<0.05);血清PIGF水平比较,A组>B组>C组(P<0.05)。见表2。
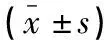
表2 各组血清sFlt-1、Lipocalin-2及PIGF水平比较
2.2 各组24 h尿蛋白、FFAs、UA、TG水平及HOMA-IR比较
24 h尿蛋白、FFAs比较,C组>B组>A组(P<0.05);C组UA、TG及HOMA-IR水平高于A、B组(P<0.05),但A、B组比较差异无统计学意义(P>0.05)。见表3。
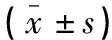
表3 各组24 h尿蛋白、FFAs、UA、TG水平及HOMA-IR比较
2.3 不同程度PE患者血清sFlt-1、Lipocalin-2、PIGF、FFAs、UA、TG水平及24 h尿蛋白、HOMA-IR比较
重度PE组患者血清sFlt-1、Lipocalin-2、FFAs、UA、TG及24 h尿蛋白、HOMA-IR水平高于轻度PE组;PIGF水平低于轻度PE组,差异均有统计学意义(P<0.05)。见表4。
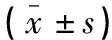
表4 不同程度PE患者血清 sFlt-1、Lipocalin-2、PIGF、FFAs、UA、TG水平及24 h尿蛋白、HOMA-IR比较
2.4 sFlt-1、Lipocalin-2、PIGF与24 h尿蛋白、FFAs、UA、TG及HOMA-IR的相关性
相关性分析显示,患者血清sFlt-1、Lipocalin-2水平与24 h尿蛋白、FFAs、UA、TG及HOMA-IR呈正相关(P<0.05);血清PIGF水平与上述指标呈负相关(P<0.05)。见表5。
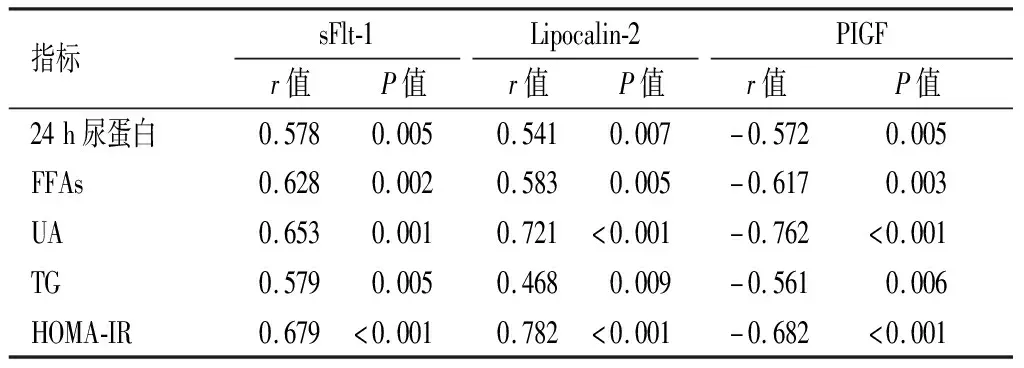
表5 sFlt-1、Lipocalin-2、PIGF与24h尿蛋白、FFAs、UA、TG及HOMA-IR的相关性分析
3 讨论
GDM合并PE患者内皮损伤和胰岛素抵抗加重,且有研究[12]显示,其较单纯GDM更易发生早产、巨大儿、新生儿窒息、畸形等,更有甚者发生母体多器官衰竭、死亡,严重影响预后。相关研究[13]表明,GDM合并PE患者产后易发生慢性低度炎症、尿蛋白、脂代谢功能障碍以及内皮功能紊乱,产后2年内2型糖尿病发病率也高于正常人。
PIGF位于人染色体14号,高度同源于血管内皮生长因子(VEGF),属于其家族的一员,是一种由血管内皮细胞和胎盘滋养细胞分泌的二聚体糖蛋白,能有效促进血管生成[14]。sFlt-1是PIGF和VEGF的拮抗剂,可促进血管的新生及内皮增殖[15]。有研究[16]证实,sFlt-1与PIGF和VEGF结合后无法将信号传至细胞内,阻断PIGF和VEGF的生物活性,导致血管生成障碍。Lipocalin-2广泛分布于人体肾、肺、肝等组织,有学者认为其与血管内皮损伤、免疫炎症反映及糖代谢紊乱有关。
本研究结果显示,GDM合并PE患者血清Lipocalin-2、24 h尿蛋白、FFAs水平较正常人升高(P<0.05),且GDM合并PE患者高于单纯GDM患者(P<0.05);GDM合并PE患者舒张压、收缩压大于单纯GDM、正常人(P<0.05);GDM合并重度PE患者Lipocalin-2、24 h尿蛋白、FFAs、UA、TG水平及HOMA-IR高于轻度PE患者(P<0.05),说明Lipocalin-2确实参加了疾病发生过程,可能是因为血管内皮损伤及胰岛素抵抗;相关分析结果也显示,Lipocalin-2与脂代谢各指标及HOMA-IR呈正相关(P<0.05),因此可通过胰岛素抵抗发生脂质紊乱、一氧化氮合成下降、高血糖,增加外周血管阻力,导致血压升高;而血管内皮细胞损伤也是导致PE的中心环节,血管内皮细胞损伤可持续增强胰岛素抵抗,进一步释放Lipocalin-2[17]。由此可见,GDM合并PE患者体内胰岛素抵抗及血脂代谢紊乱随疾病进展而增加,Lipocalin-2水平可反映疾病严重程度。本研究结果还发现,GDM、GDM合并PE患者血清sFlt-1水平较正常人升高(P<0.05),且GDM合并PE患者高于GDM患者(P<0.05);血清PIGF水平较正常人降低(P<0.05),且GDM合并PE患者低于GDM患者(P<0.05),与相关研究结果一致,提示血清sFlt-1、PIGF可能参与了PE的发病过程,这与两者比例失衡有关,sFlt-1明显升高,PIGF显著下降,导致血管迁移、形成均发生障碍,影响胎盘血管重塑,引发胎盘缺氧缺血,抑制PIGF分泌、合成,两者之间平衡被破坏,sFlt-1水平持续升高。相关性分析结果显示,患者血清sFlt-1水平与24 h尿蛋白、FFAs、UA、TG及HOMA-IR呈正相关(P<0.05),血清PIGF水平与上述指标呈负相关(P<0.05),表明其参加了GDM合并PE疾病的发生,可作为评估患者疾病严重程度的参考指标。本研究结果显示,GDM合并PE患者24 h尿蛋白、UA水平随着病情严重程度逐渐升高(P<0.05),提示患者可能存在肾功能异常状况。
综上,GDM合并PE患者血清sFlt-1、Lipocalin-2水平升高,PIGF水平降低,其水平与胰岛素抵抗、脂代谢紊乱相关,三者联合检测对早期预测肾功能损伤、GDM合并PE疾病有重要意义。

