肝细胞生长因子基因转染对骨质疏松骨愈合的影响及其作用机制
史凡祺,甄瑞鑫,郑鑫,刘世全,王媛媛
(承德医学院附属医院,1.微创脊柱外科;2.胃肠外科;3.胸外科;4.承德中心医院眼科,河北 承德 067000)
骨质疏松为绝经后女性群体常见代谢性疾病之一,主要表现为骨组织微结构损伤、易骨折、骨量下降以及骨脆性上升等[1]。骨折后所致长时间卧床较易造成一系列并发症发生,严重影响患者生活质量,严重者甚至威胁生活安全[1-2]。目前研究[3-4]显示,血管内皮生长因子、血小板衍生生长因子等细胞外信号分子可明显加快骨骼再生以及骨愈合进程。肝细胞生长因子(hepatocyte growth factor,HGF)是一种刺激肝细胞增殖物质,作为细胞外信号分子主要由间充质细胞分泌,可介导上皮-间充质相互作用[5]。HGF促有丝分裂作用可经由旁分泌与自分泌过程加速肌肉吸收与利用,发挥组织修复作用[6-7]。HGF可通过调节骨形态发生蛋白-2介导的核因子-κB信号通路促进骨再生而治疗骨折[8-9]。为明确HGF在骨愈合过程中作用及影响机制,本研究拟选择骨质疏松性骨折大鼠模型进行HGF基因转染。
1 材料和方法
1.1 实验动物、试剂及材料
健康雌性C57BL/6J大鼠(广东至远生物医药科技有限公司;SYXK(粤)2021-0251),周龄为8周,体质量(19.26±2.76)g,饲养环境温度为22~24 ℃与相对湿度52%~58%。DMEM/F12培养基购自Gibco,青霉素-链霉素、胰蛋白酶购自Hyclone,FuGENE HD Transfection Reagent购自普洛麦格(北京)生物技术有限公司,DNA质粒购自和元生物技术(上海)股份有限公司,荧光实时定量聚合酶链式反应(qPCR)引物及试剂购自Takare公司,其他试剂均为国产分析纯。
1.2 实验仪器
细胞培养箱购自上海富泽商贸有限公司,双能X线骨密度测量仪购自阿斯迈德生物科技(北京)有限公司,微型计算机断层扫描(μCT)仪购自瑞士Scanco Medical AG公司,万能力学测试机购自日本岛津公司,PCR仪购自瑞士Roche公司,离心机购自力康生物医疗科技有限公司。
1.3 方法
1.3.1 骨髓间充质干细胞(BMSCs)分离与培养 选择1只雌性健康SD大鼠以颈椎脱臼法将其处死,在无菌环境下收集大鼠胫骨与股骨,无菌磷酸盐缓冲溶液冲洗以保证骨表面软组织被完全清除,胫骨与股骨两端采用咬骨钳咬除,骨髓腔采用DMEM/F12培养基多次冲洗至髓腔发白,细胞悬液经多次吹打后以200目筛网过滤,过滤后收集细胞悬液,悬液经离心处理后再次重悬,以1.0×104个/mL接种至培养瓶,转移到细胞培养箱(37 ℃、5% CO2)中培养,培养48 h进行半换液,72 h予以全换液,其后换液频率为2 d。每天均需要在显微镜下观察细胞生长情况,至生长到瓶底面积的80%时需要以1∶3比例进行传代。
1.3.2 HGF慢病毒载体构建及转染 转染前1 d,BMSCs细胞需要以0.5×105个/mL转移至24孔板,应用无抗生素培养基培养1 d,保证转染前细胞融合率达至80%~90%。50 mL无血清DMEM/F12培养基中加入DNA质粒后匀混,再取50 mL无血清DMEM/F12培养基加入适量FuGENE HD Transfection Reagent混匀后在室温环境下孵育5 min,孵育结束后将两种无血清DMEM/F12培养基轻轻混合均匀,在室温环境下孵育25 min,24孔板中每孔添加上述混合物100 μL与适当体积培养基。细胞在加入混合物4~6 h后换液,再次培养18~48 h后应用显微镜观察细胞转染情况,并在72 h后收集最高转染效率细胞,调整细胞浓度至1.0×106个/μL进行后续研究。
1.3.3 骨质疏松骨折模型大鼠构建及分组 选择100只健康雌性SD大鼠,随机取其中80只构建骨质疏松模型大鼠,大鼠称重后采用以10 mg/kg剂量1%戊巴比妥钠进行麻醉处理,大鼠固定在操作台上,消毒铺巾后将皮肤、肌肉逐层切开,打开腹腔,沿着子宫方向向上寻找卵巢,结扎后将其切除,无菌生理盐水冲洗处理后将腹腔关闭,术后3 d内均采用青霉素钠处理以预防感染。另20只作为假手术组(Sham组)需切除等量脂肪,不切除卵巢。造模后大鼠单笼饲养于同一房间,环境、摄食以及饮水情况均相同,3个月后测定大鼠骨密度以判断大鼠是否建模成功。骨质疏松大鼠最终建模成功76只,随机分为四组,分别为模型组(Model组)、BMSCs组、空载慢病毒组(Vehicle组)与HGF慢病毒组(Vehicle+HGF组),每组均为19只。上述四组大鼠均以1%戊巴比妥钠麻醉后使左侧胫骨显露,于其上端1/2位置将胫骨剪断形成骨折,骨折后以克氏针髓内固定。大鼠BMSCs组、Vehicle组与Vehicle+HGF组,分别以1.0×106个/kg注入BMSCs、空载慢病毒-BMSCs、HGF慢病毒-BMSCs,而Sham组与Model组则注入等量生理盐水,各组在相同饲养条件下再次饲养1个月。
1.3.4 大鼠骨折愈合程度与骨密度测定 大鼠饲养结束后随机取5只应用X线侧位片及双能骨密度测定仪分别评估左侧胫骨骨折愈合情况与骨密度,骨折愈合程度按照X线结果进行评分[10],评分由3位影像科医师负责,最终骨折愈合评分结果为3位医师评估结果均值。
1.3.5 大鼠骨痂骨参数测定 取5只大鼠再全麻条件下穿刺心脏处理,收集左侧胫骨骨折标本。将收集大鼠胫骨骨折标本切成含有全部骨痂的块状物,其大小为10 mm,置于70%酒精中保存,采用micro-CT系统测定定量评估标本骨参数,主要包括骨痂感兴趣区平均断面面积、相对骨体积及百分比骨体积。
1.3.6 骨痂组织中骨愈合相关因子水平测定 取4只大鼠在全麻条件下穿刺心脏处理,收集左侧胫骨骨折标本,取骨折愈合位置组织,应用RNA提取试剂盒与反转录试剂盒获得cDNA,采用荧光实时qPCR测定骨痂组织中骨愈合相关因子骨碱性磷酸酶(BALP)、骨钙素(OCN)、转录因子抗体(OSX)、Runt相关转录因子2(Runx2)、基质金属蛋白酶13(MMP-13)等指标mRNA水平,依据Maxima SYBR Green qPCR Mastermix试剂盒说明书选择各反应物用量,反应条件设置为:95 ℃、95 ℃、60 ℃、72 ℃环境下分别预变性处理5 min、变性处理15 s、退火处理20 s、延伸处理30 s,共需要循环45次。引物序列见表1。

表1 基因引物序列
1.4 统计学分析
2 结果
2.1 五组大鼠骨折愈合程度评分与骨密度比较
Model组骨折愈合程度评分与骨密度低于Sham组(P<0.05);BMSCs组、Vehicle组与Vehicle+HGF组骨折愈合程度评分与骨密度均高于Model组(P<0.05);BMSCs组、Vehicle组骨折愈合程度评分及骨密度比较,差异均无统计学意义(P>0.05);Vehicle+HGF组骨折愈合程度评分与骨密度高于BMSCs组、Vehicle组(P<0.05)。见表2。
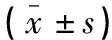
表2 五组大鼠骨折愈合程度评分与骨密度比较
2.2 五组大鼠骨痂骨参数比较
Model组平均断面面积、相对骨体积高于Sham组,百分比骨体积低于Sham组(P<0.05);BMSCs组、Vehicle组与Vehicle+HGF组平均断面面积、相对骨体积低于Model组,百分比骨体积高于Model组(P<0.05);BMSCs组、Vehicle组平均断面面积、相对骨体积及百分比骨体积比较,差异无统计学意义(P>0.05);Vehicle+HGF组平均断面面积、相对骨体积低于BMSCs组、Vehicle组,百分比骨体积高于BMSCs组、Vehicle组(P<0.05)。见表3。
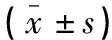
表3 五组大鼠骨痂骨参数比较
2.3 五组骨痂组织中骨愈合相关因子水平比较
Model组BALP、OCN、OSX、Runx2、MMP-13 mRNA低于Sham组(P<0.05);BMSCs组、Vehicle组、Vehicle+HGF组BALP、OCN、OSX、Runx2、MMP-13 mRNA高于Model组(P<0.05);BMSCs组、Vehicle组BALP、OCN、OSX、Runx2、MMP-13 mRNA比较,差异无统计学意义(P>0.05),Vehicle+HGF组BALP、OCN、OSX、Runx2、MMP-13 mRNA高于BMSCs组、Vehicle组(P<0.05)。见表4。
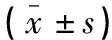
表4 五组骨痂组织中骨愈合相关因子水平比较
3 讨论
大鼠骨质疏松性骨折采用骨保护素基因修饰BMSCs处理后可显著抑制破骨细胞活性,保证大鼠骨代谢平衡,进而改善大鼠骨密度,显示基因治疗改善骨质疏松性大鼠骨代谢情况的疗效明确[11]。HGF为骨髓微环境细胞分泌重要生长因子,不仅可以在体内与体外介导成骨细胞增殖分化过程,还能够调节骨吸收以及新生过程[12]。BMSCs作为多向分化细胞,可在骨组织修复及再生方面发挥重要作用。既往研究[13-14]已证实,BMSC向成骨分化过程是骨质疏松性骨折愈合重要机制,因此本研究选择BMSCs作为HGF基因表达载体,以促进骨质疏松性骨折骨愈合。
骨愈合过程是一个应对骨损伤发生多阶段复杂修复过程,使损伤骨生物力学以及骨功能状态恢复正常是其最终目标[4]。骨质疏松性骨折愈合需要经历炎症期、软骨内骨化期以及骨痂重塑期三个阶段,软骨内成骨阶段是骨愈合重要阶段,可多向分化MSCs并促使其被大量聚集在骨折断端,然后在生长因子作用下分化成软骨细胞,分泌出大量软骨蛋白聚糖以及X型胶原以促进骨折位置形成软骨骨痂,随后成骨细胞侵入并进行分化,在骨基质分泌后使小梁骨矿化,最终形成骨性骨痂以使其断端连接[15-16]。软骨内骨化过程由BALP、OCN、OSX、Runx2、MMP-13等多种因子调节,其中,MMP-13是软骨细胞降解标志物,BALP、OCN、OSX、Runx2可反映成骨分化及矿化能力[17-18]。本研究中,相对于Sham组,Model组BALP、OCN、OSX、Runx2、MMP-13 mRNA等指标均明显下降,而HGF慢病毒转染则有效改善骨质疏松性骨折大鼠上述指标下降状态,显示HGF慢病毒转染可促进新骨形成,加速骨折组织软骨内骨化过程,这对于加快骨折愈合具有积极意义。国外研究者[19]也发现,在小鼠骨折模型中,HGF处理可调节成骨细胞和破骨细胞活力,发挥较显著的平衡成骨细胞和破骨细胞的比例作用,上调小鼠成骨细胞中p65、IκB激酶β和IκBα的表达,同时促进血管内皮生长因子、BMP-2受体、NF-κB配体受体激活剂和巨噬细胞集落刺激因子表达,表明HGF参与骨再生、血管生成以及成骨细胞和破骨细胞之间平衡。本研究对骨痂骨参数分析显示,HGF慢病毒转染可以有效改善骨痂骨参数,证实HGF慢病毒转染可以促进骨重塑和损伤骨组织形成致密新骨桥以连接骨折位置,改善骨痂力学性能,改善骨折愈合程度。另一项研究[20]显示HGF修饰牙髓来源的骨髓间充质干细胞可高度表达成骨相关基因,具有较强的成骨分化能力,还可显著减少卵巢摘除术构建骨质疏松模型大鼠股骨远端干骺端小梁骨骨丢失,表明采用HGF修饰牙髓来源的骨髓间充质干细胞可以有效减轻骨质疏松大鼠骨损伤,这与本研究中HGF基因转染可以促进骨质疏松性骨折大鼠骨愈合、改善大鼠骨密度结论类似。
综上,HGF基因转染可上调BALP、OCN、OSX、Runx2、MMP-13等骨愈合相关指标水平,促进骨重塑以及软骨内成骨形成,改善骨生物力学性能,进而促进骨质疏松性骨折大鼠骨愈合,可为骨质疏松性骨折治疗提供新思路。

