羽扇豆醇通过抑制NF-κB活化改善克雷伯菌感染大鼠肺损伤*
王强,何超,胡城,李莉,向萍
1.石首市人民医院,湖北 石首 434400; 2.荆州市职业技术学院附属医院,湖北 荆州 434020
肺炎克雷伯菌(klebsiella pneumoniae,KP)是最常见的革兰氏阴性病原体之一,可引起支气管肺炎和支气管炎,且常出现强耐药性[1-2]。克雷伯菌肺炎因其病情严重、并发症发生率高、死亡率高而成为主要的公共卫生威胁,即使采用抗菌药物治疗后,其死亡率也高达50%[3-5]。羽扇豆醇是一种三萜类化合物,主要存在于橄榄、杧果等水果中[6]。研究发现,羽扇豆醇具有抗炎和抗肿瘤等生物学作用[7-9]。但是,关于羽扇豆醇对肺部感染肺炎克雷伯菌大鼠的保护作用机制研究甚少。因此,本研究基于核因子κB(nuclear factor-kappa B,NF-κB)信号通路探讨羽扇豆醇对肺炎克雷伯菌大鼠肺损伤的影响,以期为羽扇豆醇应用于临床治疗肺炎克雷伯菌大鼠肺损伤提供实验依据。
1 材料
1.1 动物45只SPF级健康成年雄性SD大鼠,6~8月龄,体质量280~320 g,购自武汉贝赛模式生物科技有限公司,许可证号:SYXK(鄂)2021-0119。动物饲养于室温23 ℃,湿度55%的环境中,可自由饮水,12 h昼夜交替照明。本研究动物实验遵从国家有关实验动物保护规范和管理条例。
1.2 药物与试剂羽扇豆醇(美国Sigma公司,货号:L5632,纯度:99%);半胱氨酸天冬氨酸蛋白水解酶-3(Caspase-3)抗体、Caspase-9抗体、 B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)抗体、Bcl-2相关X蛋白(Bcl-2-associated X protein,Bax)抗体、p65抗体、p-P65抗体(英国Abcam公司,货号:ab13847、ab185719、ab32503、ab196495、ab16502、ab194726);HRP标记的小鼠抗兔二抗、γ-干扰素(interferon gamma,IFN-γ)抗体、白细胞介素-4(interleukin-6,IL-4)抗体、CD4抗体(美国Santa Cruz公司,货号:sc-2357、sc-52556 FITC、sc-53084 FITC、sc-13573 PE);抗IgG-FITC抗体、PE-anti-IgG1抗体(美国Sigma公司,货号:F1763、FCMAB230P);蛋白Marker、PierceTMBCA定量试剂盒(美国Thermo Fisher Scientific公司,货号:26616、23227);PVDF膜(美国Millipore公司,货号:IPVH00010);RIPA裂解液(强)、极超敏ECL化学发光试剂盒(上海碧云天生物技术有限公司,货号:P0013B、P0018FS);诱导型一氧化氮合成酶(inducible nitric oxide synthase,iNOS)试剂盒、巨噬细胞趋化蛋白-1(macrophage chemoattractant protein 1,MCP-1)测试盒、IL-10测试盒(南京建成生物工程研究所,货号:H372-1、H115、H009);TUNEL反应试剂盒(上海雅吉生物科技有限公司,货号:G001-1)。
1.3 仪器Olympus DP71型显微镜(日本Olympus公司);Microfuge22R型高速低温离心机(美国Beckman公司,离心半径13.5 cm);MedGraphics 1085D型肺功能仪器(美国麦加菲公司);Varioskan Flash型多功能酶标仪 (美国 Thermo Fisher Scientific公司);AMA440N型高压灭菌锅(英国Astell公司);MINI4型电泳槽、170-3940型电转仪(美国 Bio-Rad公司);GDS-800型凝胶成像系统(美国UVP公司)。
2 方法
2.1 克雷伯菌肺炎大鼠模型建立、动物分组与给药大鼠适应性喂养后随机分为对照组、模型组、羽扇豆醇低剂量组、羽扇豆醇中剂量组及羽扇豆醇高剂量组,每组各9只。除对照组外,其余组大鼠参照文献方法建立克雷伯菌肺炎大鼠模型[10],具体如下:大鼠经腹腔注射80 mg·kg-1氯胺酮麻醉,颈部消毒、备皮后,无菌操作,暴露大鼠上段气管,用 1 mL 注射器刺入气管并滴入浓度为1.2×109CFU·mL-1的菌液0.15 mL;对照组滴入相同体积的生理盐水。接种后立即竖立大鼠固定台,使大鼠保持直立位约20 s,以保证接种菌液因重力作用而入肺。观察造模后大鼠的临床表现,若体温升高,活动度及进食明显下降,体质量减轻,有明显的呼吸喘鸣声等则表明造模成功。所有大鼠均造模成功,第6天进行药物干预,羽扇豆醇低、中、高剂量组分别用10 mg·kg-1、20 mg·kg-1、50 mg·kg-1的羽扇豆醇腹腔注射给药,一次性给药剂量为1 mL,连续给药7 d。
2.2 大鼠肺功能的检测采用肺功能仪器测量各组大鼠的静息通气量、气道阻力改变和肺容积变换,并做好记录。
2.3 HE染色观察肺组织病理损伤取部分肺脏组织放入4%多聚甲醛溶液进行固定,24 h后脱水,石蜡包埋、切片;然后HE染色:将切片分别置于二甲苯Ⅰ和二甲苯Ⅱ及不同纯度(100%、95%、90%、80%、70%)的酒精中各10分钟,自来水冲洗;苏木精染色、伊红染色;由低到高浓度酒精梯度脱水,二甲苯透明,中性树脂封片;光学显微镜拍照,观察其形态特征。
2.4 TUNEL染色检测肺组织细胞凋亡首先对包埋的大鼠肺组织进行脱蜡、复水及抗原修复,然后使用TUNEL反应试剂盒,将配好的反应液滴于标本上,置于湿盒中,37 ℃孵育1 h。用PBS洗3次,每次 15 min,滴加合适浓度的ToPro荧光探针反应 15 min,然后再用PBS清洗3次,每次15 min。最后用中性树脂封片,显微镜下拍照记录。
2.5 流式细胞仪检测外周血辅助性T细胞1(helper T cell 1,Th1)和Th2的水平取1 mL抗凝混匀全血加入等量淋巴细胞分离液,各组均离心后分离外周血单个核细胞,随后加入红细胞裂解液将残余红细胞裂解,离心取沉淀,制成1×106mL-1的细胞悬液200 μL,并等量分到测定管与对照管中,测定管加入CD4抗PE抗体10 μL进行胞外染色,然后加10倍稀释的FACS溶血素2 mL进行溶血及破膜,最后分别加入IFN-γ抗体、IL-4抗体各 10 μL,对照管加入IgG-FITC抗体和PE-anti-IgG1抗体,混匀后室温避光30 min。每管加1%多聚甲醛500 μL,采用流式细胞仪进行检测。
2.6 ELISA检测外周血清iNOS、MCP-1、IL-10的含量严格按照大鼠iNOS、MCP-1、IL-10 ELISA试剂盒说明书操作步骤进行操作测定大鼠血清iNOS、MCP-1、IL-10的含量。
2.7 Western Blot检测凋亡及NF-κB相关蛋白的表达水平取适量肺脏组织,按13体积比加入含有蛋白酶抑制剂的RIPA裂解液进行匀浆,12 000 r·min-1离心10 min,取上清,根据 BCA 试剂盒说明书测蛋白浓度。匀浆上清液与上样缓冲液11配比,电泳,转膜,封闭,一抗(稀释比例为11 000) 4 ℃ 孵育过夜,二抗(稀释比例为1500)室温孵育1 h,TBST漂洗,ECL发光剂显影,采用 BIO-RAD Gel Doc XR+凝胶成像系统采集图像,用Image J2x 软件对各抗体条带灰度值进行统计。
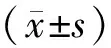
3 结果
3.1 羽扇豆醇对大鼠肺功能的影响与对照组比较,模型组静息通气量、气道阻力改变及肺容积变换均明显降低(P<0.05)。与模型组比较,羽扇豆醇中、高剂量组静息通气量、肺容积变换及气道阻力改变明显升高(P<0.05)。见表1。

表1 不同组大鼠的肺功能比较
3.2 羽扇豆醇对大鼠肺组织病理学的影响对照组肺脏胸膜完整,间质无水肿,无炎性细胞浸润,无充血,结构正常;模型组肺脏间质严重水肿,肺泡内出现大量炎性细胞和纤维素样物质沉积,组织局灶性坏死,肺泡壁明显增厚;与模型组比较,羽扇豆醇中、高剂量组肺组织病变程度明显减轻。见图1。

图1 不同组大鼠肺组织形态学变化(HE染色,×400)
3.3 羽扇豆醇对大鼠肺组织细胞凋亡的影响与对照组比较,模型组肺组织细胞凋亡率明显升高(P<0.05)。与模型组比较,羽扇豆醇中、高剂量组肺组织细胞凋亡率明显降低(P<0.05)。 见图2。
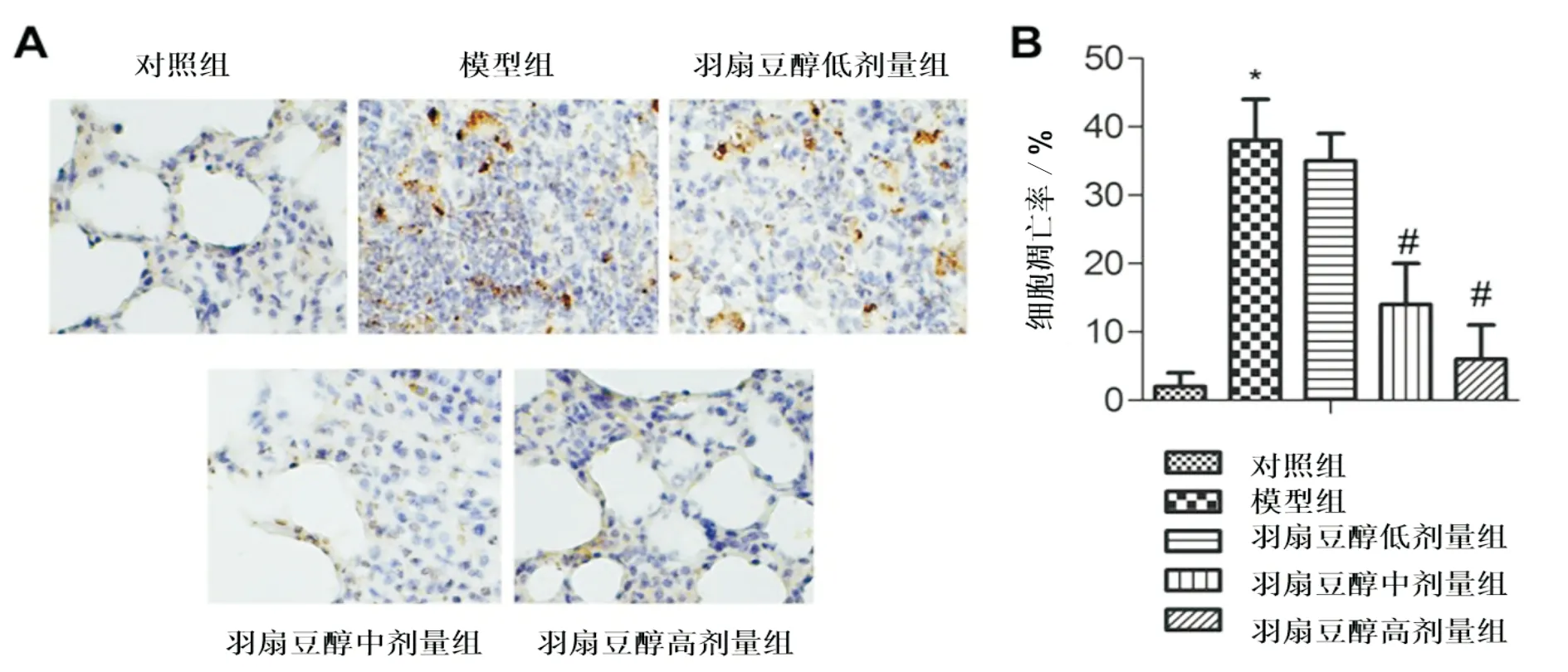
注:A:肺组织细胞凋亡TUNEL染色图(×400);B:肺组织细胞凋亡量化结果比较。与对照组比较,*P<0.05;与模型组比较,#P<0.05图2 不同组大鼠肺组织细胞凋亡率比较
3.4 羽扇豆醇对大鼠肺组织凋亡相关蛋白表达的影响与对照组比较,模型组Cleaved Caspase-3/Caspase-3、Cleaved Caspase-9/Caspase-9、Bax/Bcl-2的水平均明显升高 (P<0.05)。与模型组比较,羽扇豆醇中、高剂量Cleaved Caspase-3/Caspase-3、Cleaved Caspase-9/Caspase-9、Bax/Bcl-2的水平均明显降低 (P<0.05)。见图3。

注:A:凋亡相关蛋白条带;B:凋亡相关蛋白量化结果比较。与对照组比较,*P<0.05;与模型组比较,#P<0.05图3 不同组大鼠肺组织细胞凋亡相关蛋白表达水平比较
3.5 羽扇豆醇对大鼠外周血中Th1和Th2水平的影响与对照组比较,模型组Th1 (CD4+IFN-γ+) 水平明显升高 (P<0.05)。与模型组比较,羽扇豆醇中、高剂量组Th1 (CD4+IFN-γ+)水平均明显降低 (P<0.05);Th2 (CD4+IL-4+) 水平均明显升高 (P<0.05)。见图4。

注:A:流式细胞仪检测Th1、Th2的水平;B、C:Th1、Th2水平比较。与对照组比较,*P<0.05;与模型组比较,#P<0.05图4 不同组大鼠外周血中Th1、Th2水平比较
3.6 羽扇豆醇对大鼠血清中iNOS、MCP-1、IL-10 含量的影响与对照组比较,模型组iNOS、MCP-1含量均明显升高(P<0.05)。与模型组比较,羽扇豆醇中、高剂量组iNOS、MCP-1含量均明显降低(P<0.05),IL-10含量明显升高(P<0.05)。见表2。
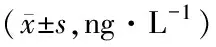
表2 不同组大鼠血清中iNOS、MCP-1、IL-10的含量比较
3.7 羽扇豆醇对NF-κB活化的影响与对照组比较,模型组P65磷酸化水平明显升高 (P<0.05)。与模型组比较,羽扇豆醇中、高剂量组P65磷酸化水平均明显降低 (P<0.05)。见图5。

注:与对照组比较,*P<0.05;与模型组比较,#P<0.05图5 不同组大鼠肺组织凋亡相关蛋白表达比较
4 讨论
在克雷伯菌肺炎模型中,病原体抵达下呼吸道,滋生繁殖,引起肺泡毛细血管充血、水肿、肺泡内纤维蛋白渗出及细胞浸润等炎性症状,产生大量炎症因子,加重体内炎症反应[11]。研究发现,肺部感染肺炎克雷伯菌后会出现大面积的炎症反应,肺泡实质和血管周围有明显的炎症浸润,肺泡壁增厚、水肿[12-13]。虽然,目前尚无关于羽扇豆醇对克雷伯菌肺炎作用的报道,但有学者研究发现羽扇豆醇能调节iNOS及IL-6、IL-1β等因子水平,缓解机体炎症,减轻组织损伤[14]。本研究发现,羽扇豆醇处理后,肺部感染肺炎克雷伯菌大鼠的静息通气量、肺容积变换及气道阻力改变均明显升高,肺组织病变程度减轻,表明羽扇豆醇可改善克雷伯菌肺炎大鼠肺损伤。
细胞凋亡是由细胞内凋亡相关基因直接调控,Bax、Bcl-2、caspase-9和caspase-3均在细胞凋亡过程中起着关键作用[15-16]。已有研究发现,在羽扇豆醇预处理的肝细胞中,Bax/Bcl-2的水平及Caspase-3和Caspase-9的蛋白表达水平降低,证实了羽扇豆醇体外调控细胞凋亡的作用[17]。同样,研究发现,羽扇豆醇可通过增强线粒体抗氧化应激抑制高糖诱导的髓核细胞凋亡,上调Bcl-2的表达,而下调Bax、caspase 9、caspase 3的表达[18]。本研究发现,模型大鼠给予羽扇豆醇处理后细胞凋亡率和Cleaved Caspase-3/Caspase-3、Cleaved Caspase-9/Caspase-9、Bax/Bcl-2的水平均明显降低,表明羽扇豆醇可抑制肺组织细胞凋亡,从而发挥肺保护作用,与已有的相关研究结果一致。
肺炎克雷伯菌感染可引起炎症细胞流入肺实质,并伴有促炎细胞因子和化学因子的释放,造成中性粒细胞聚集[19-20]。有研究发现,羽扇豆醇可诱导iNOS和NLRP3的mRNA表达水平下调,起到抗炎的作用[6,21]。而MCP-1可进一步干扰免疫系统的平衡,触发其他免疫细胞的浸润,加重炎症的严重程度[22]。Wang等报道羽扇豆醇可下调MCP-1的表达,上调抗炎因子IL-10的表达,从而减轻炎症[23]。Thl、Th2作为CD4+T的两个亚组,分泌不同的细胞因子,Thl细胞主要分泌IFN-γ,Th2主要分泌IL-4和IL-10[24]。有研究证实,羽扇豆醇处理后增加了Th2/Th1细胞因子的分泌比率,表明羽扇豆醇可能具有抗炎作用[25-26]。与前人研究结果一致,本研究发现羽扇豆醇处理后Th1 (CD4+IFN-γ+)水平和 iNOS、MCP-1含量降低;Th2 (CD4+IL-4+) 水平和IL-10含量升高,表明羽扇豆醇可减轻肺部炎症,改善肺部感染肺炎克雷伯菌所引起的肺损伤。
NF-κB是调节炎症最重要的转录调节因子,激活的NF-κB可转移到细胞核并与促炎基因启动子结合,导致基因表达和炎症反应增强,从而导致炎症损伤[27-28]。研究发现,羽扇豆醇对NF-κB信号通路具有抑制作用,IκBα磷酸化减弱[29-30]。与前人研究结果一致,本研究发现,羽扇豆醇处理后P65磷酸化水平降低,表明羽扇豆醇可有效抑制 NF-κB 的活化。
综上所述,羽扇豆醇可抑制NF-κB的活化,改善肺部感染肺炎克雷伯菌大鼠肺损伤,并减轻炎性反应,为羽扇豆醇应用于肺炎的临床防治提供理论依据。